糖尿病兔后囊膜混浊发生过程中血清及房水中AGE和IGF-1的变化及去整合素echistatin对二者的影响△
陈迎迎 谭少健 梁皓 钱光霞
糖尿病兔后囊膜混浊发生过程中血清及房水中AGE和IGF-1的变化及去整合素echistatin对二者的影响△
陈迎迎 谭少健 梁皓 钱光霞
后囊膜混浊;糖尿病;晚期糖基化终末产物;胰岛素样生长因子-1;去整合素
目的观察糖尿病兔后囊膜混浊(posterior capsule opacification,PCO)发生过程中血清及房水中晚期糖基化终末产物(advanced glycation end products,AGE)和胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)的含量变化,同时观察去整合素echistatin(Ecs)对二者的干预作用。方法将24只兔随机分为对照组、糖尿病组及Ecs组,后2组应用四氧嘧啶建立糖尿病模型,所有兔行晶状体摘出术,Ecs组术中晶状体囊袋内注入10 mg·L-1Ecs,其余2组注入等量高压灭菌蒸馏水。分别于术后10 d、6周提取3组血清及房水,应用ELISA法检测AGE和IGF-1含量。结果术后10 d房水中AGE浓度在三组中分别为(0.189±0.200)μg·L-1、(0.467±0.190)μg·L-1、(0.527±0.130)μg·L-1;6周为(0.255±0.640)μg·L-1、(0.716±0.340)μg·L-1、(0.830±0.330)μg·L-1。术后10 d血清中AGE浓度在对照组、糖尿病组和Ecs组中分别为(0.074±0.013)μg·L-1、(0.270±0.120)μg·L-1、(0.213±0.690)μg·L-1;6周为(0.054±0.010)μg·L-1、(0.166±0.460)μg·L-1、(0.149±0.200)μg·L-1。术后10 d房水中IGF-1浓度在3组中分别为(0.279±0.080)μg·L-1、(0.914±0.130)μg·L-1、(0.556±0.290)μg·L-1;6周为(0.176±0.030)μg·L-1、(0.508±0.040)μg·L-1、(0.367±0.090)μg·L-1。术后10 d血清中IGF-1浓度在对照组、糖尿病组和Ecs组中分别为(0.075±0.030)μg·L-1、(0.293±0.160)μg·L-1、(0.305±0.160)μg·L-1;6周为(0.032±0.020)μg·L-1、(0.833±0.570)μg·L-1、(0.788±0.530)μg·L-1。术后10 d及6周对照组血清及房水中AGE和IGF-1含量均低于糖尿病组及Ecs组(均为P<0.05)。糖尿病组及Ecs组中AGE含量比较,差异均无统计学意义(均为P>0.05),糖尿病组及Ecs组中IGF-1含量在血清中差异均无统计学意义(均为P>0.05),但在房水中Ecs组IGF-1含量明显低于糖尿病组(P=0.003、0.031)。结论AGE和IGF-1可能促进了糖尿病兔PCO的发生和发展,降低房水中IGF-1的含量可能是去整合素Ecs抑制PCO发展的机制之一。
[眼科新进展,2014,34(7):612-615]
已有研究报道糖尿病性白内障术后有更高的后发性白内障发生率[1-3],后发性白内障主要表现为后囊膜混浊(posterior capsule opacification,PCO)。血糖浓度升高[4],术后残留的晶状体上皮细胞(lens epithelium cells,LEC)出现多种整合素的高表达等因素都有促使LEC异常增殖、黏附和分化的作用,从而促进了PCO的发生发展[5]。近年研究发现LEC的过度增殖及异常分化也与房水内众多的细胞因子含量改变有关。为观察糖尿病并发症相关因子与PCO的关系,本文通过测定糖尿病兔PCO模型血清及房水中晚期糖基化终末产物(advanced glycation end products,AGE)和胰岛素样生长因子-1(insulin-like growth factor 1,IGF-1)含量,旨在探讨房水中这2种因子与糖尿病条件下PCO发生发展的相关性,并应用去整合素echistatin(Ecs)进行干预,观察其对AGE和IGF-1含量的影响。
1 材料与方法
1.1实验动物新西兰大白兔24只(购自广西医科大学实验动物中心),雌雄不限,体质量2.4~2.8 kg,眼部检查无异常。由广西医科大学实验动物中心提供。本实验动物的饲养与使用均遵循视觉与眼科学研究学会(ARVO)关于动物使用原则的规定,并且经广西医科大学动物伦理委员会批准。
1.2试剂与仪器去整合素Ecs(Sigma公司),四氧嘧啶(Sigma公司),ONE TOUCH血糖分析仪(美国强生),血糖试纸条(美国强生,稳豪型),长效胰岛素注射液(甘精胰岛素注射液,Sanofi-Aventis Deutschland GmbH,德国),兔AGE酶联免疫吸附法(ELISA)试剂盒(上海蓝基)、兔IGF-1 ELISA试剂盒(武汉华美),Multiskan MK3酶标仪(美国Thermo Scientific)。
1.3方法
1.3.1糖尿病兔模型的建立在24只新西兰大白兔中随机选择16只用四氧嘧啶按100 mg·kg-1耳缘静脉注射建立糖尿病兔模型,当血糖持续2周大于12 mmol·L-1时,为建模成功。对于血糖浓度高于16 mmol·L-1者,根据血糖值给予皮下注射长效胰岛素,使其血糖控制在12~16 mmol·L-1之间。其余8只兔子同期行左耳缘静脉注射等量高压灭菌蒸馏水,并同期测血糖。
1.3.2糖尿病兔PCO模型的建立和分组8只未建模且血糖正常兔设为对照组。16只建模成功的糖尿病兔16眼(右眼)随机分为糖尿病组和Ecs组,每组8只兔8眼。每只兔右眼由同一术者行透明晶状体囊外摘出术。术毕Ecs组晶状体囊袋内注入10 mg·L-1Ecs溶液0.2 mL,对照组和糖尿病组注入高压灭菌蒸馏水0.2 mL。术毕结膜下注射庆大霉素地塞米松注射液,术后用庆大霉素地塞米松眼液和阿托品眼液滴术眼7~10 d,每天4次。夜间涂四环素可的松眼膏,直至角膜水肿、前房渗出消失。
1.3.3酶联免疫吸附测定方法
1.3.3.1标本采集分别于术后10 d、6周随机抽取各组动物各4只,抽耳缘静脉血并提取血清 -80 ℃ 保存。并于耳缘静脉采血后空气栓塞法处死动物,处死后立即经角巩膜缘处以5号针头行前房穿刺,分别抽取房水0.1~0.2 mL,于-80 ℃保存。
1.3.3.2方法测定前从4 ℃冰箱取出AGE或IGF-1 ELISA试剂盒,开启前室温平衡30 min。取出房水或血清,室温融化,备用。严格按照说明书操作。终止反应后,测定在加入终止液后5 min内进行,在酶标仪上读取AGE波长450 nm和630 nm处的吸光度(A)值,IGF-1波长450 nm和570 nm处的吸光度(A)值,AGE OD值=A450-A630,IGF-1 OD值=A450-A570。根据标准浓度及对应的OD值计算出标准曲线的回归方程,再根据样品的OD值在回归方程上计算出对应的样品浓度。
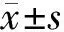
2 结果
2.1房水中AGE与IGF-1的浓度3组兔房水中AGE和IGF-1的浓度见表1,由表1可见:对照组房水中AGE的含量在术后10 d、6周时均低于糖尿病组(P=0.016、0.041)和Ecs组(P=0.006、0.015),但糖尿病组和Ecs组房水中AGE的含量差异均无统计学意义(P=0.905、0.567);对照组房水中IGF-1的含量在术后10 d、6周时亦均低于糖尿病组(P<0.000、=0.001)和Ecs组(P=0.011、0.009),Ecs组房水中IGF-1含量在各时间点均低于糖尿病组(P=0.003、0.031)。

表1 3组兔房水中AGE与IGF-1浓度的比较Table 1 AGE and IGF-1 concentrations in aqueous humor of three groups(±s,ρ/μg·L-1)
2.2血清中AGE与IGF-1的浓度3组兔血清中AGE和IGF的浓度见表2,由表2可见:对照组血清中AGE的含量在术后10 d、6周时均低于糖尿病组(P=0.008、<0.000)和Ecs组(P=0.039、0.001),糖尿病组和Ecs组血清中AGE的含量差异无统计学意义(P=0.352、0.430);对照组血清中IGF-1的含量在术后10 d、6周时亦均低于糖尿病组(P=0.044、0.032)和Ecs组(P=0.036、0.040),糖尿病组和Ecs组的IGF-1含量差异均无统计学意义(P=0.905、0.891)。

表2 3组兔血清中AGE与IGF-1浓度的比较Table 2 AGE and IGF-1 concentrations in serum of three groups(±s,ρ/μg·L-1)
3 讨论
我们的前期研究表明糖尿病兔较正常血糖兔更早出现PCO[6],同时发现使用去整合素Ecs可有效降低糖尿病兔PCO分级,抑制PCO的发展。糖尿病并发症相关的致病因子是否促进了糖尿病PCO的发展、去整合素Ecs是否通过对上述因子的调控从而发挥抑制PCO的作用尚未见相关文献报道。
AGE是糖尿病并发症发生发展的重要因素。目前,AGE在眼部的致病作用日益受到重视[7]。AGE指还原糖如葡萄糖的醛基或酮基与蛋白质、脂质或核酸的氨基发生非酶糖化反应,最终生成不可逆的高级糖化终产物,并且由于受血糖浓度的影响,形成后不易降解,可在糖尿病患者个体中积聚,表现出致病作用。高血糖、炎性反应等因素可促进AGE的形成[8]。房水中的AGE以及眼组织中的长寿蛋白糖化形成的AGE与其受体相互作用,导致糖尿病相关的角膜、白内障、视网膜等病变[7]。本研究表明糖尿病兔行晶状体摘出术后,其血清及房水中AGE含量均高于非糖尿病兔。这与Lu等[4]的体外实验结果一致,该实验发现高糖条件下培养的LEC中AGE水平提高,提示AGE可能参与了糖尿病相关的白内障的发生和发展。在活体内,糖尿病循环血中高含量的AGE沉积在眼部以及术后炎性反应刺激均造成糖尿病兔房水中AGE含量的增高。Hong等[9]报道AGE可促进LEC纤维化改变,使纤连蛋白、Ⅰ型胶原、肌纤维母细胞及异常细胞外基质的合成增加。罗怡等[10]报道AGE可诱导体外培养的LEC中转化生长因子-β(transforming growth factor-β,TGF-β)上调,而TGF-β是促进LEC发生间质转分化的最重要因子之一[5]。因此糖尿病兔晶状体摘出术后在房水中大量堆积的AGE可能通过上调TGF-β的表达发挥了促LEC间质转分化的作用,从而促进PCO的发生和发展。
有研究表明AGE与整合素存在关联:在糖尿病肾病研究中发现AGE通过β1整合素及其下游分子FAK途径诱导细胞外基质表达增加,促进细胞黏附、增殖。AGE也可通过趋化与活化单核巨噬细胞等细胞增加细胞因子的分泌和释放,包括TGF-β、血小板衍性生长因子等可上调β1整合素及FAK的表达[11]。但在本实验中并未观察到β1整合素的特异性拮抗剂—去整合素Ecs的干预对AGE造成明显的影响,其含量与单纯糖尿病组的差异并无统计学意义。有可能是AGE与整合素是单向调节的关系,即AGE可调控整合素的表达,但整合素对AGE并无反馈调节作用。我们的前期实验表明去整合素Ecs既可有效抑制体外培养的LEC增殖、迁移、黏附[3],也可有效降低糖尿病兔PCO的分级[12]。结合Ecs对AGE的实验结果可以推测Ecs上述抑制PCO的作用可能并非通过影响AGE而实现的。
IGF-1是一类具有胰岛素类似结构和生理功能的多肽,既有促细胞分化和增殖功能,同时又是细胞凋亡的一个重要抑制因子。在晶状体研究中发现糖尿病白内障患者房水中IGF-1含量高于非糖尿病患者,其参与了糖尿病性白内障的形成。本研究证实糖尿病兔在晶状体摘出术后其血清及房水中的IGF-1含量高于非糖尿病兔。其原因可能是手术损伤导致IGF-1表达上升,使前房局部内源性的IGF-1分泌增加;同时高糖使晶状体内环境代谢失衡,导致血-房水屏障的破坏[13],使血清中进入房水的外源性IGF-1也增加。由于房水中的IGF-1可促进LEC的增殖,减少LEC的凋亡[14-16],而且IGF-1与LEC上的IGF-1受体结合后可触发caspase-3介导的LEC转分化过程[17-18],因此糖尿病兔晶状体摘出术后房水中含量增高的IGF-1可能加强了其在眼内的促LEC增殖、分化及抗凋亡的作用,从而促进了PCO的发生和发展。
有实验表明IGF-1在促进细胞黏附、增殖、分化中所起的作用是通过生物信号转导,激活了PI3K和MARK两条途径,而这也包括了整合素的参与。Lynch等[19]研究发现由IGF-1受体介导乳腺癌细胞的黏附和转移是通过β1亚单位的整合素发挥作用的。Fujita等[20]研究表明整合素αvβ3与IGF-1及其受体结合形成αvβ3-IGF1-IGF1R三复合体是激活IGF-1信号通路的必要条件。在本实验中,在糖尿病兔晶状体摘出术后的眼前房注入去整合素Ecs虽然没有引起血清中IGF-1含量的明显变化,但影响了房水中IGF-1的表达,无论是术后10 d还是6周,Ecs组房水中IGF-1的含量均低于糖尿病组。提示Ecs影响PCO的发生发展可能与降低IGF-1的表达相关。
综上所述,本实验表明糖尿病兔晶状体摘出术后血清和房水中AGE和IGF-1含量均高于正常血糖兔,提示二者可能对糖尿病更早出现的PCO发挥了一定的促进作用。术中囊袋内注入去整合素Ecs可有效抑制房水中IGF-1的表达,这可能与Ecs抑制PCO的发生和发展的机制有关。本实验初步探讨了糖尿病活体模型中可能参与PCO发展的糖尿病相关因素以及去整合素Ecs防治糖尿病性PCO的机制,为进一步明确糖尿病条件下PCO发生发展机制以及疾病防治的深入研究提供了一定的实验基础。
1 Ebihara Y,Kato S,Oshika T,Yoshizaki M,Sugita G.Posterior capsule opacification after cataract surgery in patients with diabetes mellitus[J].JCataractRefractSurg,2006,32(7):1184-1187.
2 Elgohary MA,Hollick EJ,Bender LE,Heatley CJ,Wren SM,Boyce J,etal.Hydrophobic acrylic and plate-haptic silicone intraocular lens implantation in diabetic patients:pilot randomized clinical trial[J].JCataractRefractSurg,2006,32(7):1188-1195.
3 周星,谭少健,梁皓,陈迎迎,李霞.去整合素 echistatin 对人晶状体上皮细胞增生、黏附、移行的影响[J].中华实验眼科杂志,2013,31(4):320-324.
4 Lu Q,Yang T,Zhang M,Du L,Liu L,Zhang N,etal.Preventative effects of Ginkgo biloba extract(EGb761) on high glucose-cultured opacity of rat lens[J].PhytotherRes,2014,28(5):767-773.
5 Walker J,Menko AS.Integrins in lens development and disease[J].ExpEyeRes,2009,88(2):216-225.
6 丁文君,韦琦,梁皓,陈金印,李霞,谭少健.糖尿病兔后发性白内障发生过程中晶状体上皮细胞增殖的变化[J].眼科新进展,2012,32(1):5-7.
7 陈颖,杜之渝.糖基化终末产物在眼部疾病中的作用[J].眼科研究,2008,26(4):280-282.
8 Herold K,Moser B,Chen Y,Zeng S,Yan SF,Ramasamy R,etal.Receptor for advanced glycation end products(RAGE) in a dash to the rescue:inflammatory signals gone awry in the primal response to stress[J].JLeukocBiol,2007,82(2):204-212.
9 Hong SB,Lee KW,Handa JT,Joo CK.Effect of advanced glycation end products on lens epithelial cellsinvitro[J].BiochemBiophysResCommun,2000,275(1):53-59.
10 罗怡,吴继红,张圣海,徐萍,卢奕.老年性白内障合并2型糖尿病患者晶状体上皮细胞转化生长因子β表达及其与晚期糖基化终末产物的相关性[J].中国眼耳鼻喉科杂志,2010,10(4):212-214.
11 Xu Z,Ma DZ,Wang LY,Su JM,Zha XL.Transforming growth factor-beta1 stimulated protein kinase B serine-473 and focal adhesion kinase tyrosine phosphorylation dependent on cell adhesion in human hepatocellular carcinoma SMMC-7721 cells[J].BiochemBiophysResCommun,2003,312(2):388-396.
12 陈迎迎,谭少健,梁皓,钱光霞.去整合素Echistatin对糖尿病兔后发性白内障模型中晶状体上皮细胞间质转分化及胶质合成的影响[J].眼科新进展,2014,34(4):306-309.
13 何花,张虹,罗爱珍.糖尿病性白内障晶状体上皮细胞凋亡与增殖特性的实验研究[J].眼科新进展,2003,23(5):323-327.
14 Iyengar L,Patkunanathan B,McAvoy JW,Lovicu FJ.Growth factors involved in aqueous humour-induced lens cell proliferation[J].GrowthFactors,2009,27(1):50-62.
15 Kampmeier J,Baldysiak-Figiel A,de Jong-Hesse Y,Lang GK,Lang GE.Effect of growth factors on proliferation and expression of growth factor receptors in a human lens epithelial cell line[J].JCataractRefractSurg,2006,32(3):510-514.
16 丁小艳,张林,马波,王丛毅,吴利安.胰岛素样生长因子-1对人晶状体上皮细胞增殖的影响[J].新乡医学院学报,2012,29(9):653-655.
17 Chandrasekher G,Sailaja D.Phosphatidylinositol 3-kinase(PI-3K)/Akt but not PI-3K/p70 S6 kinase signaling mediates IGF-1-promoted lens epithelial cell survival[J].InvestOphthalmolVisSci,2004,45(10):3577-3588.
18 Basu S,Rajakaruna S,Menko AS.Insulin-like growth factor receptor-1 and nuclear factor kappaB are crucial survival signals that regulate caspase-3-mediated lens epithelial cell differentiation initiation[J].JBiolChem,2012,287(11):8384-8397.
19 Lynch L,Vodyanik PI,Boettiger D,Guvakova MA.Insulin-like growth factor 1 controls adhesion strength mediated by alpha5beta1 integrins in motile carcinoma cells[J].MolBiolCell,2005,16(1):51-63.
20 Fujita M,Takada YK,Takada Y.Insulin-like growth factor(IGF) signaling requires alphavbeta3-IGF1-IGF type 1 receptor(IGF1R) ternary complex formation in anchorage independence,and the complex formation does not require IGF1R and Src activation[J].JBiolChem,2013,288(5):3059-3069.
date:Mar 20,2014
National Natural Science Foundation of China(No:81160120)From theDepartmentofOphthalmology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,GuangxiZhuangAutonomousRegion,China
Levels of AGE and IGF-1 in serum and aqueous humor of posterior capsular opacification models in diabetic rabbits and effects of disintegrin echistatin on them
CHEN Ying-Ying,TAN Shao-Jian,LIANG Hao,QIAN Guang-Xia
posterior capsular opacification;diabetes;advanced glycation end products;insulin-like growth actor-1;disintegrin
ObjectiveTo investigate the levels of advanced glycation end products (AGE) and insulin-like growth factor-1 (IGF-1) in serum and aqueous humor of posterior capsular opacification in diabetic rabbits,and observe the effects of disintegrate echistatin (Ecs) on them.MethodsTwenty-four New Zealand white rabbits were randomly divided into three groups:control group,diabetic group and Ecs group.The rabbits of diabetic group and Ecs group were treated with ear vein injection of alloxan.The rabbits of control group were given the same volume of sterilization distilled water.After the model constructed,all the rabbits were implemented lens extraction surgery.During the surgery,the rabbits of control group and diabetic group were injected with sterilization distilled water into lens capsular bags and the Ecs group was injected with 10 mg·L-1Ecs.The serum and aqueous humor of rabbits were extracted at 10 days and 6 weeks after surgery,and the levels of AGE and IGF-1 were determined using enzyme-linked immunosorbent assay (ELISA) technique.ResultsTen days after surgery,AGE concentration in serum of the control group,diabetes group and Ecs group were (0.074±0.013) μg·L-1,(0.270±0.120) μg·L-1,(0.213±0.690) μg·L-1,respectively,which at 6 weeks after surgery were (0.054±0.010) μg·L-1,(0.166±0.460) μg·L-1,(0.149±0.200) μg·L-1,respectively.Ten days after surgery,AGE concentration in aqueous humor of the control group,diabetes group and Ecs group respectively were (0.189±0.200) μg·L-1,(0.467±0.190) μg·L-1,(0.527±0.130) μg·L-1,respectively,which at 6 weeks after surgery were (0.255±0.640) μg·L-1,(0.716±0.340) μg·L-1,(0.830±0.330) μg·L-1,respectively.Ten days after surgery,IGF-1 concentration in serum of the control group,diabetes group and Ecs group respectively were (0.075±0.030) μg·L-1,(0.293±0.160) μg·L-1,(0.305±0.160) μg·L-1,respectively,which at 6 weeks after surgery were (0.032±0.020) μg·L-1,(0.833±0.570) μg·L-1,(0.788±0.530) μg·L-1,respectively.Ten days after surgery,IGF-1 concentration in aqueous humor of the control group,diabetes group and Ecs group respectively were (0.279±0.080) μg·L-1,(0.914±0.130) μg·L-1,(0.556±0.29) μg·L-1,respectively,which at 6 weeks after surgery were (0.176±0.030) μg·L-1,(0.508±0.040) μg·L-1,(0.367±0.090) μg·L-1,respectively.The levels of AGE and IGF-1 in serum and aqueous humor of rabbits in control group at 10 days or 6 weeks after surgery were lower than those in diabetic group and Ecs group(allP<0.05).There was no difference in AGE levels in serum or aqueous humor between diabetic group and Ecs group (allP>0.05).The IGF-1 levels in aqueous humor in Ecs group was lower than those in diabetic group (P=0.003,0.031),but there was no difference in serum between two groups (allP>0.05).ConclusionAGE and IGF-1 may promote the occurrence and development of posterior capsular opacification in diabetic rabbits,and lower IGF-1 levels in the aqueous humor may be one of the mechanisms that disintegrin Ecs inhibiting the development of posterior capsular opacification in diabetic rabbits.
陈迎迎,女,1978年10月出生,广西横县人,在读博士研究生,副主任医师。主要研究方向为晶状体疾病。联系电话:0771-5356507(O);E-mail:chenyingying_cyy@163.com
AboutCHENYing-Ying:Female,born in October,1978.Doctoral candidate,associate chief physician.Tel:+86-771-5356507(O);E-mail:chenyingying_cyy @ 163.com
2014-03-20
国家自然科学基金项目(编号:81160120)
530021 广西南宁市,广西医科大学第一附属医院眼科
谭少健,E-mail:shaojiantan@163.com
陈迎迎,谭少健,梁皓,钱光霞.糖尿病兔后囊膜混浊发生过程中血清及房水中AGE和IGF⁃1的变化及去整合素echistatin对二者的影响[J].眼科新进展,2014,34(7):612⁃615.
10.13389/j.cnki.rao.2014.0168
【实验研究】
修回日期:2014-04-21
本文编辑:方红玲
Accepteddate:Apr 21,2014
Responsibleauthor:TAN Shao-Jian,E-mail:shaojiantan@163.com
[RecAdvOphthalmol,2014,34(7):612-615]

