前列腺素E2对新生大鼠呼吸影响的机制研究*
成 问,孙明洁,王儒蓉,芶大明
(1.四川大学华西医院麻醉科,四川 成都610041;2.遵义医学院麻醉系,贵州 遵义563003)
新生儿尤其是早产儿,常出现周期性呼吸,甚至呼吸暂停等呼吸功能紊乱,是新生儿群体中一个重要的医学问题之一。然而新生儿期易发生呼吸暂停的病因目前仍不清楚。前列腺素E2(prostaglandin E2,PGE2)是一种前炎症介质,在气道炎症反应时,对气道的平滑肌和神经起一定的调节作用[1]。已有研究发现,发生呼吸暂停的新生儿尿中前列腺素代谢产物的含量与呼吸暂停的次数呈正相关[2];婴儿期脑脊液中的感染性标志物C反应蛋白与PGE2增高的水平有关[3]。以前的研究发现,新生大鼠右心房注射PGE2可产生明显的呼吸暂停[4],但其具体作用机制尚不明确。本实验目的是观察新生期大鼠右心房注射PGE2引起呼吸改变的作用机制。
1 材料和方法
1.1 实验动物 出生后7~9天的SD大鼠,雌雄不限,购买于四川大学华西医院实验动物中心。
1.2 实验方法
1.2.1 动物准备 大鼠在0.3%苯巴比妥钠(50mg/kg,腹腔注射)麻醉后行气管切开插管,保留自主呼吸。麻醉深度以轻轻夹尾有无体动反应来判断,无体动反应认为麻醉深度合适。麻醉维持通过间断追加0.3%苯巴比妥钠(15mg/kg,腹腔注射)。右侧颈外静脉切开置管至上腔静脉近右心房,以注射各种试剂,导管长度以测量插管处至心尖搏动处来进行估计,实验结束后以尸检验证。持续监测体温并用加热灯维持大鼠直肠温度在37.5℃左右。若因麻醉或手术因素导致呼吸频率低于75次/分者排除出实验。每次颈静脉推注药物前以同样的速度给予等量溶剂作为对照。根据体重给予0.25μg/kg的PGE2,给予的容量是0.05ml,控制容量一定而浓度随剂量不同而变化,以减少容量改变可能对呼吸产生的影响。推注的时间控制在3秒以内。
1.2.2 实验分组 将24只7~9天(P7~9)大鼠平均分为3组,从右心房第一次推注0.25μg/kg PGE2,待30min后,分别从右心房注射辣椒平8μg/kg(辣椒素受体拮抗剂),S-3144 0.1mg/kg(P物质受体拮抗剂),AH6809 5mg/kg(EP2受体拮抗剂),待15min后第二次从右心房推注0.25μg/kg PGE2,观察右心房注射拮抗剂前后即第1次和第2次同量PGE2对呼吸的影响。
1.3 数据采集和分析 实验中将气管切开插管连接到呼吸流量头,经呼吸放大器,将呼吸的原始信号输入装有Power Lab Chart5/PowerLab 8SP数据采集计算系统(ADInstruments,CastleHill,Australia),对数据进行采集记录和分析,得到呼吸频率(f)、吸气时间(Ti)、呼气时间(TE)等参数。将TE延长3倍以上定义为呼吸暂停。
1.4 统计学方法 数据用±s表示,用SPSS 13.0进行统计分析。组间比较采用独立样本t检验,组内比较采用配对t检验。两组以上比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
在辣椒平、S-3144、AH6809 3组中,第1次(first injection)和第2次(second injection)注射PGE2后均出现呼吸暂停,但在辣椒平和S-3144两组中,第1次和第2次注射PGE2引起的呼气延长时间无统计学差异(P>0.05),而在AH6809组中,两次呼气延长时间之间存在统计学差异(P<0.05),利用AH6809拮抗后,呼气延长时间比拮抗前缩短,约42%,见图1。3组之间在推注PGE2前的呼吸频率(f)和呼气时间(TE)之间并无统计学差异(P>0.05),见图2;产生呼吸暂停的潜伏期以及推注药物时间在3组间无统计学差异(数据未显示)。
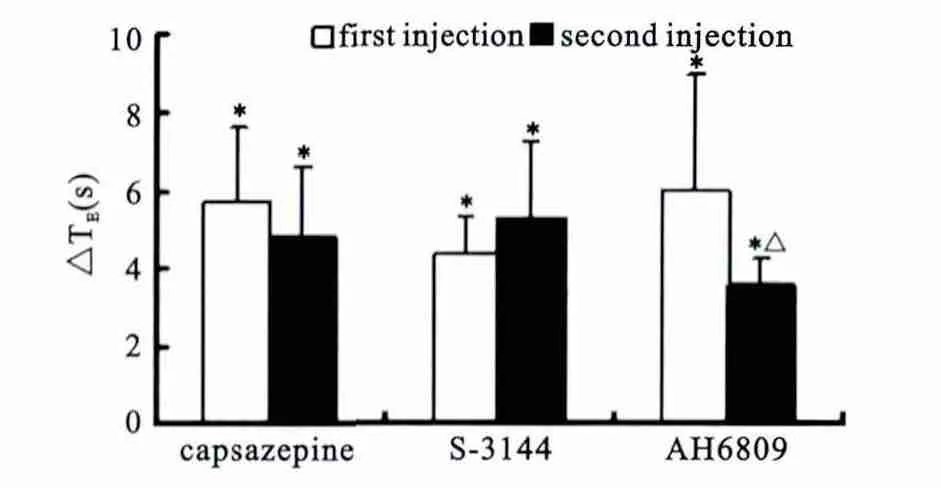
图1 右心房注射辣椒平、S-3144、AH6809前后注射PGE2所引起呼气时间的变化Figure 1 The ventilatory alterations caused by injection of PGE2before and after capsazepine,S-3144and AH6809injection from the right atrium.

图2 右心房注射辣椒平、S-3144、AH6809前各组基础值比较Figure 2 The comparison of basic values before the right atrial injection of capsazepine,S-3144and AH6809
3 讨论
早产儿呼吸暂停是儿科常见症状之一,起病急,可反复发生,导致中枢神经系统损害,最常见的为痉挛性脑性瘫痪和(或)耳聋[5]。研究表明,早产儿呼吸暂停多属原发性,与中枢神经的发育不成熟密切相关;足月儿多为继发性,与窒息、感染等基础疾病有关[6]。目前确切的发病机制还不清楚,近年来前列腺素样物质在发病中的作用日益受到关注。研究发现,呼吸暂停发生者尿中前列腺素代谢产物(PGE-M)的浓度明显高于对照组,且呼吸暂停发生次数与尿中PGE-M浓度呈正相关,提示内源性前列腺素样物质可能在呼吸暂停的发病过程中起作用[2];婴儿期脑脊液中的炎性标志物与PGE2的增高水平有关,PGE2与呼吸暂停发生的频率相关联,暗示炎症抑制呼吸是通过PGE2的生物合成与中枢活动所引起的[3]。
前列腺素E2广泛存在于组织细胞中,是花生四烯酸经环氧合酶途径代谢产生的一种前炎症介质。在气道炎症反应时,肺泡的上皮细胞、巨噬细胞等可产生并释放前列腺素,对气道平滑肌和神经起一定的调节作用。有研究表明,PGE2在胎儿期和新生期羊能够抑制呼吸[7],且抑制体外呼吸相关性神经元[8]。当PGE2合成受到抑制后,呼吸活动增加[9]。研究证实,静脉注射或吸入辣椒素可通过刺激肺C类神经纤维产生呼吸暂停或咳嗽反射[10];在成年大鼠静脉持续输注前列腺素E2可增强肺C类纤维对右心房注射辣椒素的敏感性,明显延长辣椒素所产生的呼吸暂停,而其本身并不产生呼吸暂停作用[11]。本实验结果发现,在出生后7~9天大鼠右心房注射前列腺素E2产生了长时间呼吸暂停。我们之前的研究发现在出生后7~9天和21~23天大鼠右心房注射0.25μg/kg前列腺素E2后均产生长时间呼吸暂停,其呼气时间延长约7.5~9倍,且在7~9天大鼠前列腺素E2产生的呼吸暂停时间大于21~23天大鼠[4]。因此,本实验选用了出生后7~9天的SD大鼠来探讨其呼吸暂停的机制。辣椒平(Capsazepine)是一种合成的辣椒素受体拮抗剂,可特异地抑制辣椒素的作用。Oh等用组织培养的感觉细胞进行实验发现,辣椒平可阻断辣椒素激活的单通道电流,说明辣椒平是直接作用于辣椒素受体的。在体实验中也得出了辣椒平可阻断辣椒素产生的生物学效应。已有研究证明肺C类纤维在辣椒素引起的未成熟期大鼠的呼吸抑制中起着重要的作用[10]。成年大鼠右心房持续输注前列腺素E2可刺激肺迷走神经中的C类神经纤维,对辣椒素产生的呼吸抑制有易化作用[11]。本课题组以往的研究证实前列腺素E2所引起的呼吸抑制依赖于迷走神经的完整性,迷走神经切断后,右心房注射前列腺素所引起的呼吸抑制完全消失[4]。由于肺C类纤维占肺部迷走神经的75%~80%,其感受器广泛分布于肺的毛细血管和呼吸道上皮等周围,所以我们推测其引起呼吸抑制的作用机制可能与肺C类纤维有关。本实验研究发现,在注射辣椒平后,PGE2引起的呼吸暂停依然存在,注射辣椒平前后PGE2产生的呼吸暂停的时间并无统计学差异,因此右心房注射前列腺素E2所引起的呼吸抑制不是通过辣椒素受体起作用的。
P物质(SP)是初级感觉神经末梢的肽类神经递质,也是神经源性炎症的主要介质,还是重要的神经-免疫调节肽和前炎症因子,参与了组织的损伤及免疫、炎症反应,引起各种炎症介质如组胺,激肽和前列腺素的释放和聚集。在急性肺损伤的发生、发展中有重要的作用。主要是通过NK1型P物质受体起作用的。曾有研究表明,P物质会引起离体成年大鼠的支气管组织前列腺素E2的释放[12]。而单纯吸入或静脉注射P物质会引起成年大鼠的气管收缩[13]。本实验发现,给予P物质拮抗剂S-3144前后,PGE2产生的呼吸暂停时间之间没有统计学差异。对于外源性的前列腺素E2,P物质受体拮抗剂不会阻断其对呼吸的抑制作用。由此推测,前列腺素E2所引起的呼吸抑制不是通过NK1受体起作用的。
AH6809是一种特异的前列腺素E2受体拮抗剂。PGE2在体内存在四种受体,分别为EP1、EP2、EP3、EP4,广泛分布于支气管上皮细胞、支气管平滑肌细胞、血管内皮和间质细胞中。其中EP1/EP3可引起气管收缩,而EP2/EP4则可引起气管舒张。因此,有研究发现,PGE2可以引起气道平滑肌舒张;而另一些研究发现,PGE2可以引起气道平滑肌收缩。研究报道,EP2受体广泛分布于许多组织和细胞中并介导PGE2的作用[14]。曾有实验研究通过同源染色体重组的成年大鼠来证实了前列腺素E2引起的支气管扩张主要是EP2受体的作用[15]。在EP2受体缺失的成年大鼠中,前列腺素E2几乎完全不能引起气道平滑肌的舒张,因此EP2可能主要引起成年大鼠气道平滑肌舒张的受体,同时仍有其他引起气道平滑肌舒张的物质存在,如EP4。AH6809是作用于EP2受体的拮抗剂。在AH6809组中用AH6809拮抗以后再给予等剂量等浓度的前列腺素E2,观察到PGE2引起的呼气延长时间缩短约42%,与未拮抗前所产生的呼气延长时间相比有统计学差异(P<0.05),但并不完全阻断PGE2引起的呼吸暂停的发生。静脉推注前列腺素E2前的呼气时间相比仍有延长。据此我们推测在未成熟期大鼠中前列腺素E2引起的呼吸抑制部分是通过EP2受体产生的,同时也可能与EP4、EP1/EP3等受体有关,但尚需进一步研究证实。
4 结论
新生大鼠右心房注射PGE2引起的呼吸暂停部分是通过作用于前列腺素E2(EP2)受体产生的,而与辣椒素受体和P物质受体无关。本实验为临床实践过程中治疗新生儿呼吸暂停提供了重要的理论依据。对于PGE2浓度升高引起的新生儿呼吸抑制可用EP2受体特异性拮抗剂AH6809对抗以增加呼吸活动,这对治疗新生儿呼吸暂停提供了新的思路。
[1]Pavord I D,Tattersfield A E.Bronch oprotective role for endogenous prostaglandin E2[J].Lancet,1995,345(8947):436-438.
[2]Hoch B,Bernhard M.Central apnoea and endogenous prostaglandins in neonates[J].Acta Paediatr,2000,89(11):1364-1368.
[3]Annika O,Hofstetter,Sipra Saha,etal.The induced prostaglandin E2pathway is a key regulator of the respiratory response to infection and hypoxia in neonates[J].The National Academy of Sciences of the USA,2007,104(23):9894-9899.
[4]孙明洁,基 鹏,王茂华,等.右心房注射前列腺素E2对新生大鼠呼吸的影响[J].华西医学,2009,24(2):368-370.
[5]孙眉月.极低出生体重儿并发呼吸暂停[J].小儿急救医学,2002,9(1):1-2.
[6]Pisarri TE,Yu J,Coleridge HM,Coleridge JC.Background activity in pulmonary vagal C-fibers and its effects on breathing[J].Respir Physiol,1986,64:29-43.
[7]Tai TC,Adamson SL.Developmental changes in respiratory,febrile,and cardiovascular responses to PGE2in newborn lambs[J].Am J Physiol,2000,278:1460–1473.
[8]Olsson A,Kayhan G,Lagercrantz H,etal.IL-1βDepresses Respiration and Anoxic Survival via a Prostaglandin-Dependent Pathway in Neonatal Rats[J].Pediatr Res,2003,54:326 –331.
[9]Wallen LD,Murai DT,Clyman RI,etal.Regulation of breathing movements in fetal sheep by prostaglandin E2[J].J Appl Physiol,1986,60(2):526-531.
[10]Wang R,Xu F.Postnatal development of right atrial injection of capsaicin-induced apneic response in rats[J].J Appl Physiol,2006,101(1):60-67.
[11]Ho CY,Gu QH,Hong JL,etal.ProstaglandinE2enhances chemical and mechanical sensitivities of pulmonary C fibers in the rat[J].Am J Respir Crit Care Med,2000,162(2pt 1):528-533.
[12]Bergren DR.Prostaglandin involvement in lung C-fiber activation by substance P in guinea pigs[J].J Appl Physiol,2006,100(6):1918-1927.
[13]John L Szarek,Beverly Spurlock,Carl A,etal.Substance P and capsaicin release prostaglandin E2from rat intrapulmonary bronchi[J].Am J Physiol Lung Cell Mol Physiol,1998,275:1006-1012.
[14]Manabu Negishi,Yukihiko Sugimoto,Atsushi Ichikawa.Prostanoid receptors and their biological actions[J].Prog Lipid Res,1993,32(4):417-434.
[15]Hartney JM,Coggins KG,Stephen LT.Prostaglandin E2protects lower airways against bronchoconstriction[J].Am J Physiol Lung Cell Mol Physiol,2006,290:105-113.

