泪腺腺样囊性癌S-100蛋白、神经细丝酸性蛋白的表达及其意义
王磊峰,董玉萍,朱素芳,李晓娟,董秋艳,黑 砚
泪腺腺样囊性癌S-100蛋白、神经细丝酸性蛋白的表达及其意义
王磊峰1,董玉萍1,朱素芳1,李晓娟1,董秋艳1,黑 砚2
目的 探讨泪腺腺样囊性癌S-100蛋白及神经细丝酸性蛋白(glial fibrillary acidic protein, GFAP)的表达及其意义。方法 收集手术切除泪腺腺样囊性癌28例标本,根据临床症状及组织学观察分为嗜神经侵袭组(15例)和无嗜神经侵袭组(13例),并取术中切除的正常泪腺组织9例为正常对照。应用免疫组织化学SP染色法检测S-100及GFAP在上述组织中表达的差异。结果 嗜神经侵袭性生长组的S-100、GFAP阳性表达分别为12例(80%)和9例(60%),与无嗜神经侵袭性生长组S-100阳性5例(41.67%)、GFAP 阳性表达率为0相比,呈显著升高趋势,差异有统计学意义 (P<0.05)。结论 GFAP、S-100在有嗜神经性侵袭的腺样囊性癌中有特异性表达,其侵袭特性可能与肿瘤细胞中存在着神经膜细胞分化有关。
泪腺腺样囊性癌; S-100;神经细丝酸性蛋白;嗜神经性;免疫组织化学
腺样囊性癌嗜神经侵袭生长的特性,常导致疼痛、麻木等周围神经受损症状或体征,且由于肿瘤细胞易沿神经生长,使手术切除范围非常不易掌握。有学者推测,腺样囊性癌细胞发生雪旺细胞分化可能是其嗜神经侵袭的机制之一[1]。常见的雪旺细胞标志物有S-100蛋白、GFAP等。本研究收集了2005-02至2011-04的28例腺样囊性癌病例,检测S-100、GFAP在腺样囊性癌有嗜神经性侵袭组与无嗜神经性侵袭组中的表达,旨在探讨泪腺腺样囊性癌嗜神经性侵袭性生长的机制。以期对腺样囊性癌的嗜神经侵袭特性采取更有效的针对性手段。
1 对象与方法
1.1 对象 28例中,男12例,女16例,年龄25~81岁,平均46岁。根据临床症状及组织学观察有无嗜神经性生长分为有嗜神经侵袭组(15例)和无嗜神经侵袭组(13例)。另取9例正常泪腺组织作为正常对照。
1.2 入选标准 (1)结合临床上是否有神经受损症状及HE染色后显微镜下观察有无瘤细胞包绕神经判定有无肿瘤嗜神经性;若满足上述两种条件中的一种,则判断为有嗜神经性[2]。(2)所有患者术前均未行放、化疗。
1.3 试剂 鼠抗人GFAP单克隆抗体及鼠抗人S-100蛋白单克隆抗体(美国Santa Cruz 公司产品),SP试剂盒,DAB显色试剂盒均购自北京中杉金桥生物技术开发公司。
1.4 试验仪器 TP1020全自动组织脱水机、EG1140H石蜡包埋机、EG1140C冷冻台、RM2145组织切片机、HI1210捞片机、HI1220烤片机及DMLED显微镜等(德国LEICA产品);国产DHP-781电热恒温培养箱,WD9001微波炉(格兰仕)。
1.5 方法 所有标本经10%中性甲醛固定,常规脱水、浸蜡、石蜡包埋、行2 μm连续切片。切片经苏木素-伊红(HE)染色后经高年资病理医师进行组织形态学观察,参照2001年世界卫生组织(WHO)对泪腺上皮性肿瘤分类标准进行病理诊断[1]。免疫组织染色方法采用SP法。免疫组织化学染色过程中,每批染色均设阴性及阳性对照片,以除外假阳性及假阴性结果。阴性对照片以PBS缓冲液代替相应一抗制成,阳性对照片用已知的S-100及GFAP阳性片。
1.6 GFAP染色阳性结果的判断 GFAP定位于细胞质上,细胞质内出现棕色颗粒为阳性。根据细胞数目,将表达情况分为4级:(-)细胞染色数=0;(+)为0<细胞染色数≤33%;(++)为33%<细胞染色数≤66%;(+++)为细胞染色数>66%。
1.7 S-100染色阳性结果的判断 S-100定位于胞浆和胞核上,以胞质或核中出现棕色颗粒或均一棕色为阳性,无阳性细胞记为(-),有阳性细胞记为(+)。

2 结 果
2.1 腺样囊性癌的嗜神经性生长 28例中,有13例经HE染色后进行组织形态学观察和临床病历回顾都未出现神经受侵表现,有11例在HE染色后进行组织形态学观察出现瘤细胞包绕神经现象(图1)。通过病历回顾,有12例出现疼痛、麻木等明显神经的受损症状。神经受侵率为53.57%。
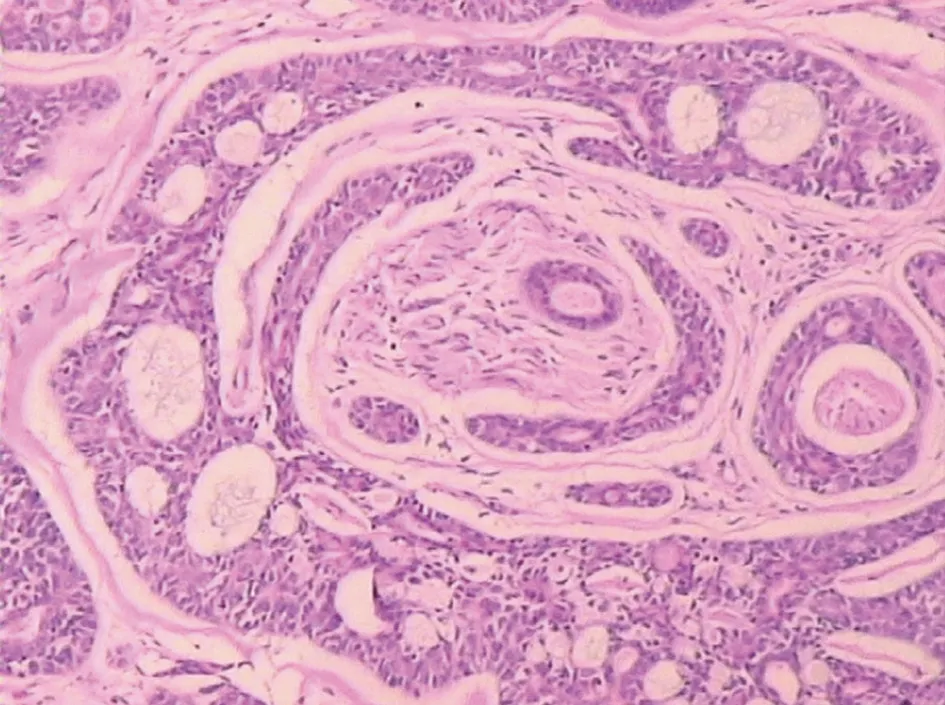
图1 ACC细胞包绕神经生长现象 (HE,×100)
2.2 S-100在腺样囊性癌中的表达 S-100定位于胞质和胞核上,以胞质或核中出现棕色颗粒或均一棕色为阳性。无嗜神经侵袭性生长组中有5例有S-100 的阳性表达,表达强度不均,灶性分布,染色较淡。S-100LI为0.62±1.19 。有嗜神经侵袭性生长组中12例有S-100 的阳性表达,表达强度不均,染色较强。S-100LI为16.73±24.74(图2)。有嗜神经侵袭性生长组中的S-100阳性表达率(80%)较无嗜神经侵袭性生长组(41.67%)呈升高趋势,差异有统计学意义(P<0.05)。
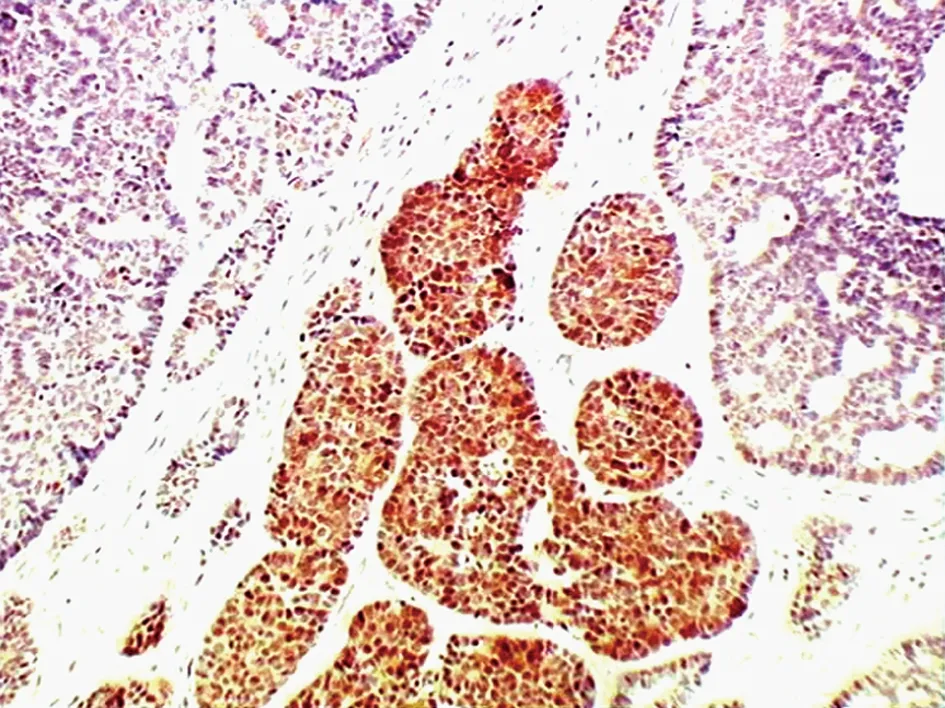
图2 S-100在泪腺腺样囊性癌中的表达 (SP,×100)
2.3 GFAP在腺样囊性癌中的表达 GFAP定位于细胞质上,以胞质中出现棕色颗粒为阳性。无嗜神经侵袭性生长组13例中均未见到GFAP的阳性表达。有嗜神经侵袭性生长组15例中9例(60.00%)出现GFAP 的阳性表达,表达强度不均,染色较强。两组GFAP阳性比较差异有统计学意义(P<0.05)。GFAP LI为2.07±3.01。有嗜神经侵袭性生长组中的GFAP阳性表达率较无嗜神经侵袭性生长组呈升高趋势(图3)。
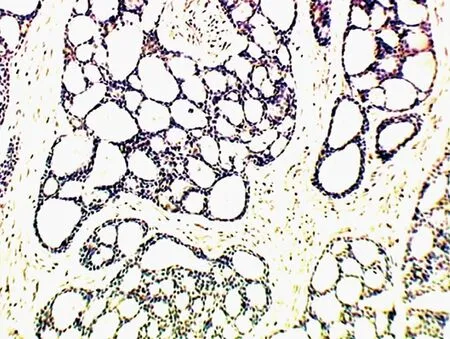
图3 GFAP在泪腺腺样囊性癌中的表达(SP,×100)
2.4 S-100和GFAP在腺样囊性癌中的表达相关性 28例标本中,两者同时出现阳性表达的6例,同时出现阴性表达的8例,差异无统计学意义。
3 讨 论
腺样囊腺癌居泪腺恶性肿瘤的第1位,具有高度恶性[3-5]。嗜神经性侵袭的特性使得泪腺腺样囊性癌的治疗更加棘手,由于肿瘤细胞易沿神经生长,使得手术切除范围非常不易掌握,因此是目前腺样囊性癌研究的热点问题之一。Toth等[6]用神经膜细胞免疫组化标记物S-100、GFAP、NSE及神经膜细胞组织化学标记物搔洛铬(solochrome)对腺样囊性癌和多形性低度恶性腺癌作了研究,提出腺样囊性癌和多形性低度恶性腺癌中突变的肌上皮细胞存在着神经膜细胞分化。Iwamoto等[7]用神经膜细胞标记物p75及GFAP证明了具有神经侵袭性的梭形细胞型恶性黑色素瘤细胞中存在着雪旺细胞分化,而在不具嗜神经侵袭性的其他亚型中则不存在这种分化,并将其作为恶性黑色素瘤嗜神经侵袭的组织学基础。罗小龙等[8]通过免疫组化的方法证明了神经膜细胞标志物S-100、GFAP在腺样囊性癌中有表达,而在不具有嗜神经侵袭性的黏液表皮样癌中则没有表达,进一步证明了腺样囊性癌的嗜神经侵袭与腺样囊性癌发生神经膜细胞分化有关。
S-100蛋白家族是1965年由Moore发现并命名的一组酸性钙调节蛋白,属肌钙蛋白C家族,分子量为20 ku。目前发现有21个家族成员。S-100蛋白广泛分布于不同组织,通过对钙离子的调节及与靶蛋白的相互作用,在体内发挥多种生物学功能,与肿瘤的发生发展关系密切。
以往对肿瘤有无嗜神经性的判断单独依靠组织形态学观察[6]。本研究在判定肿瘤是否侵袭神经时结合了临床症状和组织形态学观察两种方式。结合临床上是否有神经受损症状及HE染色后镜下观察有无瘤细胞包绕神经判定肿瘤嗜神经性的有无,若满足上述两种条件中的一种,则判断为有嗜神经性。本研究发现,组织形态学能否观察到神经受侵现象与临床上是否表现出神经受损症状并不一致,这说明由于病理标本取材的局限性,即使腺样囊性癌细胞已经侵袭神经,也未必能通过组织形态学观察到。而另一方面,由于神经处于受侵袭早期,或由于邻近神经的代偿作用,即使显微镜下能观察到神经受侵现象,临床上也不表现任何神经受损症状。
本研究结果发现,有13例腺样囊性癌经HE染色后进行组织形态学观察和临床病历回顾都未出现神经受侵表现,有11例在HE染色后进行组织形态学观察出现瘤细胞包绕神经现象,有12例出现疼痛、麻木等明显神经的受损症状。
部分非神经源性恶性肿瘤除具备浸润、复发和转移一般特性外,还有一个较为特殊的临床表现就是显微镜下可见癌细胞多聚集在神经束衣和神经内衣的间隙下,也可散在于神经轴柱之间或包裹神经纤维。临床上可以出现感觉和(或)运动神经功能障碍,还可以有脑病表现。神经侵袭主要发生在神经周围淋巴管的侵袭[9-13],嗜神经侵袭是ACC的重要生物学特性之一,也成为泪腺ACC局部复发与蔓延不可忽视的重要因素。文献[12]报道,头颈部ACC神经侵袭的发生率为69%,知名神经侵犯为28%。
本研究结果中GFAP在15例有嗜神经性腺样囊性癌的标本中有9例为阳性表达,而在13例无嗜神经性腺样囊性癌标本中无一例阳性表达,差异有统计学意义(P<0.01)。S-100在15例有嗜神经性腺样囊性癌的标本中有12例为阳性表达,在13例无嗜神经性腺样囊性癌标本中5例阳性表达。因此,认为GFAP、S-100这两种雪旺细胞标志物在具嗜神经性的腺样囊性癌中有特异性表达,而在不具嗜神经性的腺样囊性癌中却没有表达或表达率低,这与Iwamoto等[7]在恶性黑色素瘤嗜神经侵袭的研究结果类似,也与罗小龙等[8]在涎腺腺样囊性癌的研究结果类似,因此推论泪腺腺样囊性癌中嗜神经性侵袭特性与肿瘤细胞中存在着神经膜细胞分化有关。
[1] 吕春堂,周树夏.涎腺腺样囊性癌热点问题研究 [J].第二军医大学学报,2005,26(6):589-592.
[2] Azadeh A, Soheil P, Zohreh J,etal. Expression of Ki67 and CD105 as Proliferation and Angiogenesis Markers in Salivary Gland Tumors3 [J]. Asian Pacific Journal of Cancer Prevention, 2012,13(10):5155-5159.
[3] Tang W, Hei Y, Xiao L. Recurrent orbital space-occupying lesions: a clinicopathologic study of 253 cases[J]. Chin J Cancer Res, 2013,25(4):423-429.
[4] Bhavna C, Seema K, Seema S,etal. Clinicopathologic Review of Epithelial Tumors of the Lacrimal Gland3 [J]. Ophthal Plast Reconstr Surg,2013, 29(6): 440-445.
[5] Zeng J, Shi J T, Li B,etal. Epithelial tumors of the lacrimal gland in the Chinese: a clinicopathologic study of 298 patients[J]. Graefes Arch Clin Exp Ophthalmol, 2010,248:1345-1349.
[6] Toth A,Daley T D.Schwann cell differentiation of modified myoepithelial cells within adenoid cystic carcinomas and polymorphous low-grade adenocarcinomas [J]. J Otolaryngol, 1996, 25(2):94-102.
[7] Iwamoto S,Burrows R C.The p75 neurotrophin receptor,relative to others Schwann cell and melanoma markers,is abundantly expressed in spindled melanomas[J].Am J Dermatopathol,2001,23(4):288-294.
[8] 罗小龙,孙沫逸, 杨连甲,等. 雪旺细胞标志物S-100蛋白在涎腺腺样囊性癌嗜神经侵袭中的意义[J].实用口腔医学杂志,2003,19(2):173-175.
[9] 范 莹,耿美玉,张均田.神经细胞粘附分子与硫酸化氨基聚糖在神经发育、轴突生长、突触可塑性及学习和记忆中的作用[J].生理科学进展,2002,33(4):370-373.
[10] Toshitaka N, Eiichi S, Rie I,etal. Immunohistochemical Analysis of Salivary Gland Tumors: Application for Surgical Pathology Practice[J]. Acta Histochem, 2012,45 (5): 269-282.
[11] Tieu K,Yu P H. Neural cell adhesion molecules. In: Boultin AA,Baker GB,Bateson AN. Neuromet hods vol 33 : cell neurobiology techniques [M]. New Jersey:Humana press, 1999:103-107.
[12] HO H, Lim Z, Kh T,etal. Bilateral kutter tumors of the lacrimal glands[J]. Orbit, 2011,30(2):96-97.
[13] Gandour R,Kapadia S B,Barnes L,etal. Cell adhesion molecule in adenoid cystic carcinoma invading the skull base [J]. Otolaryngol Head Neck Surg,1997,117(5):453-458.
(2014-01-12收稿 2014-09-18修回)
(责任编辑 郭 青)
Expression and significance of S-100 and GFAP in lacrimal adenoid cystic carcinoma
WANG Leifeng1, DONG Yuping1, ZHU Sufang1, LI Xiaojuan1, DONG Qiuyan1,and HEI Yan2.
1.Department of Ophthalmology, Beijing Municipal Corps Second Hospital, Chinese People’s Armed Police Forces, Beijing 100037, China; 2.The Institute of Orbital Disease ,The General Hospital of Chinese People’s Armed Police Forces, Beijing 100039,China
Objective To investigate the expression of Schwann's cell markers S-100 and GFAP in lacrimal adenoid cystic carcinoma, and to explore the relationship between GFAP or S-100 expression and neural invasion of adenoid cystic carcinoma. Methods Twenty-eight lacrimal adenoid cystic carcinoma and 9 normal lacrimal gland specimens were collected . Each specimen was stained by S-P(streptavidin/peroxidase) immuno- histochemical staining. The expression of S-100 and GFAP was analyzed by immunohistochemistry in order to find the difference in the above-mentioned tissues. One-way ANOVA, Student,s test, chi-square test or linear correlation were carried out for statistical evaluation. Results The average S-100 Index(S-100LI) in nor-neural invasion group and neural invasion group were 0.62±1.19 and 16.73±24.74,respectively,in lacrimal gland adenoid cystic carcinoma. (P<0.05). The average GFAP LI in nor-neural invasion group and neural invasion group were 0 and 2.07±3.01,respectively,in lacrimal gland adenoid cystic carcinoma. (P<0.05). Conclusions Schwann’s cell markers GFAP and S-100 in neural invasion group is higher than that in nor-neural invasion group (P<0.05). The Schwann’s cell differentiation may account histologically for the neural invasion of lacrimal gland adenoid cystic carcinoma.
lacrimal adenoid cystic carcinoma;S-100; glial fibrillary acidic protein; neural invasion; immunohistochemistry
王磊峰,硕士,副主任医师,E-mail:wangleifeng123@sina.com
1.100037,武警北京总队第二医院眼科;2.100039北京,武警总医院眼眶病研究所
黑 砚,E-mail:heiy an842@163.com
R777.5

