视网膜母细胞瘤小鼠模型的建立
伊世芹,李彦珊,苗丽霞,孙岩峰,王 军,刘红艳,杨新吉,刘秋玲
视网膜母细胞瘤小鼠模型的建立
伊世芹1,李彦珊2,苗丽霞2,孙岩峰2,王 军2,刘红艳2,杨新吉2,刘秋玲2
目的 建立视网膜母细胞瘤(retinoblastoma,RB)模型,为研究RB新疗法提供实验动物模型。方法 选取出生第1天的CD1小鼠40只,随机分为A、B、C、D 4组,每组10只。设每组小鼠的右眼为实验眼,左眼为对照眼,将RB-Y79细胞以4 μl/只注射至右眼玻璃体腔内,A、B、C、D组注射的RB-Y79浓度分别是2.0×107/ml、3.0×107/ml、3.5×107/ml、4.0×107/ml。4组小鼠左眼均注射等量重悬细胞的溶剂;观察小鼠生长状态及移植瘤生长情况,并与对照眼比较,选择出最佳建模细胞浓度;取出的组织常规石蜡切片HE染色,观察移植瘤组织细胞形态学特征。结果 注射RB-Y79细胞后,实验小鼠右眼可形成肿瘤,而对照眼左眼无肿瘤形成;注射的RB-Y79细胞浓度不同,成瘤率和存活率不同,第10天A、B、C、D组的成瘤率分别为20%、80%、100%和100%,存活率分别为100%、80%、80%和50%。C组3.5×107/ml为最佳建模浓度;移植瘤组织病理检查:右眼眼球结构被破坏。瘤细胞大小不等,形态为圆形、椭圆形、多边形或不规则形;细胞质少;胞核大,圆形,卵圆形或不规则形,染色深,有1~2个以上核样结构。结论 新生小鼠玻璃体腔内注射RB-Y79细胞可成功建立RB小鼠模型。
CD1新生小鼠;视网膜母细胞瘤;移植瘤模型
视网膜母细胞瘤(retinoblastoma,RB)是婴幼儿最常见眼内原发恶性肿瘤[1],致残率、病死率高。我国每年新增RB病例约占全球新增病例的20%[2,3]。发达国家RB患儿的5年生存率已达90%以上[4],但在我国RB患儿的病死率仍很高。因此,探索新的治疗方法成为我国RB治疗的重要研究方向。由于各种新的治疗手段在进入临床应用之前,必须先经体外实验证实,为此,本研究选用出生第1天的新生小鼠,进行玻璃体腔内注射RB-Y9细胞,成功建立了RB移植瘤小鼠模型,为研究RB新的治疗方法和新的药物提供合适的动物模型。
1 材料与方法
1.1 材料 人RB-Y79细胞株,购自中国医学科学院基础医学研究所基础医学细胞中心;新生CD1小鼠,饲养于北京生命科学研究所SPF级动物房。
1.2 方法
1.2.1 准备受孕母鼠 15只CD1成年母鼠,每盒3只置于5个鼠盒中,分别放入1只CD1成年雄鼠。每天早晚检查1次母鼠阴道,观察有无孕栓形成。将查到孕栓的母鼠从雌雄同盒中取出,单独放于其他鼠盒,标记受孕日期。
1.2.2 受孕母鼠待产准备 根据受孕期,推算出小鼠出生日期(一般小鼠的孕期为18.5~19.5 d)。在查出孕栓后17.5 d时,将腹部膨隆的母鼠单独放于鼠盒中,1个鼠盒放1只孕鼠,标记受孕日期,待产。
1.2.3 选取建模用新生CD1小鼠并进行分组 为保证实验的可比性,选取同一天出生的小鼠进行建模,在本研究的15只母鼠中,同一天受孕最多的是5只,共产小鼠54只,死亡0只。在存活的54只出生第1天的新生小鼠中选取40只,随机分为A、B、C、D 4组,每组10只,选择每只小鼠的右眼为实验眼,左眼为对照眼。
1.2.4 复苏、培养RBY-79细胞 小鼠出生前2 d复苏RBY-79细胞并传代,使之生长状态良好。待RBY-79细胞长到80%左右时消化细胞,计数、离心、重悬,然后接种于含10%胎牛血清、100 U/ml青链双抗、15 mmol/L HEPES的RPMI1640培养液中,置于37 ℃、相对湿度95%、含5%CO2的培养箱中常规培养,当培养液颜色由红色变为黄色时更换培养液,当细胞80%融合后即可按1∶3到1∶6传代。收集对数生长期细胞进行实验,用0.05%胰酶-EDTA混合消化液消化,计数、离心,用不含血清的培养液重悬细胞,调整细胞浓度分别为2.0×107/ml、3.0×107/ml、3.5×107/ml、4.0×107/ml,备用。
1.2.5 注射RB-Y9细胞建模 固定实验小鼠于体式显微镜下,找到小鼠眼裂的体表痕迹,用5 μl微量注射器,抽取事先调整好浓度的RBY-79细胞悬液,于眼裂体表痕迹下1~2 mm处进针,进针2~3 mm,有针尖刺破小鼠皮肤的落空感时,即将细胞悬液缓慢推注到小鼠玻璃体腔,每只小鼠注射4 μl,注射后退针。A、B、C、D组小鼠注射的细胞浓度依次为2.0×107/ml、3.0×107/ml 、3.5×107/ml、4.0×107/ml。以同样方法,向作为对照眼的每只实验小鼠的左眼,注射4 μl上述细胞重悬用溶剂。
1.2.6 观察成瘤情况 注射肿瘤细胞后,每天观察各组小鼠生活状态变化。于体式显微镜下观察小鼠右眼移植瘤生长情况,并与左眼对照,拍照、记录观察结果。标记可见肿瘤形成小鼠,不同时间可见肿瘤团块的小鼠剪掉不同的脚趾 ,以区别于未见肿瘤形成的小鼠。如遇小鼠死亡,即解剖死亡小鼠,剪开其眼睑,观察是否有肿瘤形成,计算小鼠成瘤率。
1.2.7 切除小鼠移植瘤 准备好小鼠解剖剪刀、镊子,1XPBS、4% PFA,将小鼠取出鼠盒,用CO2安乐处死。置于体式显微镜下,用解剖镊夹起小鼠眼睑,沿着肿瘤边缘将眼睑剪开,用镊子轻轻将小鼠的眼睑扯下,若眼睑和肿瘤粘连较紧密,撕扯会损坏肿瘤的完整性,此时可用解剖剪刀沿着眼睑与肿瘤粘连的边缘将眼睑剪下,以保证肿瘤组织的完整性。若出血较多,即用1XPBS冲洗,清楚视野。将完整解剖出来的肿瘤组织用4% PFA固定。以同样的方法解剖每只小鼠的左眼,同样将解剖出来的左眼眼球用4%PFA固定。
1.2.8 确认移植瘤病理形态 观察切除肿瘤的颜色、质地并记录。将上述肿瘤组织及切除的左眼眼球分别做石蜡切片,切片厚5 μm。进行HE染色,普通光学显微镜下观察肿瘤组织形态,明确肿瘤组织的病理学类型。
1.3 统计学处理 应用SPSS18.0统计软件,多组样本间率的比较采用卡方检验或Fisher确切概率法,P<0.05表示差异有统计学意义。
2 结 果
2.1 不同RB细胞浓度小鼠的成瘤率及存活率 注射肿瘤细胞10 d后,C组和D组成瘤率最高,均为100%,存活率分别为80%和50%,两组存活率比较差异有统计学意义(P<0.05,表1)。因此,C组细胞浓度3.5×107/ml, 4 μl/只是建模最佳浓度,成瘤率、存活率最高。
2.2 注射RB-Y79细胞(3.5×107/ml)的CD1小鼠移植瘤形成情况 见图1。注射肿瘤细胞后连续2 d未见肿瘤形成,第3天可见7只小鼠右眼球较左眼球突出皮肤表面。第4天,之前未见肿瘤团块形成的3只小鼠右眼见肿瘤团块的形成,之前有肿瘤形成的小鼠右眼球更明显的突出于皮肤表面;第7天,1小鼠自发死亡,解剖该小鼠,剪开眼睑,右眼可见明显的肿瘤组织的形成,左眼未见异常;第10天,剩余8只存活小鼠,肿瘤更加突出增大。

表1 4组不同浓度细胞培养下视网膜母细胞瘤小鼠的10 d成瘤率及存活率
注:A、B、C、D组分别表示Y79浓度是2.0×107/ml、3.0×107/ml、3.5×107/ml、4.0×107/ml;与A组比较,①P<0.05;与C组比较,②P<0.05
2.3 移植瘤组织病理形态 对照的左眼HE染色,可以见到清晰完整的眼球基本结构;右眼眼球结构破坏,被肿瘤细胞占据;肿瘤细胞大小不等,呈圆形、椭圆形、多边形或不规则形,细胞质少,胞核大,染色深,有1~2个核样结构体(图2)。
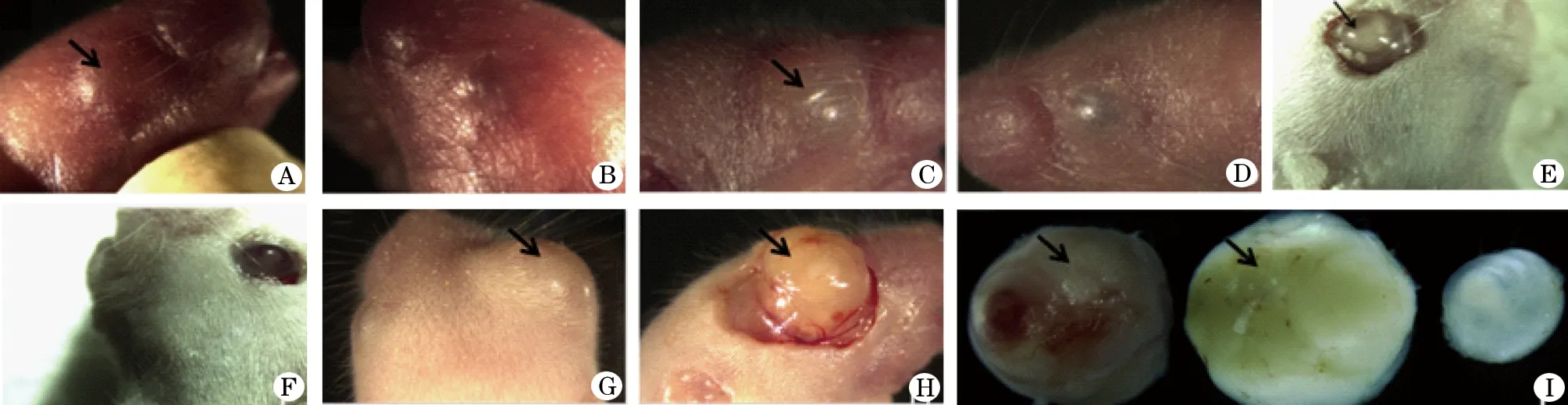
图1 注射RB-Y79(3.5×107/ml)细胞后CD1移植瘤形成过程
A. 第3天,右眼(箭头所指,后同);B. 第3天,左眼;C. 第5天,右眼;D. 第5天,左眼;E. 第7天,剖开眼睑小鼠右眼;F. 第7天,剖开眼睑小鼠左眼;G. 第10天,移植瘤更加增大,明显突出于皮肤表面;H.第10天,剪开小鼠右眼眼睑,肿瘤组织呈鱼肉状,肿瘤表面可见丰富的血管网,肿瘤中心部位呈向内凹陷现象,并可见轻微出血坏死(箭头所示);I. 完整解剖出来的肿瘤(箭头所示),部分移植瘤呈红色,有明显充血现象,部分移植瘤呈瓷白色,无明显充血,部分移植瘤表面光滑,部分移植瘤形态很不规则。左眼眼球形状规则,呈圆形,眼球透光度好,玻璃体内晶状体清晰可见

图2 注射RB-Y79(3.5×107/ml)细胞后小鼠第10天病理(HE)
3 讨 论
移植性肿瘤动物模型是筛选抗肿瘤新药中最常用的模型。1969年,丹麦Rygaard和Povsen[5]首先将人类结肠腺癌移植到裸小鼠成功,为移植性肿瘤动物模型开创了新局面。裸鼠由于先天缺乏T细胞免疫,缺少了对异种物质的排斥反应,这一特点为人源肿瘤细胞找到一个合适的活载体,所以很多对人源肿瘤的生长和转移研究都借助于裸鼠。1977年,Gallie等[6]首先报道将新鲜RB手术切除标本制成细胞悬液后接种于裸小鼠眼前房内,结果发现绝大多数肿瘤标本能生长增殖,且能成功传代。1995年,易先金等[7]成功建立了一株人RB裸小鼠移植瘤,共接种5例新鲜RB手术标本于裸小鼠皮下,结果仅1例获得成功。2009年,孙莹等[8]于成年裸鼠身上建立视网膜移植瘤模型获得成功。与肿瘤相关的研究离不开免疫,由于缺少了T细胞免疫,裸鼠体内肿瘤的生长转移和人体内的情况会有很大差异,对于裸鼠接种的肿瘤,瘤体可以长到接近裸鼠自身体重的程度,而裸鼠仍然可以存活很长时间,但是如果发生在人体,机体将难以承受。此外,很多基因、蛋白和药物对于肿瘤的作用均是通过作用于免疫系统而发挥作用,而没有T细胞免疫的裸鼠本身成为这方面研究的最大障碍,裸鼠的优点也成为了其缺点,且裸小鼠抵抗力差,饲养和繁殖要求条件比较严格,易患病毒性肝炎和肺炎, 受孕率低。由于以上种种原因,裸鼠建立肿瘤动物模型有很多局限性。
目前,国际上用于RB研究的动物模型主要采用反转录病毒法小鼠视网膜单个前体细胞内癌基因导入的转基因RB小鼠模型,或者采用基因敲除的方法,将小鼠RB及P53或P107基因一起敲除[9-12]。这些模型的优点是更接近于人类RB的形成,但是,此模型的获得周期长,数量受限,且价格昂贵,不适合临床前期药物选择。
本研究采用RB-Y79细胞在新出生的无免疫缺陷CD1小鼠玻璃体腔建立视网膜移植瘤模型。借鉴于RB在成年裸鼠建立移植瘤所需的细胞数[6-8],本研究设置了4组不同的细胞浓度在新生CD1小鼠玻璃体内建立移植瘤模型。根据新生小鼠眼球的解剖结构,我们确定了注射肿瘤细胞到玻璃体腔内的进针位置及深度,在注射器的针尖穿透眼睑进入玻璃体腔时,会有一个轻微的落空感,若不慎将肿瘤细胞注入了眼眶,没有进入玻璃体腔,在把针尖拔出后,细胞悬液随即会从针孔溢出,表示注射失败。
RB-Y79细胞系来源于一有母系家族史的2岁半白种女性RB患儿,是第1个培养成功的人类RB细胞株,目前在国际上应用较为广泛[13]。新生24 h内的小鼠免疫系统尚未完善[14],排斥反应小,适于肿瘤种植。CD1小鼠是没有基因缺陷的正常小鼠;小鼠的产仔数量多,适于实验要求;相对于其他品系的小鼠CD1小鼠哺乳期的母鼠不会把非亲生的小鼠吃掉,更适合做代孕妈妈。RB主要发生于3岁之内的婴幼儿,选用无免疫缺陷的新生小鼠建立肿瘤模型,其生长发育环境比成年鼠更接近肿瘤在人体内的生长环境。新生小鼠移植瘤模型的建立,可弥补裸鼠肿瘤模型的不足,更好地促进肿瘤研究的进展。
本实验结果显示,RB-Y79细胞在新生CD1小鼠玻璃体腔内可成功种植。最佳建模浓度是3.5×107/ml,4 μl/只,本实验浓度梯度中该浓度成瘤率最高的同时存活率最高,接种肿瘤细胞后第3天即可见肿瘤团块的形成,第10天成瘤率100%。HE染色结果显示,肿瘤细胞在玻璃体内聚集成瘤,眼球结构被破坏,肿瘤生长速度较快,明显突出于眶外。移植瘤肿瘤细胞大小不等,呈圆形、椭圆形、多边形或不规则形,细胞质少,胞核大,染色深,有1~2个以上核样结构体,组织细胞学特点与人类RB相符合。
基于以上实验结果,通过玻璃体腔RB-Y79细胞接种可以建立新生小鼠RB模型,为RB治疗研究提供了更佳的实验动物模型。
[1] Dimaras H, Kimani K, Dimba E A,etal. Retinoblastoma [J]. Lancet, 2012, 379(9844):1436-1446.
[2] Leal-Leal C, Flores-Rojo M, Medina-Sanson A,etal. A multicentre report from the Mexican Retinoblastoma Group[J]. Br J Ophthalmol, 2004, 88(8): 1074-1077.
[3] Broaddus E, Topham A, Singh A D. Incidence of retinoblastoma in the USA: 1975-2004[J]. Br J Ophthalmol, 2009, 93(1): 21-23.
[4] Shields C L, Shields J A. Diagnosis and management of retinoblastoma [J]. Cancer control, 2004,15(11):317-327.
[5] Rygaard J, Povsen C O. Heterotransplantation of a human malignant tumour to "nude" mice [J]. Acta Pathol Microbiol Scand,1969, 77(4): 758-760.
[6] Gallie B L, Albert D M, Wong J J,etal. Invest Ophthalmol [J]. Vis Sci, 1977, 16(3): 256-259.
[7] 易先金,倪 连, 王文吉,等. 人视网膜母细胞瘤裸小鼠移植瘤的建立及有关生物学特性的研究[J]. 中华眼科杂志, 1995, 31(2): 201-205.
[8] 孙 莹,吴 荒,张小猛, 等. 视网膜母细胞瘤Y79 细胞裸鼠玻璃体腔移植瘤模型的建立 [J]. 中国实验诊断学,2009, 13(10): 1363-1365.
[9] Chen D, Livne-bar I, Vanderluit J L,etal. Cell-specific effects of RB or RB/p107 loss on retinal development implicate an intrinsically death-resistant cell-of-origin in retinoblastoma [J]. Cancer cell, 2004,5(6): 539-551.
[10] MacPherson D, Sage J, Kim T,etal. Cell type-specific effects of Rb deletion in the murine retina [J]. Genes Dev, 2004,18(14): 1681-1694.
[11] Dyer M A, Bremner R. The search for the retinoblastoma cell of origin[J]. Nat Rev Cancer, 2005,5(2): 91-101.
[12] Zhang J, SchweersB, Dyer M A. The first knockout mouse model of retinoblastoma[J]. Cell Cycle, 2004,3(7): 952-959 .
[13] McFall R C, Sery T W, Makadon M. Characterization of a new continuous cell line derived from a human retinoblastoma[J]. Cancer Res, 1977, 37(8): 1003-1010.
[14] Dyer M A, Rodriguez-Galindo C, Wilson M W. Use of preclinical models to improve treatment of retinoblastoma [J]. PLoS Med, 2005,2(10): e332.
(2014-05-20收稿 2014-08-15修回)
(责任编辑 武建虎)
Development of a new retinoblastoma mouse model
YI Shiqin1, LI Yanshan2, MIAO Lixia2, SUN Yanfeng2, WANG Jun2, LIU Hongyan2, YANG Xinji2, and LIU Qiuling2.
1. Xuzhou Medical College, Xuzhou 221002, China; 2. Department of Pediatrics, The General Hospital of Chinese People’s Armed Police Forces, Beijing 100039, China
Objective To establish a retinoblastoma model and provide an animal model for the new treatment of RB. Methods Forty CD1 postnatal day 1 mice were randomly divided into 4 groups ( A,B, C, D), 10 in each. We set the right eye of each mouse as experiment group and the left as control. Different density of RB-Y9 cells(A 2.0×107/ml,B 3.0×107/ml,C 3.5×107/ml,D 4.0×107/ml, 4 μl/one) were injected into the vitreous cavity of right eyes, and the left eyes were injected with the same volume of cell culture medium. We closely monitored the tumor growth after injection and found the most appropriate density of the cells for the model construction. We used HE staining to analyze the tumor formation and histology and convinced that the tumor was RB. Results After the cell injection, we found no tumor formation in control group and most mice in the experiment group had tumors. Different density of injeced cells resulted in different rates of survival and tumor formation: the rate of tumor formation in the above 4 groups were 20%,80%,100% and 100% and the survival rates were100%,80%,80% and 50%. We regarded the C group (the density of the cells was 3.5×107/ml) as the best model for the experiment. HE staining of the tumor tissues implied that the structure of right eyes were severely destroyed and the cells had different size and were irregularly shaped: some were circular, oval and others were polygonal or irregular. The tumor cells had less cytoplasm and bigger nuclei when compared with normal controls. Cells with more than 1-2 nuclei can be frequently observed. Conclusions By injecting RB-Y79 cells in the vitreous cavity of neonatal mice can successfully develop the RB mouse model.
CD1 postnatal day 1mice; retinoblastoma; transplanted tumor model
伊世芹,硕士,医师,E-mail: yishiqin2006@163.com
1. 221002,徐州医学院;2.100039北京,武警总医院儿科
刘秋玲,E-mail:wj670@vip.sina.com
R73-35

