运动训练抑制了TGFβ通路并缓解了D-半乳糖诱导衰老大鼠的肌肉流失
王今越,王小虹,冯维斗
运动训练抑制了TGFβ通路并缓解了D-半乳糖诱导衰老大鼠的肌肉流失
王今越1,王小虹2,冯维斗3
目的:研究TGFβ(经典和非经典)通路在运动缓解衰老性肌肉流失(少肌症)中的作用。方法:24只雄性Wistar大鼠分为3组,C组(青年安静组)、S组(40d D-半乳糖注射致衰老组)、E组(40d D-半乳糖注射+6 wk跑台运动的衰老运动组)。检测各组大鼠体重、腓肠肌重量、TGFβ(经典与非经典)通路因子——TGFβ1、MSTN、Phospho-smad2/3、Phospho-MAPKs(p38、JNK1/2 、ERK1/2) 及通路效应因子——p21、Pax7(WB法)、MyoD mRNA、MyoG mRNA(RT-PCR法)。结果:与C组相比,S组腓肠肌比重(腓肠肌重量/体重)降低,TGFβ1、MSTN、Phospho-smad2/3、Phospho-MAPKs (Phospho-p38、Phospho-JNK1/2、Phospho-ERK1/2)、p21、MyoD mRNA、MyoG mRNA升高,Pax7降低;与S组相比,E组腓肠肌比重升高,TGFβ1、MSTN、Phospho-smad2/3、Phospho-MAPKs (Phospho-JNK1/2、Phospho-ERK1/2)降低,p21、Pax7、MyoD mRNA、MyoG mRNA升高。结论:运动训练抑制了TGFβ经典及非经典通路并缓解了衰老肌肉的流失,Pax7、p21、MyoD、MyoG可能作为TGFβ通路的效应器介导了该过程。
TGFβ通路;少肌症;D-半乳糖;运动;鼠;动物实验
衰老性肌肉流失(少肌症)是一种普遍存在、以肌肉质量和力量退行性损失为特征的疾病,它限制人体活动能力,间接加重了多种老年常见症状(II型糖尿病、动脉硬化、骨质疏松),损害了老年人的生活质量,提高了健康成本和社会负担。规律的运动训练可改善肌肉的结构和功能,对于预防和缓解少肌症作用明显。尽管相关研究很多,然而,少肌症的运动性干预乃至少肌症发生本身的分子机制却仍不完全明晰。
TGFβ信号在调控肌肉质量及功能方面起重要作用,它抑制卫星细胞激活、生肌分化、肌母细胞融合、肌肉特异性蛋白表达,促进胶原蛋白合成、肌母细胞纤维化、疤痕生成[40]。上升的报道显示,TGFβ信号激活与肌肉损伤、肌肉营养不良、胰岛素抵抗诱发的肌肉萎缩和肌肉纤维化均有密切关联[11]。近来,有研究报道,肌肉TGFβ信号增强损害了肌肉再生是少肌症发生的重要原因[12,41]。此外,活体研究显示,多种组织(心肌[25]、脾[46]、动脉血管[42]、肺[38])的TGFβ信号对运动敏感。TGFβ信号在少肌症运动性干预中的作用值得关注。
机制上,TGFβ信号始于TGFβ超家族与细胞膜表面TYPE I和TYPE II受体的结合,继而引起TYPE I受体交互磷酸化,再磷酸化下游效应器[10]。经典TGFβ信号(smad依赖性)中,TYPE I受体交互磷酸化后磷酸化smad2/3,再与smad4结合,然后转位进入胞核,发挥转录因子作用[10]。非经典TGFβ信号(smad非依赖性)主要是MAPKs依赖性,即TYPEI受体磷酸化后磷酸化MAPKs,MAPKs继而调节下游因子的活动[10]。已知的TGFβ超家族成员包括TGFβ、MSTN、活化素、抑制素、缪勒氏管抑制质和骨形成蛋白,其中, TGFβ、MSTN对骨骼肌质量和功能调节作用尤为重要[43]。
Pax7、p21、MyoD、MyoG是肌肉发生进程及肌肉质量的关键调控剂[45],亦为TGFβ信号的效应器——TGFβ经典
及非经典信号均抑制Pax7、p21表达[3,4,43],前者亦抑制MyoD、MyoG的基因表达[43]。
本研究检测了衰老(D-半乳糖诱导)和运动对于TGFβ经典与非经典信号关键因子及上述效应因子的影响,探究TGFβ信号相关的少肌症发生和少肌症的运动性缓解中的分子事件,为完善运动性肌肉重塑信号网络及少肌症的运动性干预提供视角和靶点。
1 材料与方法
1.1 动物分组及运动方案
购入24只清洁级雄性10周、230~270 g Wistar大鼠(许可证:SCXK 吉2009-0004)。适应性训练3天后随机分组:C组6只、S、E组各9只,次日(周一)执行表1方案。各组大鼠自由进食,国家标准啮齿类动物常规饲料喂养。动物饲养环境温度23℃,湿度40%~60%。

表 1 本研究动物分组方案一览表
1.2 取材
大鼠以断颈椎方式处死(处死前2 h禁食),称重后取右后腿,用4℃预冷的生理盐水清洗,去处血污,滤纸吸干水分,称重后切分成数段,锡箔纸包裹,做好标签,浸入液氮30 min后放入-80℃超低温冰箱冷冻待测。意外死亡或无法完成运动方案而淘汰大鼠S组1只、E组2只。
1.3 主要试剂及试剂盒
D-半乳糖,Sigma公司;TGFβ1抗体(兔来源)、MSTN抗体(兔来源)、Pax7 抗体(小鼠来源)、p21抗体(小鼠来源),Santa Cruz公司;Phospho-Smad2 (Ser465/467)/Smad3 (Ser423/425)抗体(兔来源)、Phospho-p38 MAPK (Thr180/Tyr182)抗体 (兔来源)、Phospho- ERK (Thr202/Tyr204)抗体(兔来源)、Phospho- JNK (Thr183/Tyr185)抗体(小鼠来源)、tubulin抗体(兔来源),Cell Signal;Trizol总RNA提取试剂 :Tiangen;Biort RT-PCR assasy kit:博日生物公司;抗兔、抗小鼠二抗、Trizol总RNA提取kit,碧云天。
1.4 方法
1.4.1 腓肠肌比重
腓肠肌比重=大鼠右后腿腓肠肌湿重/处死时的全身湿重×100%。
1.4.2 蛋白测定
1.细胞蛋白提取:取50~100 mg腓肠肌放入小烧杯中,加入1 ml提前预冷的匀浆介质(210 mM甘露醇,70 mM蔗糖,5 mM Tris-HCl,1 mM EDTA,0.1 mM PMSF,0.5 mM DTT,10 mM NaF)。剪碎肌组织,去除结缔组织、脂肪等。电动匀浆,转速1 500~1 800 rpm,使组织匀浆化。匀浆液倒入离心管,1 400 g 4℃离心10 min;吸取上清即蛋白样品,BCA法定量。
2.Western Blotting测定上述蛋白含量。一般步骤略。聚丙烯酰胺凝胶浓度12%;抗体稀释[TGFβ1 1∶1 200;MSTN 1∶1 000;P-Smad2(Ser465/467)/Smad3 (Ser423/425)1∶900;P-p38 MAPK(Thr180/Tyr182)1∶1 500;P-
Erk1/2(Thr202/Tyr204)1∶1 200;P-SAPK/JNK(Thr183/Tyr185)1∶1 000;P-p21 1∶900;Pax7 1∶1 200;tubulin 1∶2 000];蛋白表达值为条带的灰度值,以内参tubulin校正。
1.4.3 mRNA测定
按照Trizol Reagent液说明书提取总RNA,总RNA的质量和纯度检测采用变性琼脂糖凝胶电泳和紫外分光检测OD260/OD280比值,依据质量和纯度选取符合RT-PCR要求的RNA进行逆转录反应。按照Biort RT-PCR kit说明书进行cDNA的逆转录,总RNA经RT反应后进行PCR扩增,采用25 μL体系。PCR循环条件:1)95℃ 5 min;2)95℃ 30 s;3)(MyoD:60℃;MyoG:62℃)40 s;4)72℃ 1 min;5)回至第2步,25个循环;6)72℃ 10 min;7)保持在4℃。 PCR产物加样于2%琼脂糖凝胶、电泳(上样量12 μl,6×DNA loading buffer 2 μl,电压150 v,电泳35 min)。mRNA含量为条带的OD值,以内参GAPDH校正。引物(5′-3′)如下:1)MyoD F:CCCGACGCGTCTCTCTGCTCCTT R:CGCCTGGCGCTGGGTGCA(178 kp);2)MyoG F:GAGCGCGATCTCCCGTCAAGAGG R:CTGGCTTGTGCGAGCCCAGG(688 kp);3)GAPDH F:ACAGCAACAGGGTGGTGGAC R:TTTGAGGGTGCAGCGAACTT(252 kp)
1.5 统计学处理

则SNK法进行事后检验。统计学显著性水平定为0.05。
2 结果
2.1 体重、腓肠肌比重
S组大鼠与C组相比较,体重、腓肠肌比重均下降;E组大鼠与S组相比较两指标均升高。此外,E组与C组比较无统计学意义,仅在图表标注,在此及下文中不再赘述(图1)。
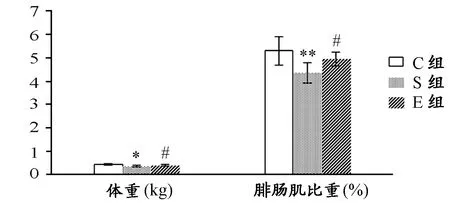
图 1 本研究(D-半乳糖诱导)衰老、运动对体重及腓肠肌比重的影响
2.2 TGFβ通路相关因子
与C组相比,S组大鼠TGFβ1、MSTN、Psmad2/3、Pp38、PJNK2/1、PERK1/2、p21、MyoD mRNA、MyoG mRNA升高,Pax7降低;与S组相比,E组TGFβ1、MSTN、Psmad2/3、 PJNK2/1、PERK1/2降低,Pp38不变,p21、Pax7、MyoD mRNA、MyoG mRNA升高(图2)。

图 2 本研究(D-半乳糖诱导)衰老、运动对TGFβ通路相关因子的影响示意图
3 讨论
3.1 衰老、运动对腓肠肌比重的影响
以往研究显示,规律性运动训练对阻止衰老肌肉质量流失有明显效果[16,17,24,26,36,37], 本研究表明,腓肠肌比重(腓肠肌重量/体重)为衰老组下降(vs.青年组,下同),运动组上升(vs.衰老组,下同)。提示,衰老大鼠的肌肉率下降,而运动抑制了肌肉流失,结果符合少肌症发生及少肌症运动性缓解的研究目的。
3.2 衰老、运动对 TGFβ通路因子的影响
TGF-β是广泛表达的、TGFβ家族最典型的成员,以二聚物复合体形式合成,在某些条件下(如损伤修复和重塑)裂解激活。在哺乳动物成体骨骼肌中,存在TGF-β1、2、3三个亚型,其中,对TGF-β1的研究最广泛[9]。TGF-β在成体肌肉的再生和衰老过程中抑制卫星细胞增殖、生肌分化、肌母细胞融合、促进纤维化,诱发肌肉质量和功能的缺失[22]。但也有研究报道,低剂量的TGF-β1能促进原代肌母细胞的增殖[12]。骨骼肌中的TGF-β的主要来源并非是肌细胞,而是免疫细胞(巨噬细胞、淋巴细胞),在炎症反应过程中,TGF-β在炎症介质(白介素、NF-κB等)及ROS的作用下上调、激活,继而调节组织损伤愈合及组织纤维化[10]。衰老本身就是慢性的炎症加剧、ROS积累的过程,而规律性运动能够抑制慢性炎症及ROS,故运动对炎症和ROS的抑制作用可以解释本研究显示的运动对衰老诱导TGF-β1升高的抑制。作为肌肉生长抑素,TGF-β1的改变也能够解释衰老肌质量流失的运动性抑制及衰老肌肉流失本身。本结果与以往动物研究显示的长期运动抑制衰老动物的心肌[25]、脾[46]、动脉血管[42]、肺[38]的TGF-β1的上调结果一致,也提示,这些组织中TGF-β1有共同的调节机制,可能都与炎症及ROS相关。
TGF-β家族另一个代表成员MSTN同样是典型肌肉抑素,MSTN纯合子基因删除的小鼠肌肉是普通小鼠2~3倍,其肌纤维数量和体积均上调[32],肌纤维附着的卫星细胞数量和活性提高[29]。运动领域的人体研究显示,消瘦的老人[18,24]、胰岛素抵抗患者[18]、慢性心力衰竭患者[28]肌肉的MSTN[18,28,31]及/或其mRNA[24,28,31]的升高趋势在长期运动后得到抑制,且消瘦老人肌肉横截面与力量[24]提高,胰岛素抵抗患者[18]与慢性心律衰竭患者[28]的症状改善。最近,Dalbo等[13]报道,力量训练降低了老年人肌肉MSTN mRNA,但对青年人无效,该研究认为,运动对MSTN表达的抑制仅发生于MSTN高表达者(肌肉快速流失的老人或病患),本结果与以往研究一致——运动抑制了MSTN的上调,提示,MSTN参与了少肌症的运动性抑制。MSTN对肌肉抑制的机制与TGF-β基本一致[22],但MSTN是否在卫星细胞增殖和自我更新环节起抑制作用还存在相当的争议[22,29],有报道,MSTN敲除的小鼠卫星细胞数量和活性未受影响, 而且,MSTN也未能抑制原代成体肌母细胞的增殖[7]。如果确实如此,那么,MSTN的肌肉抑素作用可能主要源于肌核特异性基因表达或者肌母细胞分化的抑制,对此尚无相关调查,有待查证。此外,MSTN还能通过促进成纤维细胞增殖、激活以及诱导促炎症因子和巨噬细胞迁移[22],诱发肌肉纤维化及炎症级联,导致肌细胞的变性、凋亡、坏死,从而负面影响肌肉质量和功能。
本研究发现,TGF-β经典通路中,TGFβ、MSTN的效应器smad2/3的磷酸化表达上调也被运动所抑制。综上提示,TGFβ经典通路(TGFβ1、 MSTN/smad)参与少肌症运动性抑制及少肌症发生本身。
MAPK是TGFβ非经典通路的最重要的组件,广泛的参与了骨骼肌各种适应性改变。其中,p38、JNK参与细胞炎症、凋亡、生长、分化,而ERK参与了生长、分化、发育[10]。MAPK暂时性激活对于肌肉发育、肌肉量保持有积极作用,能够促进肌母细胞增殖或分化,促进肌肉特异性基因表达[21],但持续激活对肌肉呈负面作用——ERK抑制肌肉特异性基因表达和肌母细胞分化[21],p38和JNK均会通过激活泛素蛋白酶体通路及促凋亡因子的表达加速蛋白质的分解[27]。本研究显示,与TGFβ1、MSTN变化一致,衰老组MAPKs激活(Pp38、PJNK、PERK升高),而运动后MAPKs激活被抑制(PJNK、PERK下调)。提示,TGFβ非经典通路(MAPK依赖性)也参与了少肌症发生及其运动性抑制。本结果与以往Williamson等(2003)、Dasgupta等(2009)的报道“衰老动物肌肉p38、JNK1/2、ERK1/2磷酸化水平上调”一致。但也有不同报道,Rahnert等(2011)报道,衰老大鼠肱二头肌ERK磷酸化水平下降,JNK与p38磷酸化水平不变。矛盾的结果可能与研究选用的大鼠年龄差异有关,多数研究选用衰老大鼠为22~24月龄,而Rahnert等(2011)的实验对象为26月龄大鼠,显然,Rahnert实验动物衰老程度更高,可能衰老的后期与晚期的MAPK调控机制有所不同,对此有待查证。最近,Olesen等(2013)报道,衰老小鼠肌肉p38、JNK磷酸化水平并未改变,但该研究所用为16月龄小鼠,显然,其研究对象过于年轻健康,不够衰老。需要指出,本研究测试采用是磷酸化蛋白水平(目标磷酸化蛋白/常规内参),而上述Williamson等(2003)、Dasgupta等(2009)、Rahnert等(2011)和Olesen等(2013)的测试均为蛋白磷酸化水平(目标磷酸化蛋白/目标总蛋白),前者代表磷酸化蛋白含量,后者代表蛋白磷酸化程度,意义和衡量方法虽然有所差异,但均反映MAPK激活的状况,并在研究中广泛应用[20,27],且MAPKs总蛋白表达变化远不如磷酸化修饰敏感,对其功能影响很有限[20],故总体上两个指标波动是一致的,本研究以磷酸化蛋白含量与文献中蛋白磷酸化水平进行波动趋势比较并无不妥。
TGFβ、smad、MAPKs的变化(运动后TGFβ1、 MSTN、P-smad、P-MAPKs下调)表明,运动对衰老骨骼肌TGFβ经典(TGFβ1、 MSTN/smad)及非经典信号(TGFβ1、 MSTN/MAPKs)均有抑制作用,这可以至少部分解释少肌症的运动性抑制效用。
3.3 衰老、运动对TGFβ信号下游生肌因子的作用
成体肌肉发生经历卫星细胞(增殖、分化)→肌母细胞(分化)→单核前体肌细胞(分化、融合)→多核肌纤维的多个阶段,MyoD、MyoG、Pax7、p21则为不同阶段重要驱动者和分子标志,MyoD在细胞循环中的肌母细胞表达,MyoG在单核前体肌细胞分化及融入肌纤维过程中表达,Pax7在卫星细胞激活、增殖过程中表达,p21则在肌母细胞退出细胞循环过程表达[11]。它们均为TGFβ信号干预肌肉质量的重要效应器——经典TGFβ信号抑制MyoD、MyoG mRNA含量[3,4,11],TGFβ经典和非经典通路均能抑制p21、Pax7表达[3,4,11,19]。
涉及MyoD、MyoG指标的研究报道较多,但结果很不一致,Alway等(2002)报道,衰老大鼠肌肉MyoD、MyoG mRNA降低,而Raue等(2006)、Kim等(2005)的自然衰老动物及一项D-半乳糖诱导衰老大鼠的研究[1]结果正好相反。在运动领域研究中,McKay等(2008)报道,急性抗阻运动后,人体股四头肌MyoD、MyoG mRNA上调,Drummond等(2010)报道,急性抗阻运动后,大鼠红股四头肌MyoD、MyoG mRNA均上升,而白股四头肌则未变;Alway等(2002)报道,14天的肌肉负重提高成年大鼠MyoD和MyoG mRNA,而对衰老大鼠(33月龄)无效;Siu等(2004)报道,8周耐力跑台运动后,大鼠比目鱼肌的MyoG mRNA、蛋白水平均升高,MyoD mRNA、蛋白则不变。上述研究表明,运动对MyoD、MyoG的诱导受肌肉快慢类型、衰老程度影响。本研究显示,衰老组MyoD、MyoG mRNA上调,运动后则进一步上调,提示,衰老进程中MyoD、MyoG的作用是抵抗而非促进少肌症的发生,且运动能够进一步强化MyoD、MyoG的作用。本研究发现,与MyoD、MyoG变化一致——衰老组p21升高,运动组进一步上升,但Pax7则在衰老组下降,运动组Pax7同样上调,提示,衰老肌中,p21拮抗而Pax7促进肌肉流失,而运动后,p21及Pax7的升高明显均对肌肉流失起到抑制作用。从上述4个生肌因子与TGFβ通路的变化而言,显然,衰老条件下,增强的TGFβ信号通路不可能解释Pax7外3个因子变化(MyoD、MyoG mRNA、p21均升高),三者一定另外有其他主导因素,而运动诱导下,4个因子的改变(MyoD、MyoG mRNA、p21、Pax7均升高)至少部分应与TGFβ通路的抑制相关。
4 总结
TGFβ经典和非经典信号的增强是诱发少肌症因素之一,Pax7可能作为TGFβ信号效应器介导了该过程。运动训练通过抑制TGFβ经典和非经典信号缓解少肌症, p21、Pax7、MyoD、MyoG可能在TGFβ信号诱导下介导了该过程。条件所限,上述结论仍需在自然衰老动物并通过信号阻断剂、激活剂等手段进一步确认。
[1]王今越,王小虹,冯维斗.IRS1,Akt,FOXO1 在少肌症发生及其运动性缓解中的作用[J].成都体育学院学报,2012,38(7):86-91.[2]徐智,吴国明,钱桂生,等.大鼠衰老模型的初步建立[J].第三军医大学学报,2003,25(4):312-315.
[3]ACHARJEE S,CHUNG T K,GOPINADHAN S,etal.Sharp-1 regulates TGF-beta signaling and skeletal muscle regeneration[J].J Cell Sci,2014,127(3):599-608.
[4]ACUNA M J,PESSINA P,OLGUIN H,etal.Restoration of muscle strength in dystrophic muscle by angiotensin-1-7 through inhibition of TGF-beta signalling[J].Hum Mol Genet,2014,23(5):1237-1249.
[5]ALWAY S E,DEGENS H,LOWE D A,etal.Increased myogenic repressor Id mRNA and protein levels in hindlimb muscles of aged rats[J].Am J Physiol Regul Integr Comp Physiol,2002,282(2):411-422.
[6]ALWAY S E,DEGENS H,KRISHNAMURTHY G,etal.Potential role for Id myogenic repressors in apoptosis and attenuation of hypertrophy in muscles of aged rats[J].Am J Physiol Cell Physiol,2002,283(1):66-76.
[7]AMTHOR H,OTTO A,VULIN A,etal.Muscle hypertrophy driven by myostatin blockade does not require stem/precursor-cell activity[J].Proceedings National Acad Sci,2009,106(18):7479-7484.
[8]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Applied Physiol,1979,47(6):1278-1283.
[9]BEGGS M L,NAGARAJAN R,TAYLOR-JONES J M,etal.Alterations in the TGFbeta signaling pathway in myogenic progenitors with age[J].Aging Cell,2004,3(6):353-361.
[10]BURKS T N,AND COHN R D.Role of TGF-beta signaling in inherited and acquired myopathies[J].Skelet Muscle,2011,1(1):19-28.
[11]BURKS T N,ANDRES-MATEOS E,MARX R,etal.Losartan restores skeletal muscle remodeling and protects against disuse atrophy in sarcopenia[J].Sci Transl Med,2011,3(82):12-37.
[12]CARLSON M E,CONBOY M J,HSU M,etal.Relative roles of TGF-beta1 and Wnt in the systemic regulation and aging of satellite cell responses[J].Aging Cell,2009,8(6):676-689.
[13]DALBO V J,ROBERTS M D,HASSELL S,etal.Effects of pre-exercise feeding on serum hormone concentrations and biomarkers of myostatin and ubiquitin proteasome pathway activity[J].Eur J Nutr,2013,52(2):477-487.
[14]DASGUPTA J,KAR S,VAN REMMEN H,etal.Age-dependent increases in interstitial collagenase and MAP Kinase levels are exacerbated by superoxide dismutase deficiencies[J].Exp Gerontol,2009,44(8):503-510.
[15]DRUMMOND M J,CONLEE R K,MACK G W,etal.Myogenic regulatory factor response to resistance exercise volume in skeletal muscle[J].Eur J Appl Physiol,2010,108(4):771-778.
[16]EVANS W J.Effects of exercise on senescent muscle[J].Clin Orthop Relat Res,2002,40(3):211-220.
[17]EVANS W J,CAMPBELL W W.Sarcopenia and age-related changes in body composition and functional capacity[J].J Nutr,1993,123(2):465-468.
[18]HITTEL D S,AXELSON M,SARNA N,etal.Myostatin decreases with aerobic exercise and associates with insulin resistance[J].Med Sci Sports Exe,2010,42(11):2023-2029.
[19]HULMI J J,KOVANEN V,LISKO I,etal.The effects of whey protein on myostatin and cell cycle-related gene expression responses to a single heavy resistance exercise bout in trained older men[J].Eur J Appl Physiol,2008,102(2):205-213.
[20]ISHII N.Progress of research and development of MAPK pathway inhibitors[J].Nihon Yakurigaku Zasshi,2013,141(1):15-21.
[21]JONES N C,FEDOROV Y V,ROSENTHAL R S,etal.ERK1/2 is required for myoblast proliferation but is dispensable for muscle gene expression and cell fusion[J].J Cell Physiol 2001,186(1):104-115.
[22]KEMALADEWI D U,AT HOEN P,TEN DIJKE P,etal.TGF-β signaling in Duchenne muscular dystrophy[J].Future Neurology,2012,7(2):209-224.
[23]KIM J S,KOSEK D J,PETRELLA J K,etal.Resting and load-induced levels of myogenic gene transcripts differ between older adults with demonstrable sarcopenia and young men and women[J].J Appl Physiol (1985),2005,99(6):2149-2158.
[24]KONOPKA A R,DOUGLASS M D,KAMINSKY L A,etal.Molecular adaptations to aerobic exercise training in skeletal muscle of older women[J].J Gerontol A Biol Sci Med Sci,2010,65(11):1201-1207.
[25]KWAK H B,KIM J H,JOSHI K,etal.Exercise training reduces fibrosis and matrix metalloproteinase dysregulation in the aging rat heart[J].FASEB J,2011,25(3):1106-1117.
[26]LACOUR J R,KOSTKA T,BONNEFOY M.Physical activity to delay the effects of aging on mobility[J].Presse Med,2002,31(25):1185-1192.
[27]LEMIRE B B,DEBIGARE R,DUBE A,etal.MAPK signaling in the quadriceps of patients with chronic obstructive pulmonary disease[J].J Appl Physiol,2012,113(1):159-166.
[28]LENK K,ERBS S,HOLLRIEGEL R,etal.Exercise training leads to a reduction of elevated myostatin levels in patients with chronic heart failure[J].Eur J Prev Cardiol,2012,19(3):404-411.
[29]MCCROSKERY S,THOMAS M,MAXWELL L,etal.Myostatin negatively regulates satellite cell activation and self-renewal[J].J Cell Biol,2003,162(6):1135-1147.
[30]MCKAY B R,O’REILLY C E,PHILLIPS S M,etal.Co-expression of IGF-1 family members with myogenic regulatory factors following acute damaging muscle-lengthening contractions in humans[J].J Physiol,2008,586(22):5549-5560.
[31]MCKAY B R,OGBORN D I,BELLAMY L M,etal.Myostatin is associated with age-related human muscle stem cell dysfunction[J].FASEB J,2012,26(6):2509-2521.
[32]MCPHERRON A C,LAWLER A M,LEE S J.Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member[J].Nature,1997,387(6628):83-90.
[33]OLESEN J,RINGHOLM S,NIELSEN M M,etal.Role of PGC-1alpha in exercise training- and resveratrol-induced prevention of age-associated inflammation[J].Exp Gerontol,2013,48(11):1274-1284.
[34]RAHNERT J A,LUO Q,BALOG E M,etal.Changes in growth-related kinases in head,neck and limb muscles with age[J].Exp Gerontol,2011,46(4):282-291.
[35]RAUE U,SLIVKA D,JEMIOLO B,etal.Myogenic gene expression at rest and after a bout of resistance exercise in young (18-30 yr) and old (80-89 yr) women[J].J Appl Physiol,2006,101(1):53-59.
[36]ROBINSON M M,TURNER S M,HELLERSTEIN M K,etal.Long-term synthesis rates of skeletal muscle DNA and protein are higher during aerobic training in older humans than in sedentary young subjects but are not altered by protein supplementation[J].FASEB J,2011,25(9):3240-3249.
[37]ROGERS M A,EVANS W J.Changes in skeletal muscle with aging:effects of exercise training[J].Exe Sport Sci Rev,1993,21(65):90-102.
[38]SILVA A C,VIEIRA R P,NISIYAMA M,etal.Exercise inhibits allergic lung inflammation[J].Int J Sports Med,2012,33(5):402-409.
[39]SIU P M,DONLEY D A,BRYNER R W,etal.Myogenin and oxidative enzyme gene expression levels are elevated in rat soleus muscles after endurance training[J].J Appl Physiol,2004,97(1):277-285.
[40]SMITH C A,STAUBER F,WATERS C,etal.Transforming growth factor-beta following skeletal muscle strain injury in rats[J].J Appl Physiol,2007,102(2):755-761.
[41]TRENDELENBURG A U,MEYER A,JACOBI C,etal.TAK-1/p38/nNFkappaB signaling inhibits myoblast differentiation by increasing levels of Activin A[J].Skelet Muscle,2012,2(1):3-12.
[42]WANG M,ZHAO D,SPINETTI G,etal.Matrix metalloproteinase 2 activation of transforming growth factor-beta1 (TGF-beta1) and TGF-beta1-type II receptor signaling within the aged arterial wall[J].Arterioscler Thromb Vasc Biol,2006,26(7):1503-1509.
[43]WATTS R,MCAINCH A J,DIXON J B,etal.Increased Smad signaling and reduced MRF expression in skeletal muscle from obese subjects[J].Obesity (Silver Spring),2013,21(3):525-528.
[44]WILLIAMSON D,GALLAGHER P,HARBER M,etal.Mitogen-activated protein kinase (MAPK) pathway activation:effects of age and acute exercise on human skeletal muscle[J].J Physiol,2003,547(3):977-987.
[45]ZHAO X,YU Q,HUANG L,etal.Patterns of positive selection of the myogenic regulatory factor gene family in vertebrates[J].PLoS One,2014,9(3):928-939.
[46]ZHOU D,CHREST F J,ADLER W,etal.Increased production of TGF-beta and Il-6 by aged spleen cells[J].Immunol Lett,1993,36(1):7-11
ExerciseTrainningInhibitingTGFβPathwayandImprovingD-GlactoseInjection-inducedSenescentMuscleLossinRat
WANG Jin-yue1,WANG Xiao-hong2,Feng Wei-dou3
Objectvie:To explore the functions of (canonical and uncanonical) TGFβ pathway in exercise-induced improvement of sarcopenia.Method:24 male wistar rats were divided into 3 groups:C group (quiet young group),S group (40day D-Glactose injection-induced senecence),E group (40 days D-Glactose injection-induced senecence+6 weeks exercise trainning on treadmill).To detect body wet weight,gastrocnemius wet weight (by weighment),TGFβ pathway component-TGFβ1,MSTN,Phospho-smad2/3,Phospho-MAPK(p38,JNK1/2 ,ERK1/2),TGFβ pathway effector-p21,Pax7 by WB and MyoD mRNA,MyoG mRNA by RT-PCR in each group.Result:The ratio of gastrocnemius weight to body weight decreased,but TGFβ1,MSTN,Phospho-smad2,3 ,Phospho-p38,Phospho-JNK1,2,Phospho-ERK1,2,p21,MyoD mRNA,MyoG mRNA increased and Pax7 decreased in S group vs C group.The ratio of gastrocnemius weight to body weight increased,but TGFβ1,MSTN,Phospho-smad2,3 ,Phospho-JNK1,2,Phospho-ERK1,2 decreased,Phospho-p38 unchanged ,and p21 ,Pax7,MyoD mRNA,MyoG mRNA increased in E group vs S group.Conclusion:Exericse trainning can improve senescene-induced muscle loss by inhibiting TGFβ canonical and uncanonical pathway with the mediation of Pax7,p21,MyoD and MyoG.
TGFβ;pathway;sarcopenia;D-Glactose;exercise;rat;animalexperiment
1000-677X(2014)10-0072-06
2014-04-13;
:2014-09-15
广东省教育厅科研项目(2012WYM_0126);吉林省科技发展计划(20100593)。
王今越(1978-),男,满族,长春人,副教授,博士,主要研究方向为运动适应和机能评定,E-mail:wjytnt@163.com。
1.佛山大学 体育学院,广东 佛山 528000;2.东北师范大学 体育学院,吉林 长春 130026;3.吉林省体育科学研究所,吉林 长春130022 1.Foshan University,Foshan 528000,China;2.Northeast Normal University,Changchun 130026,China;3.Jinlin Province Sport Rearch institute,Changchun 130022,China.
G804.2
:A

