绿原酸对体外培养的人鼻咽癌细胞株CNE-1的作用
姚素艳,李全胜,郑德宇
(1. 辽宁医学院病理生理学教研室,辽宁锦州 121001;2. 盘锦市中心医院耳鼻喉科,辽宁盘锦 124000;3. 辽宁医学院解剖学教研室,辽宁锦州 121001)
◇中医药研究◇
绿原酸对体外培养的人鼻咽癌细胞株CNE-1的作用
姚素艳1,李全胜2,郑德宇3
(1. 辽宁医学院病理生理学教研室,辽宁锦州 121001;2. 盘锦市中心医院耳鼻喉科,辽宁盘锦 124000;3. 辽宁医学院解剖学教研室,辽宁锦州 121001)
目的 探讨绿原酸(chlorogenic acid, CHA)对体外培养状态下人鼻咽癌细胞株CNE-1的作用及其机制。方法 在无菌状态下复苏人鼻咽癌细胞株CNE-1,取传4代的细胞,向培养基内加入CHA,使其终浓度达到0、25、50、100、200、500 μmol/L,应用CCK-8体外抑制实验进行筛选CHA的最佳抑癌浓度。选择CHA最佳抑癌浓度,作用于CNE-1细胞系。检测人鼻咽癌细胞株CNE-1中端粒酶活性、抑癌基因p27和p16的表达、细胞周期蛋白(cyclin D1)和细胞周期蛋白依赖激酶(CDK4)的表达。结果 经CCK-8体外抑制实验进行筛选CHA的最佳抑癌浓度为100 μmol/L。人鼻咽癌细胞株CNE-1的培养基中加入终浓度为100 μmol/L的CHA,维持10 d,CNE-1细胞株中其端粒酶活性为1.621,远低于试剂盒中的阳性对照和未处理的CNE-1细胞株,差异具有统计学意义(P<0.01)。应用CHA处理CNE-1细胞株10 d后,抑癌基因p27和p16均有少量的表达,而在阳性对照组(HT1080细胞)和未处理的CNE-1细胞几乎没有表达。应用CHA处理CNE-1细胞株10 d后,cyclin D1和CDK4的表达量与阳性对照组(HT1080细胞)和未处理的CNE-1细胞相比明显降低。结论 应用100 μmol/L CHA 10 d,可以降低CNE-1细胞株端粒酶活性、增加抑癌基因的表达,降低细胞周期蛋白的表达。CHA对人鼻咽癌细胞株CNE-1的作用是通过活化抑癌基因和抑制细胞周期蛋白的表达来实现的。
绿原酸;鼻咽癌;抑癌基因;细胞周期蛋白;端粒酶;p27;p16
鼻咽癌(nasopharyngeal carcinoma, NPC)是我国最常见头颈部恶性肿瘤,是威胁人类健康的十大恶性肿瘤之一[1-2]。由于鼻咽部特殊的解剖学位置,发病时多为中晚期,手术根治非常困难[3-4]。临床上手术治疗只是一种辅助治疗手段,放疗或放化综合治疗已成为鼻咽癌的主要治疗手段。研究发现p27和p16均为抑癌基因,在各种类型的肿瘤细胞中,几乎都有p27蛋白的表达降低[5]。p16蛋白能抑制细胞由G0/G1期向S期转变。细胞周期蛋白(cyclin)和细胞周期素依赖激酶4、6(cyclin dependent kinases, CDK 4,6)结合后[6],促进细胞由G0/G1期向S期转变。由于p16蛋白氨基末端具有与Cyclin D1的周期素编码区同源的区域,故p16可能与Cyclin D1竞争CDK4/CDK6的结合位点,抑制其激活酶活性,从而达到抑制细胞由G0/G1期向S期转变。在NPC组织中,p27和p16阴性表达率分别为61%~85%和71%~88%,Cyclin D1和CDK4的阳性表达率分别为56%~58%和61%~75%[7-8]。
绿原酸(chlorogenic acid, CHA)是金银花(houneysuckle flowers)的生物活性提取物,具有抗氧化、抗菌、抗病毒、免疫调节、抗肿瘤等作用[9-10]。以往的研究发现金银花的抑癌作用主要体现在CHA对肉瘤180及艾氏腹水癌有明显的细胞毒作用。CHA对于鼻咽癌的作用尚没有明确的报道。如果人鼻咽癌细胞株CNE-1在一定浓度的CHA的作用下,出现p27表达上调,CDK4下调,p16表达上调,cyclin D1的表达降低,则可以初步说明CHA具有一定的抑制人鼻咽癌的作用,可能为鼻咽癌的治疗提供一个新的选择。
1 材料与方法
1.1 实验材料 鼻咽癌细胞株CNE-1(中科院上海细胞库);CHA(金银花提取物,分子质量为354.30,纯度>98%,购自山东金宇桐生物有限公司)。高糖DMEM、胰蛋白酶和二甲基亚砜(DMSO)(Gibco公司)、新生牛血清(Hyclone)、CCK8试剂盒、p27单克隆抗体、CDK4单克隆抗体、Cyclin D1单克隆抗体、p16单克隆抗体(Sigma公司)、端粒酶ELISA检测试剂盒(武汉博士德)。
1.2 鼻咽癌细胞株的复苏及培养 从液氮罐中取出鼻咽癌细胞株CNE-1细胞冻存管,常规方法复苏,以106/mL的浓度接种于培养瓶中,在37 ℃、50 mL/L CO2饱和湿度的恒温培养箱内培养。待细胞长满培养瓶后,即细胞达到80%融合时,吸弃培养基,加入5 mL 的PBS(0.1 mol/L,pH=7.4)缓冲液洗涤细胞,然后吸弃PBS缓冲液,加入胰蛋白酶(含0.2 g/L EDTA)后置于室温消化细胞,倒置显微镜下观察细胞大部分突起回缩,加入上述培养基终止消化。将细胞移到一个15 mL离心管中以1 000 r/min离心5 min,吸弃上清,加入5 mL完全培养基,调整细胞浓度,按1×105/mL接种于培养瓶中,放置于37 ℃、50 mL/L CO2饱和湿度的恒温培养箱内进行传代培养。根据实验的要求取传4代的细胞进行实验。
1.3 CHA最适浓度的筛选
①细胞培养。将CNE-1细胞分为6组:阴性对照组(未加任何处理,同期培养的同代次细胞);CHA组1:在培养基中加入CHA,终浓度为25 μmol/L。CHA组2:在培养基中加入CHA,终浓度为50 μmol/L处理3 d。CHA组3:在培养基中加入CHA,终浓度为100 μmol/L处理3 d。CHA组4:在培养基中加入CHA,终浓度为200 μmol/L处理3 d。CHA组5:在培养基中加入CHA,终浓度为500 μmol/L处理3 d。阳性对照组:在培养基中加入雷公藤提取物,终浓度为100 μmol/L处理3 d。
②体外CCK-8细胞生长抑制实验。收集对数生长期的CNE-1细胞,接种于96孔板中,每孔约100 μL(2 000个细胞/孔),向培养基内加入CHA原液,使终浓度分别为0、25、50、100、200、500 μmol/L,每个浓度重复3次,将细胞放置于50 mL/L CO2、饱和湿度的37 ℃培养箱中继续培养72 h(即细胞在不同浓度的CHA作用下维持药物浓度6 d,根据文献和预实验结果,6 d时作用效果达到最佳)。向每孔中加入CCK-8 10 μL,继续培养4 h,待完全显色,用酶联免疫检测仪于450 nm波长检测每孔的吸光度A值。按公式计算出增殖率:细胞增殖率(%)=[实验组平均A值/对照组平均A值]×100%。通过增殖率,可以初步判定CHA对CNE-1的最适抑制浓度,后续实验选择此浓度为实验浓度。
③绘制细胞生长曲线。根据上一结果获得的浓度,为了进一步确定最佳的抑制浓度,选取对数生长期的CNE-1细胞,接种于24孔培养板,每孔接种500 μL细胞悬液(5×103个细胞/孔),每组设4个平行孔。常规细胞培养条件下培养加入0、75、100、125、150 μmol/L不同浓度CHA溶液,加入CCK8进行检测,连测7 d。绘制细胞生长曲线,进一步确定CHA抑制CNE-1生长的最佳浓度。其中:增殖率=CHA组吸光度值/对照组平均吸光度值×100%。
1.4 CHA对CNE-1增殖的影响
①应用ELISA检测方法检测端粒酶活性。取传4代的CNE-1,向培养基中加入CHA至其终浓度为100 μmol/L,对细胞进行正常的传代培养,维持该浓度10 d。收集细胞进行端粒酶活性PCR-ELISA检测。阳性对照组采用人纤维肉瘤HT1080细胞株(中科院细胞库),阴性对照为试剂盒自备样品。
②抑癌基因p27、p16和CDK4及Cyclin D1的检测。取传4代的CNE-1,向培养基中加入CHA至其终浓度为100 μmol/L,对细胞进行正常的传代培养,维持该浓度10 d。阳性对照组采用人纤维肉瘤HT1080细胞株,空白对照组采用未经处理的人鼻咽癌细胞株CNE-1,实验对照细胞CNE-1应用雷公藤作用10 d的细胞,取各种细胞各1×106,提取细胞总蛋白质,按Bradford法测定蛋白含量。按试剂盒的要求应用Western blot方法检测p27、p16、CDK4和Cyclin D1的表达。
2 结 果
2.1 CNE-1培养及形态学观察 细胞复苏后,复苏第一代生长较为缓慢,约为4 d才能铺满培养瓶。在传二代后,细胞生长迅速,1∶3传代,约72 h就能长满培养瓶,细胞呈近似球形或多边形,聚集在一起。在生长稀疏的部位有的有长的突起,中间部分也近似球形(图1)。
2.2 CHA对CNE-1最佳抑癌浓度的筛选 体外CCK-8细胞生长抑制实验:与对照组细胞相比,CHA作用组细胞增殖均被不同程度的抑制,CHA的浓度从25 μmol/L开始,处理组与未处理的对照组相比,CNE-1细胞的增殖率就开始明显下降(P<0.05),随着剂量的增大,细胞增殖率的下降越来越明显,呈剂量效应关系。到100 μmol/L时,CHA对CNE-1的作用达到最大。从200 μmol/L开始CHA对细胞的抑制作用开始减弱(图2)。100 μmol/L的CHA对CNE-1的抑制作用与其他各组相比差异均具有统计学意义(P<0.05)。

图1 传代培养70 h的CNE-1细胞(bar=50 μm)
Fig.1 The subculture of CNE-1 for 70 h (bar=50 μm)
细胞呈多角形或类圆形,稀疏的部位可见有长的突起。
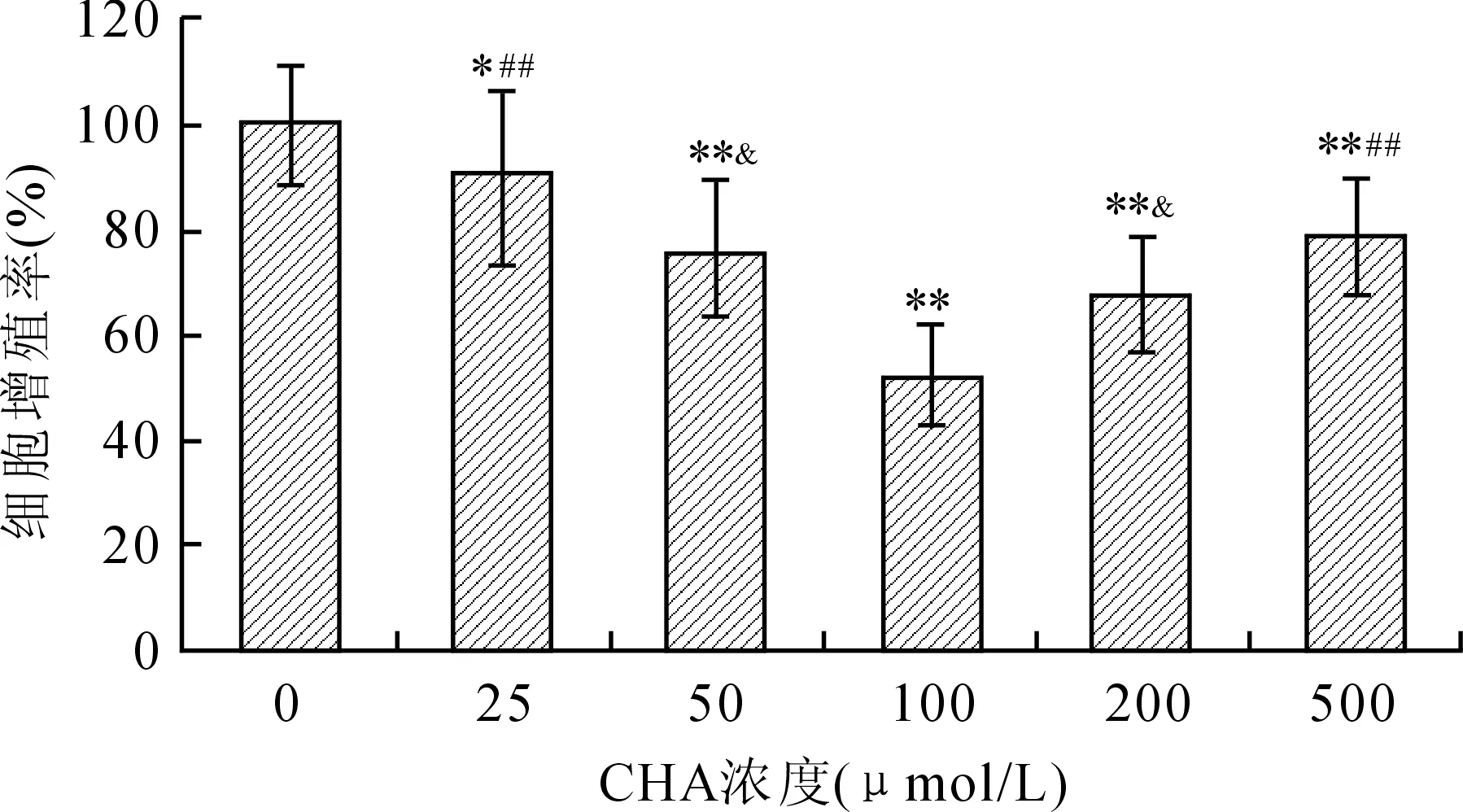
图2 不同浓度的绿原酸对鼻咽癌细胞株CNE-1的抑制作用
Fig.2 Inhibition on CNE-1 growth induced by different concentration of CHA
与0 μmol/L比较,*P<0.05,**P<0.01;与100 μmol/L 比较,&P<0.05,##P<0.01。
细胞的生长曲线:从CNE-1细胞株生长曲线可知,从75 μmol/L到150 μmol/L的各个浓度,CHA均能有效的抑制鼻咽癌细胞的生长(F=28.75,P<0.05),且随着CHA作用时间的延长,对CNE-1的抑制作用也增强,CHA作用到第6天时,抑制作用达到最佳,以后维持在较高的水平,呈时间依赖性(F=202.131,P<0.05,图3)。再结合上一个结果,CHA从25 μmol/L到500 μmol/L各个浓度中,对CNE-1的生长增殖均有不同程度的抑制作用,但以100 μmol/L的CHA的抑制作用最强。为了筛选更确切的浓度,设计并比较了从75到150 μmol/L的CHA对CNE-1的生长抑制作用,结果发现与其他浓度相比,以100 μmol/L在6 d时抑制作用最强(P<0.05)。时间与浓度之间无交互作用(F=0.733,P=0.768)。通过增殖率,可以初步判定CHA对CNE-1的最适抑制浓度为100 μmol/L,后续实验选择此浓度为实验浓度。

图3 绿原酸对人鼻咽癌细胞株CNE-1的增长抑制作用
Fig.3 Inhibition of CHA on CNE-1 growth
2.3 CHA对CNE-1细胞株的抑制作用 经过TRAP PCR ELISA检测结果显示阴性对照组的端粒酶活性为0.037,阳性对照组的端粒酶活性为3.126。正常培养的CNE-1细胞株的端粒酶活性为3.076,而应用CHA(100 μmol/L)处理10 d后的CNE-1细胞株的端粒酶活性为1.621,尽管其仍高于正常细胞,但与阳性对照组或正常培养CNE-1(0 μmol/L CHA)相比均具有显著性差异(P<0.01,图4)。说明人鼻咽癌细胞株CNE-1应用100 μmol/L的CHA处理10 d后,能有效的抑制其生长,但其仍然具有较快的生长特性。对于一般的细胞,端粒酶的活性都小于1.5,可以认为是正常范围。

图4 端粒酶活性的测定
Fig.4 Detection of telomerase activity
100 μmol/L CHA作用10 d后,与阳性对照组相比,**P<0.01;与正常培养的(0 μmol/L)CNE-1相比,##P<0.01。
从Western blot的结果可以发现,p27蛋白在100 μmol/L的CHA处理后的人鼻咽癌细胞株CNE-1中有较明显的表达,而在正常培养的CNE-1细胞中和阳性对照组(人纤维肉瘤细胞株HT1080),p27蛋白几乎检测不到(图5),偶尔能看到淡淡的条带,在实验对照组中,应用雷公藤作用10 d的CNE-1细胞中,也能看到p27蛋白的表达(图5)。说明在人鼻咽癌细胞株CNE-1中,抑癌基因p27的表达受到抑制,导致细胞癌性变,而应用100 μmol/L的CHA处理10 d后,p27的蛋白开始有较明显的表达,说明CHA通过激活抑癌基因p27,从而达到抑制鼻咽癌细胞生长的目的。
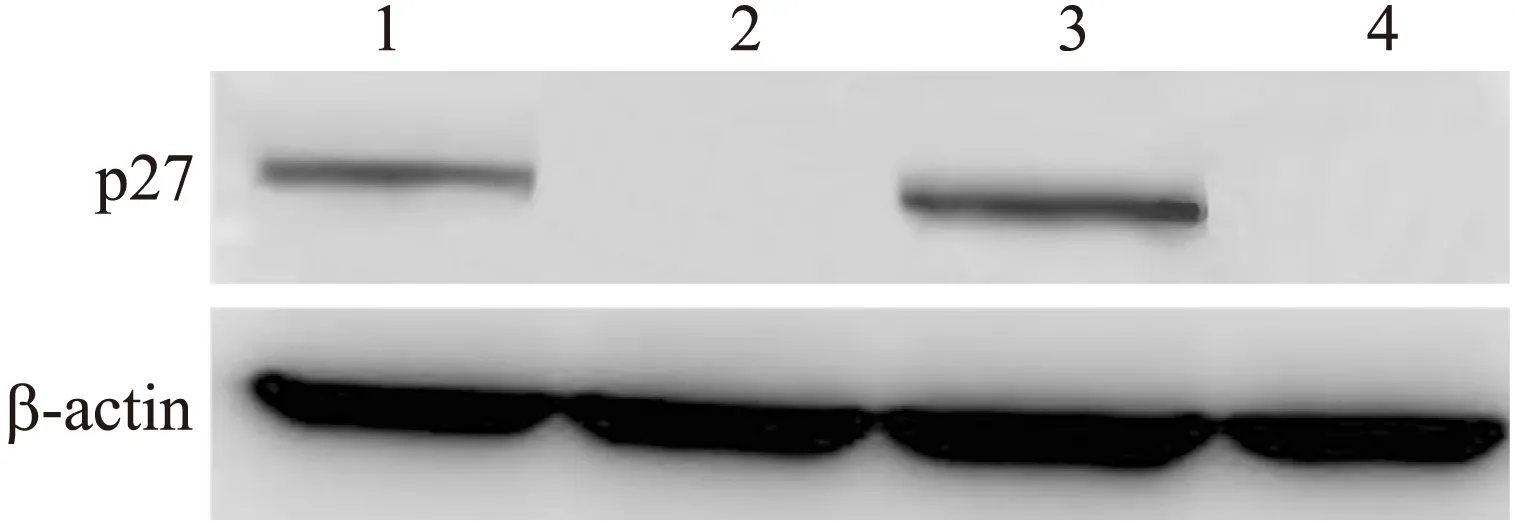
图5 绿原酸对CNE-1中p27表达的作用
Fig.5 Effects of CHA on the expression of p27 in CNE-1
泳道1:100 μmol/L CHA处理CNE-1;泳道2:0 μmol/L CHA处理CNE-1;泳道3:雷公藤处理CNE-1;泳道4:HT1080。
对于p27的Western blot的结果进行灰度扫描,再与β-actin的条带灰度进行对比,结果发现,p27在CNE-1(100 μmol/L的CHA处理组)中的表达量明显高于CNE-1(0 μmol/L的CHA处理组)和阳性对照组(P<0.01),但与雷公藤组相比没有统计学意义(P>0.05,表1)。
表1 p27表达的相对灰度值

Tab.1 Relative gray scale value of p27 expression (±s,n=4)
与阳性对照组相比,**P<0.01;与0 μmol/LCHA组相比,##P<0.01。
抑癌基因p16的表达水平和趋势与p27基因相似,在100 μmol/L的CHA处理后的人鼻咽癌细胞株CNE-1中有较明显的表达,而在正常培养的CNE-1细胞中和阳性对照组(人纤维肉瘤细胞株HT1080),p16蛋白只有少量的表达,个别样品几乎检测不到(图6),偶尔能看到淡淡的条带,在实验对照组中,应用雷公藤作用10 d的CNE-1细胞中,也能看到p16蛋白的表达(图6)。
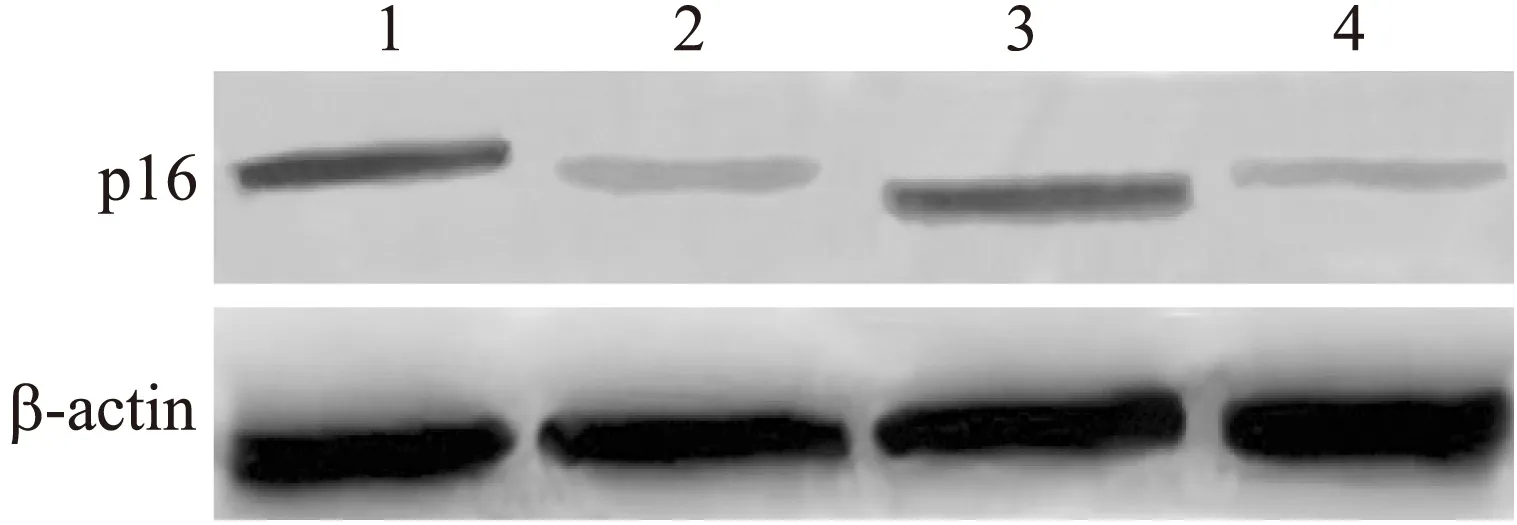
图6 绿原酸对CNE-1中p16表达的作用
Fig.6 Effects of CHA on the expression of p16 in CNE-1
泳道1:100 μmol/L CHA处理CNE-1;泳道2:0 μmol/L CHA处理CNE-1;泳道3:雷公藤处理CNE-1;泳道4:HT1080。
对于p16的Western blot的结果进行灰度扫描,再与β-actin的条带灰度进行对比,结果发现,p16在CNE-1(100 μmol/L的CHA处理组)中的表达量明显高于CNE-1(0 μmol/L的CHA处理组)和阳性对照组(P<0.01),略高于雷公藤处理组,但二者间没有统计学意义(表2)。
表2 p16表达的相对灰度值

Tab.2 Relative gray scale value of p16 expression (±s,n=4)
与阳性对照组相比,**P<0.01;与0 μmol/L的CHA组比,##P<0.01。
应用100 μmol/L的CHA处理后的人鼻咽癌细胞株CNE-1,Cyclin D1和CDK4的表达与对照组的CNE-1细胞相比,明显呈现出下调的趋势(图7、图8)。说明100 μmol/L的CHA对于鼻咽癌细胞株CNE-1具有抑制作用,其机制是通过延缓CNE-1细胞株通过G1期进入S期从而达到对CNE-1的生长抑制作用。
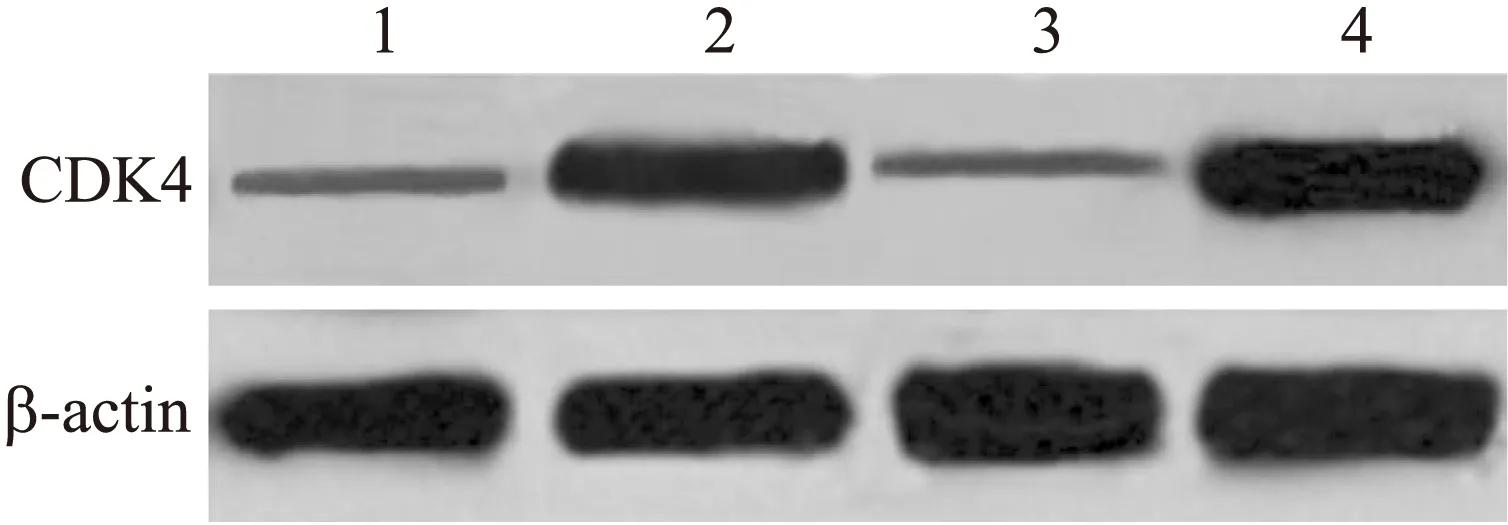
图7 绿原酸对CNE-1 中CDK4表达的抑制作用
Fig.7 CHA’s inhibition on the expression of CDK4 in CNE-1
泳道1:100 μmol/L CHA处理CNE-1;泳道2:0 μmol/L CHA处理CNE-1;泳道3:雷公藤处理CNE-1;泳道4:HT1080。
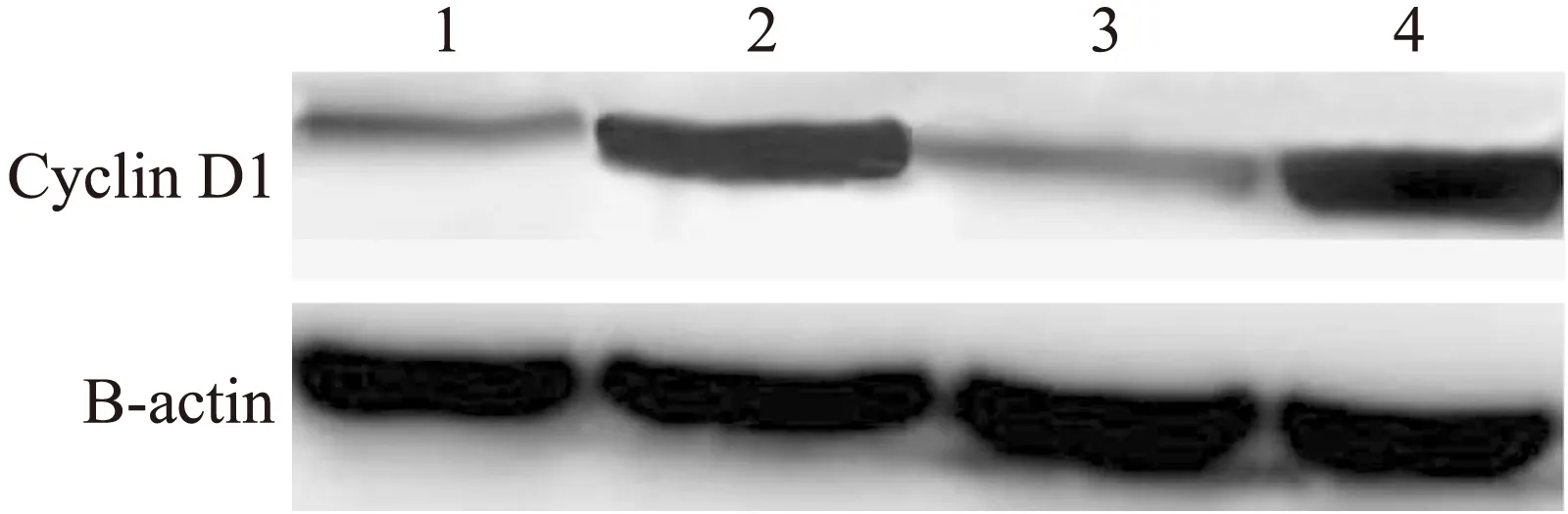
图8 绿原酸对CNE-1中Cyclin D1表达的抑制作用
Fig.8 CHA’s inhibition on the expression of Cyclin D1 in CNE-1
泳道1:100 μmol/L CHA处理CNE-1;泳道2:0 μmol/L CHA处理CNE-1;泳道3:雷公藤处理CNE-1;泳道4:HT1080。
对于cyclin D1和CDK4的Western blot的结果进行灰度扫描,再与β-actin的条带灰度进行对比,结果发现,cyclin D1和CDK4在CNE-1(100 μmol/L的CHA处理组)中的表达量明显低于CNE-1(0 μmol/L的CHA处理组)和阳性对照组(P<0.01),但与雷公藤处理组相比差异没有统计学意义(表3)。
表3 cyclin D1和CDK4表达的相对灰度值的比较

Tab.3 Relative gray value scale of cyclin D1 and CDK4 expressions (±s,n=4)
与阳性对照组相比,**P<0.01;与0 μmol/L的CHA组比,##P<0.01。
3 讨 论
中药金银花的特征活性成分为CHA,具有抗氧化、抗菌、抗病毒、升高白细胞、免疫调节、抗肿瘤、降血压、降血脂等作用[11-12]。文献报道CHA对肉瘤180及艾氏腹水癌有明显的细胞毒作用。本研究采用CCK-8吸收法观察了CHA对鼻咽癌细胞株CNE-1的抑制率,从而进行初步筛选CHA的最适抑制浓度。从本实验结果发现,随着CHA浓度的增加(从25 μmol/L到100 μmol/L),CHA对CNE-1的抑制作用明显增强,CHA浓度达到100 μmol/L时为最大值,若超过该值,抑制作用增加不明显,甚至出现对鼻咽癌细胞株CNE-1的抑制作用降低的现象。说明一定浓度的CHA对于鼻咽癌细胞株CNE-1生长具有明显的抑制作用。之后进一步对CHA的浓度进行筛选,通过绘制CNE-1细胞株的增殖率(相对生长曲线)对CHA的浓度进行精细筛选,最后确定其最佳的药物浓度为100 μmol/L。从生长曲线上,从第1天到第6天,几个不同浓度的CHA对于鼻咽癌细胞株CNE-1均具有抑制作用,其中终浓度达到100 μmol/L的CHA作用后的CNE-1细胞株,细胞增殖率最低。由此可以确定100 μmol/L是CHA发挥其抑制CNE-1细胞株的最适浓度,此后的实验均采用这一浓度。
以往的研究发现,抑癌基因的表达下调,是多数恶性肿瘤发生、发展的基础。在肝癌、前列腺癌、子宫癌等组织中,抑癌基因p27[13]、p53[14]、p16[15]等表达明显降低。鼻咽癌细胞株CNE-1中抑癌基因p27和p16的表达呈现出下调的趋势,抑癌基因的表达受到强烈的抑制,导致癌基因的作用增强,引起正常细胞的恶性变。在本实验中,人鼻咽癌细胞株CNE-1细胞系应用CHA(100 μmol/L)作用10 d后,p27基因和p16基因的表达量均明显升高,说明CHA发挥其抑制CNE-1细胞株生长增殖的作用与增加抑癌基因的表达相关。也有研究表明,Cyclin D1、CDK4表达上调的程度与某些肿瘤的恶性程度呈正相关[16]。本实验中检测了人鼻咽癌细胞株CNE-1细胞周期蛋白和细胞周期素依赖激酶的表达,结果发现细胞周期蛋白Cyclin D1呈高表达,而CDK4也呈高表达的趋势,说明细胞更加易于通过细胞周期的关卡,细胞增殖周期缩短,呈现出细胞癌性变的特性。在应用CHA(100 μmol/L)作用10d后,无论是cyclin D1还是CDK4均有明显的下降,说明一定浓度的CHA(100 μmol/L)能显著的降低细胞周期蛋白的表达,抑制CNE-1细胞快速的通过细胞关卡,达到抑制CNE-1增殖的作用。
[1] LI B, HUANG G, ZHANG X, et al. Increased phosphorylation of histone H3 at serine 10 is involved in Epstein-Barr virus latent membrane protein-1-induced carcinogenesis of nasopharyngeal carcinoma[J]. BMC Cancer,2013, 13(1):124.
[2] JI X, XIE C, HU D, et al. Survival benefit of adding chemotherapy to intensity modulated radiation in patients with locoregionally advanced nasopharyngeal carcinoma[J]. PLoS One, 2013, 8(2):e56208.
[3] FERRARI D, CODECA C, BERTUZZI C, et al. Role of plasma EBV DNA levels in predicting recurrence of nasopharyngeal carcinoma in a Western population[J]. BMC Cancer, 2012, 12:208.
[4] HSU M, WU SY, CHANG SS. Epstein-Barr virus lytic transactivator Zta enhances chemotactic activity through induction of interleukin-8 in nasopharyngeal carcinoma cells[J]. J Virol, 2008, 82(7):3679-3688.
[5] NOZOE T, OYAMA T, TAKENOYAMA M, et al. Significance of immunohistochemical expression of p27 and involucrin as the marker of cellular differentiation of squamous cell carcinoma of the esophagus[J]. Oncology, 2006,71(5-6):402-410.
[6] CHEN J, HUANG ZJ, DUAN YQ, et al. Aberrant DNA methylation of p16, MGMT, and hMLH1 genes in combination with MTHFR C677T genetic polymorphism and folate intake in esophageal squamous cell carcinoma[J]. Asian Pac J Cancer Prev, 2012, 13(10):5303-5306.
[7] VUOCOLO S, SOPRANO DR, SOPRANO KJ. p27/Kip1 mediates retinoic acid-induced suppression of ovarian carcinoma cell growth[J]. J Cell Physiol, 2004,199(2):237-243.
[8] PARK WH, JUNG CW, PARK J, et al. Trichostatin inhibits the growth of ACHN renal cell carcinoma cells via cell cycle arrest in association with p27, or apoptosis[J]. Int J Oncol,2003, 22(5):1129-1134.
[9] BANDYOPADHYAY G, BISWAS T, ROY KC, et al. Chlorogenic acid inhibits Bcr-Abl tyrosine kinase and triggers p38 mitogen-activated protein kinase-dependent apoptosis in chronic myelogenous leukemic cells[J]. Blood, 2004, 104(8):2514-2522.
[10] WU L. Effect of chlorogenic acid on antioxidant activity of Flos Lonicerae extracts[J]. J Zhejiang Univ Sci B, 2007,8(9):673-679.
[11] YUAN Y, SONG L, LI M, et al. Genetic variation and metabolic pathway intricacy govern the active compound content and quality of the Chinese medicinal plant Lonicera japonica thunb[J]. BMC Genomics,2012,13:195.
[12] WANG CZ, LI P, DING JY, et al. Discrimination of Lonicera japonica THUNB. from different geographical origins using restriction fragment length polymorphism analysis[J]. Biol Pharm Bull, 2007, 30(4):779-782.
[13] YU LQ, GAO GL, LIU FJ, et al. Dys-psychological Stress Effect on Expressions of P53 and NFκBp65 in Human Ovarian Carcinoma In Vivo[J]. Chin J Cancer Res, 2012, 24(3):245-248.
[14] VÉGRAN F, REBUCCI M, CHEVRIER S, et al. Only missense mutations affecting the DNA binding domain of p53 influence outcomes in patients with breast carcinoma[J]. PLoS One, 2013, 8(1):e55103.
[15] SILVA SD, NONOGAKI S, SOARES FA, et al. p16 (INK4a) has clinicopathological and prognostic impact on oropharynx and larynx squamous cell carcinoma[J]. Braz J Med Biol Res,2012,45(12):1327-1333.
[16] BAR-SELA G, HERSHKOVITZ D, HAIM N, et al. The incidence and prognostic value of HER2 overexpression and cyclin D1 expression in patients with gastric or gastroesophageal junction adenocarcinoma in Israel[J]. Oncol Lett, 2013, 5(2):559-563.
(编辑 韩维栋)
Effects of chlorogenic acid on cultured human nasopharyngealcarcinoma cell line CNE-1invitro
YAOSu-yan1,LIQuan-sheng2,ZHENGDe-yu3
(1.DepartmentofPathophysiology,Jinzhou121001; 2.DepartmentofOtorhinolaryngology,PanjinCentralHospital,Panjin124000;3.DepartmentofAnatomy,LiaoningMedicalCollege,Jinzhou121001,China)
Objective To explore the effects and mechanisms of chlorogenic acid (CHA) on the human nasopharyngeal carcinoma cell line CNE-1 culturedinvitro. Methods The human nasopharyngeal carcinoma cell line CNE-1 underwent resuscitation in sterile conditions. CHA was added into the CNE-1 culture media at the concentrations of 0, 25, 50, 100, 200 and 500 μmol/L for 7 days. The optimal concentration of CHA which inhibited the CNE-1 was determined by CCK8 inhibition experimentinvitro. After CNE-1 was cultured at the optimal concentration of CHA for 10 days, telomerase activation was detected by ELISA method. The expressions of anti-oncogene p27 and p16 as well as cyclin D1 and CDK4 were determined by Western blot. Results The optimal concentration of CHA for inhibiting CNE-1 cell line was 100 μmol/L determined by CCK8 inhibition experiment. Telomerase activation of CNE-1 was decreased to 1.621 after CNE-1 was treated with 100 μmol/L CHA for 10 days. The activation was significantly lower than that in the positive group and the normal cultured CNE-1 group (P<0.01). Anti-oncogene p27 and p16 were expressed in a low quantity after CNE-1 was treated with 100 μmol/L CHA for 10 days. But there was hardly any p27 or p16 expression in the positive group (HT1080) and the normal cultured CNE-1 group (CHA concentration being 0 μmol/L) determined by Western blot method. The expressions of cyclin D1 and cyclin dependence kinase 4 (CDK4) were lower after CNE-1
100 μmol/L CHA for 10 days than those in the HT1080 cell line and the normal cultured CNE-1 (CHA concentration being 0 μmol/L). Conclusion CHA has the functions of decreasing telomerase activation of CNE-1 cell line, increasing the anti-oncogene expression and decreasing cyclin D1 expression. The inhibitory function of CHA on CNE-1 cell line is realized by activating the expression of anti-oncogene and inhibiting the expression of cyclin D1.
chlorogenic acid; nasopharyngeal carcinoma; anti-oncogene; cyclin D; telomerase; p27; p16
2014-01-25
2014-05-10
辽宁省自然科学基金资助项目(No.2013022066,2013022048) Supported by the Natural Science Foundation of Liaoning Province (No.2013022066 and 2013022048)
郑德宇,博士,硕士研究生导师,主要从事神经退行性疾病的实验治疗方面的研究. E-mail: Zdy4673349@163.com
姚素艳(1971-),硕士,主要从事阿尔茨海默病的实验治疗和中药金银花提取物绿原酸的药理作用的研究. E-mail: ysyzdy@163.com
时间:2014-06-04 15∶01 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140922.0828.002.html
R766.3
A
10.7652/jdyxb201406022

