瘢痕疙瘩间充质干细胞的分离与培养及其生长曲线的研究
宋海峰,刘 涛,张衍国
(第四军医大学唐都医院皮肤科,陕西西安 710038)
◇技术方法研究◇
瘢痕疙瘩间充质干细胞的分离与培养及其生长曲线的研究
宋海峰,刘 涛,张衍国
(第四军医大学唐都医院皮肤科,陕西西安 710038)
目的 探索获得瘢痕疙瘩来源的高纯度间充质干细胞(MSCs)的培养方法。方法 来源于第四军医大学唐都医院皮肤科住院的4例患者的瘢痕疙瘩标本,所取病变部位均位于前胸及后背皮肤,采用DMEM∶F12/(100 mL/L)胎牛血清(FBS)初步培养,再改用低糖DMEM/(100 mL/L)FBS培养,接着用低糖DMEM/(10 mL/L)FBS培养,最后用无血清的干细胞培养基(SCM)培养,并通过观察细胞形态特征及应用流式细胞术检测细胞表面标记物的表达情况进行鉴定。结果 经血清梯度培养后得到了长梭形、形态均一,纯度较高的纤维样细胞,经流式细胞仪检测后细胞表面标记物表达情况为:CD29为99.99%,CD44为99.7%,CD45为0.69%,CD73为99.96%。结论 血清浓度逐渐降低的梯度培养法可获得高纯度的瘢痕疙瘩MSCs。
瘢痕疙瘩;间充质干细胞;CD29;CD44;CD45;CD73;细胞生长曲线
瘢痕分为生理性瘢痕和病理性瘢痕,而病理性瘢痕又分为增生性瘢痕和瘢痕疙瘩。瘢痕疙瘩主要由局部创伤和表皮异位等造成真皮损失和胶原的异常聚集所致,在临床上表现为呈“蟹足样”浸润性生长[1]。一般不自行萎缩,切除后易于复发,但一般不会发生转移和恶变[2]。目前瘢痕疙瘩的发病机制不清,也无理想的治疗方法[3]。而间充质干细胞(mesenchymal stem cells, MSCs)是来源于早期中胚层的一类多能干细胞,目前已经从骨髓、骨膜、皮肤等组织处分离得到MSCs[4]。有报道表明,瘢痕疙瘩中MSCs的数量要比正常皮肤中的多[5],但是其作用机制尚不明确。因此,对MSCs的研究成为瘢痕疙瘩发病机制研究的一个重要方面。目前对于瘢痕疙瘩MSCs的分离培养一般借鉴正常皮肤MSCs的培养方法,但一般培养周期长,和成纤维细胞呈混杂生长,难以分离出纯度高的干细胞。因此,探讨瘢痕疙瘩MSCs的培养方法对瘢痕疙瘩发病机制的研究具有重要的意义。
1 材料与方法
1.1 标本来源 瘢痕疙瘩标本来源于第四军医大学唐都医院皮肤科住院的4例患者,患者均为初次就诊,此前未接受过其他治疗,无全身其他器质性疾病,病变部位均位于前胸及后背。经患者知情同意后,以手术及电子线照射治疗瘢痕疙瘩病变,同时经病理诊断确诊为瘢痕疙瘩,留取标本备用。
1.2 主要试剂及仪器 2.5 g/L胰蛋白酶(Hyclon),胎牛血清(FBS,Gibco),干细胞培养基(Cell Therapy Systems STEMPRO MSC SFM CTSTM, Gibco),Ⅱ型中性蛋白酶(Dispase Ⅱ, Roche),CD29-PerCP、CD44-FITC、CD45-PE、CD73-APC(eBioScience),CO2恒温培养箱( 美国Thermo公司),高速低温离心机(德国Eppendorf公司),FACS Calibur流式细胞仪(美国Becton Dickinson公司)。
1.3 MSCs原代分离 用生理盐水将瘢痕疙瘩标本带回实验室,并用生理盐水涮洗3次,采用RIEKSTINA等[6]报道的正常皮肤MSCs的分离方法,将瘢痕疙瘩组织块剪成条索状,用25 g/L Ⅱ型中性蛋白酶37 ℃孵育2 h,在无菌条件下用镊子轻轻撕去表皮,留下真皮。再将样本剪成1 mm3大小的组织块,D-Hanks缓冲液洗3次,2.5 g/L胰蛋白酶37 ℃消化15 min,加入含有100 mL/L FBS的DMEM培养基终止消化,用吸管反复吹打乳糜状组织块使细胞分离,通过孔径40 μm的细胞滤网过滤,滤液离心弃上清,加入含100 mL/L FBS和1%双抗(青霉素和链霉素)的DMEM∶F12(1∶1)培养基重悬细胞沉淀,转移到细胞培养瓶进行培养。
1.4 MSCs的培养及显微镜下的形态观察 采用CARLSON等[7]关于小鼠心肌MSCs的培养方法,用含100 mL/L FBS和1%双抗的DMEM∶F12(1∶1)培养基于25 cm2的细胞培养瓶培养细胞,37 ℃、50 mL/L CO2条件下孵箱,10 d后改为含100 mL/L FBS的低糖DMEM的培养基进行培养,使MSC富集;再改用含10 mL/L FBS的低糖DMEM的培养基培养,在倒置显微镜下观察细胞生长情况,直到长梭形的细胞成为优势细胞;最后用含1 g/L的poly-D-赖氨酸的无血清干细胞培养基(SCM)培养细胞[含低糖DMEM∶Ham’s F12(1∶1)、B27、抗生素、20 ng/mL EGF、10 ng/mL FGF-2、10 ng/mL LIF],直到细胞完全融合后胰酶消化传代。
1.5 MSCs表面标志的鉴定 取第3代贴壁细胞,胰蛋白酶37 ℃消化2 min,用含100 mL/L FBS的DMEM培养基终止消化,离心、弃上清液,加入PBS制成单细胞悬液,调整细胞密度为1×106个/mL,PBS洗涤、离心后加入95 μL的PBS重新悬浮细胞,分别滴加5 μL的CD29-PerCP、CD44-FITC、CD45-PE和CD73-APC 4种荧光抗体,冰上避光孵育30 min,以1 000 r/min离心5 min,弃去含荧光抗体的PBS,再用PBS洗涤2次,除去未结合的荧光抗体。向细胞中加入500 μL预冷的PBS,吹打混匀,转移至流式管中,同时以未被抗体处理的MSCs作为阴性对照,上流式细胞仪进行检测。
1.6 观察MSCs生长并绘制生长曲线 取第3代细胞,调整细胞密度为1×104个/mL,接种于24孔细胞培养板中培养。分别于培养后第1、2、3、4、5、6、7、8 d采用锥虫蓝染色,计数活细胞并绘制生长曲线。
2 结 果
2.1 形态学特性 原代分离培养的细胞初期大部分为小圆形细胞,培养24 h后大部分细胞死亡,只有少量细胞存活,且生长繁殖速度缓慢。细胞在经过1~2周的潜伏期后,细胞数迅速增多,形态呈梭形,放射状生长,倒置显微镜下可见多个细胞克隆,继续培养后细胞逐渐融合在一起,早期贴壁的细胞形态差异较大,有椭圆形、多角形和梭形等(图1A)。随着培养时间的延长,细胞形态逐渐变得均一,以长梭形为主。原代培养8~10 d后,改用低糖DMEM/(100 mL/L)得FBS培养基培养,经3~4 d培养后,细胞逐渐变的细长,分裂速度明显加快(图1B)。再改用低糖DMEM/(10 mL/L)FBS培养后,细胞形态变得更加均一,增殖速度更快,2~3 d就可以增殖2倍以上(图1C)。后改用无血清干细胞培养基培养,细胞趋于稳定,为研究MSCs的各种生物学特性的最佳时期(图1D)。
2.2 细胞生物学标记物的检测 MSCs高表达CD29、CD44、CD73,低表达或不表达CD45,第3代细胞表面标记物表达的比例:CD29为99.99%,CD44为99.7%,CD45为0.69%,CD73为99.96%(图2)。

图1 血清浓度逐步降低培养后的细胞形态
Fig.1 Cell morphology under cultured conditions of gradually decreased serum concentration (×100)
A:DMEM∶F12/(100 mL/L)FBS原代分离的细胞形态(8 d);B:低糖DMEM/(100 mL/L)FBS刺激后的细胞形态(14 d);C:低糖DMEM/(10 mL/L)FBS刺激后的细胞形态(17 d);D:无血清干细胞培养基中的细胞形态(19 d)。
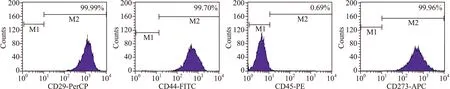
图2 流式细胞术检测瘢痕疙瘩MSCs表面标志物的结果
Fig.2 Results of keloid-derived MSCs surface markers detected by flow cytometry method
2.3 细胞生长曲线的绘制及特点 第3代细胞生长曲线结果显示,最初的2 d细胞生长缓慢,但从第3天开始细胞数量明显增加,呈现对数生长,第7~8天以后细胞增殖变缓,形成一个平台期(图3)。

图3 瘢痕疙瘩MSCs的生长曲线
Fig.3 Growth curve of keloid-derived MSCs
3 讨 论
近年来国内外学者对瘢痕疙瘩的发病机制进行了深入研究,但其发病的实质仍未阐明,对MSCs的研究已成为瘢痕疙瘩发病机制研究的一个重要方向。IQBAL等[8]对瘢痕疙瘩皮损内和皮损外造血干细胞(haematopoietic stem cells, HSCs)和MSCs分布的研究发现,CD13+、CD29+、CD44+ 和CD90+的MSCs主要分布于皮损内,而CD34+、CD90+和CD117+的HSCs主要分布于皮损外。同时发现,在皮损内外还含有独特的CD34+细胞,这提示瘢痕疙瘩为非造血干细胞提供了适宜的生长环境。AKINO等[9]研究发现,瘢痕疙瘩来源的成纤维细胞能够诱导人MSCs向肌成纤维母细胞方向分化,这是终末分化成熟的成纤维细胞所不具备的属性,而具有分化潜能的MSCs可能在瘢痕疙瘩的发生发展中发挥重要作用。
迄今为止,体外分离培养MSCs还没有统一的方案,目前瘢痕疙瘩MSCs的分离主要借鉴正常皮肤MSCs的分离方法[6,10]。国内外一些学者也从瘢痕疙瘩中分离出了MSCs[11],但是分离的干细胞纯度不高,混有成纤维细胞等杂质细胞,给进一步研究的结果判断带来一定的干扰,因此分离高纯度的MSCs成为瘢痕疙瘩研究应首要解决的问题。
瘢痕疙瘩组织由于含有大量的胶原纤维,其质地比正常皮肤坚硬,在分离细胞时,首先将瘢痕疙瘩剪成小组织块的过程比正常皮肤要困难,需要细心和技巧,同时用胰酶消化的时间要进行摸索,消化时间过短,细胞分离不出来,消化时间过长,细胞损伤严重,无法贴壁。本实验经过探索选用2.5 g/L的胰蛋白酶37 ℃消化15 min后加含血清的培养液终止消化,可以达到较理想的效果。在细胞的后续培养中借鉴CARLSON[7]等关于小鼠心肌MSCs的培养方法,先用DMEM∶F12/(100 mL/L)FBS初步培养,再改用低糖DMEM/(100 mL/L)FBS培养,接着用低糖DMEM/(10 mL/L)FBS培养,最后用无血清的干细胞培养基培养。这种逐步降低血清浓度,形成血清的浓度梯度,在最初的培养中高浓度的血清有助于细胞贴壁和快速增殖,而随着血清浓度的降低,直至无血清培养,不但干细胞的分化受到抑制,而且可能由于缺乏某些营养成分,杂细胞的生长也得到抑制,从而得到高纯度的MSCs。此外,无血清干细胞培养基的细胞因子B27和FGF-2为MSCs生长所必须,而EGF和LIF则为非必须因子[6]。因此,无血清干细胞基础培养基中需加入含B27和FGF-2等因子的添加剂。瘢痕疙瘩MSCs在培养过程中特别容易污染,因此预防细胞污染对干细胞能否培养成功尤为重要。在实验过程中给干细胞培养基添加青霉素和链霉素,同时及时换液和传代,注意操作过程中的细节,比如在培养细胞时将手进行彻底消毒,禁止说话等可防止细胞污染。
对于MSCs的鉴定目前也没有统一的方法,迄今为止也没有筛选到用于鉴定MSCs的特异标记分子,也没有统一的命名[12-13],但不同来源的MSCs却有一些共同的标准,如CD13、CD29、CD44、CD73、CD105和CD166阳性,CD11a、CD14、CD34和CD45阴性[14-16]。本实验也采用多个表面标志组合进行鉴定,应用流式细胞术鉴定的结果表明瘢痕疙瘩来源的第3代纤维样细胞均高表达CD29、CD44和CD73等MSCs表面标记物,低表达CD45等造血干细胞表面标记物。MSCs具有向成脂肪细胞、成骨细胞和成软骨细胞等多向分化的能力,诱导分化实验虽然能够研究MSCs的多向分化潜能,但是不能提示细胞的纯度。因此,我们直接用流式细胞术检测细胞纯度。同时细胞生长曲线分析表明,MSCs在最初2 d为生长缓慢的潜伏期,随后细胞生长速度加快进入对数生长期,随着细胞密度的增大,第7~8天形成一个平台期。这说明本实验分离培养的MSCs增殖及活力良好,可用于下一步的实验研究。
本实验通过总结各种已报道的干细胞的分离培养方法,吸取各自优点并加以改进,分离培养出了纯度很高的瘢痕疙瘩MSCs,细胞形态为较均一的长梭形,与成纤维细胞类似,呈不规则放射状生长。这为下一步关于瘢痕疙瘩发病机制的研究打下了良好的基础。
[1] VINCENT AS, PHAN TT, MUKHOPADHYAY A, et al. Human skin keloid fibroblasts display bioenergetics of cancer cells[J]. J Invest Dermatol, 2008, 128(3):702-709.
[2] ATIYEH BS, COSTAGLIOLA M, HAYEK SN. Keloid or hypertrophic scar: the controversy: review of the literature[J]. Ann Plast Surg, 2005, 54(6):676-680.
[3] BUTLER PD, LONGAKER MT, YANG GP. Current progress in keloid research and treatment[J]. J Am Coll Surg, 2008, 206(4):731-741.
[4] 杨立业,刘相名,惠国桢,等. 皮肤间充质干细胞的体外培养和分化[J]. 生物医学工程学杂志,2005,22(3):514-517.
[5] ZHANG Q, YAMAZA T, KELLY AP, et al. Tumor-like stem cells derived from human keloid are governed by the inflammatory niche driven by IL-17/IL-6 axis[J]. PLoS One, 2009, 4(11): e7798.
[6] RIEKSTINA U, MUCENIECE R, CAKSTINA I, et al.Characterization of human skin-derived mesenchymal stem cell proliferation rate in different growth conditions[J]. Cytotechnology, 2008, 58(3):153-162.
[7] CARLSON S, TRIAL J, SOELLER C, et al. Cardiac mesenchymal stem cells contribute to scar formation after myocardial infarction[J]. Cardiovasc Res, 2011, 91:99-107.
[8] IQBAL SA, SYED F, MCGROUTHER DA, et al. Differential distribution of haematopoietic and nonhaematopoietic progenitor cells in intralesional and extralesional keloid: do keloid scars provide a niche for nonhaematopoietic mesenchymal stem cells[J]. Br J Dermatol, 2010, 162(6):1377-1383.
[9] AKINO K, AKITA S, YAKABE A, et al. Human mesenchymal stem cells may be involved in keloid pathogenesis[J]. Int J Dermatol, 2008 , 47(11):1112-1117.
[10] 潘智慧,王丽,刘瑞风,等. 皮肤间充质干细胞的原代培养[J]. 中国皮肤性病学杂志,2012,26(2):114-117.
[11] 王达利,朱晶晶,邓呈亮,等. 人瘢痕疙瘩来源干细胞的生物学特性鉴定[J]. 中华烧伤杂志,2011, 27(3):210-214.
[12] 赵林,申延清,荣春,等. 间充质干细胞培养与分化诱导的特点及机制[J]. 中国组织工程研究与临床康复,2010,14(40):7551-7554.
[13] 周颖,高孟飞,牛慧勇. 间充质干细胞干性维持信号通路的研究进展[J]. 吉林大学学报:医学版, 2013, 39(3):638-642.
[14] 银广悦,丁俊丽,张继领. 间充质干细胞向心肌细胞分化的实验进展[J]. 标记免疫分析与临床,2013,20(3):197-200.
[15] 岳冬丽,韩交玲,关方霞,等. 肿瘤干细胞的研究进展及临床意义[J]. 郑州大学学报:医学版, 2013, 48(1):1-8.
[16] KOLF CM, CHO E, TUAN RS. Mesenchymal stromal cells. Biology of adult mesenchymal stem cells: regulation of niche, self-renewal and differentiation[J]. Arthritis Res Ther, 2007, 9(1):204.
(编辑 国 荣)
Isolation and culture of human keloid-derived mesenchymalstem cells and their growth curve
SONG Hai-feng, LIU Tao, ZHANG Yan-guo
(Department of Dermatology, Tangdu Hospital of Fourth MilitaryMedical University, Xi’an 710038, China)
Objective To investigate the method to culture high-purity keloid-derived mesenchymal stem cells (MSCs). Methods The keloid tissue samples were collected from the skin of 4 patients hospitalized in our department. The lesioned areas were the chest and the back. The human keloid cells were cultured with the serial culture medium in the following order: DMEM∶F12/(100 mL/L)fetal bovine serum (FBS), then low-glucose DMEM/(100 mL/L)FBS, low glucose DMEM/(10 mL/L)FBS, and last serum-free stem cell medium. Then we observed cell morphology and identified cell surface markers by flow cytometry method. Results We obtained high-purity fiber-like cells of long spindle and uniform shape by the serum gradient culture method. The expression of cell surface markers detected by flow cytometry was 99.99% for CD29, 99.7% for CD44, 0.69% for CD45, and 99.96% for CD73. Conclusion High-purity keloid-derived mesenchymal stem cells can be obtained by the culture method of decreasing serum concentration gradient.
keloid; mesenchymal stem cell; CD29; CD44; CD45; CD73; cell growth curve
2013-12-26
2014-03-13
国家自然科学基金资助项目(No.30900772) Supported by the National Natural Science Foundation of China (No.30900772)
张衍国,副教授. E-mail: tdxbyzw@fmmu.edu.cn
宋海峰(1981-),男(汉族),技师,硕士. 主要研究方向:瘢痕疙瘩发病机制. E-mail: songhaifeng168@126.com
时间:2014-06-27 09∶46 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140916.1121.001.html
R751; Q813
A
10.7652/jdyxb201406026

