含hITF基因cDNA的腺病毒载体的构建及其感染肠上皮细胞的研究
孙 勇,陈宝君,勒 娟,潘晓峰,张 方
(1. 徐州医学院附属淮海医院烧伤科,江苏徐州 221004;2. 中国人民解放军第九七医院烧伤科,江苏徐州 221004)
◇基础研究◇
含hITF基因cDNA的腺病毒载体的构建及其感染肠上皮细胞的研究
孙 勇,陈宝君,勒 娟,潘晓峰,张 方
(1. 徐州医学院附属淮海医院烧伤科,江苏徐州 221004;2. 中国人民解放军第九七医院烧伤科,江苏徐州 221004)
目的 构建含有人肠三叶因子基因cDNA的腺病毒载体,并观察其对肠上皮细胞的感染能力。方法 利用PCR技术扩增hITF基因cDNA全长序列,测序后亚克隆至腺病毒穿梭质粒,转化至含腺病毒骨架质粒pAdEasy-1大肠杆菌株BJ5183感受态细胞中进行同源重组,内切酶PmeⅠ线性化后转染HEK293细胞进行病毒包装及扩增,并进行滴度测定。将重组腺病毒感染肠上皮细胞(HT-29),荧光显微镜观察感染效果。结果 成功构建出重组穿梭质粒pAdTrack-CMV-hITF,PmeⅠ线性化后与骨架质粒pAdEasy-1同源重组,PacⅠ酶切鉴定后命名为Ad-hITF;重组腺病毒载体在HEK293细胞中包装,获得重组腺病毒颗粒;根据Karbers公式计算病毒颗粒滴度为2×109pfu/mL;重组腺病毒可以感染肠上皮细胞(HT-29),感染效率较高。结论 成功构建含hITF基因cDNA的重组腺病毒载体并获得大量子代重组腺病毒,为腺病毒介导hITF基因治疗的应用打下基础。
肠三叶因子;腺病毒;肠上皮细胞;基因治疗
人肠三叶因子(human intestinal trefoil factor, hITF)是近年来发现的一种具有胃肠道保护和修复作用的小分子蛋白,它由59个氨基酸残基构成,分子质量约6.7×103,属于三叶肽家族[1-2]。hITF包含一个由38~39个氨基酸残基组成的特殊保守序列,其中的6个半胱氨酸按1~5、2~4、3~6的顺序依次形成3个二硫键,从而产生特异而稳定的三叶草型结构[3]。作为一个具有广泛应用前景的药物前体,却因为复杂的制备过程、较低的产量限制了它的应用。基因治疗是近年来出现的崭新的治疗手段,是将人正常基因或有治疗作用的基因通过一定方式导入人体靶细胞以纠正基因的缺陷或者发挥治疗作用,从而达到治疗疾病目的的生物医学高技术[4-5]。腺病毒是目前应用最为广泛的基因传递载体之一[6-7]。本研究采用第3代腺病毒传递hITF基因,并感染肠上皮细胞(HT-29),为腺病毒介导hITF基因治疗的应用打下基础。
1 材料与方法
1.1 质粒、菌株、酶和主要试剂 质粒pEGFP-N1、腺病毒穿梭质粒pAdTrack-CMV、骨架质粒pAdEasy-1(存在于大肠杆菌BJ5183中)、大肠杆菌E.coliDH5α和人胚胎肾细胞(HEK293细胞)由本实验室保存。T4DNA连接酶、限制性内切酶XhoⅠ、EcoRⅠ、BglⅡ、NotⅠ、KOD-Plus酶均购自TaKaRa公司;限制性内切酶PmeⅠ、PacⅠ购自美国Biolab公司;脂质体2000购自美国Invitrogen公司;其他试剂为进口或国产分析纯。
1.2 hITF真核表达载体的构建 hITF的信号肽+成熟肽cDNA编码区的大小为219 bp,编码73个氨基酸。根据在GenBank检索得到的hITF mRNA序列(NM003226),使用Primer 5.0软件设计以下引物:引物1:5′-GAGACTCGAGATGCTGGGGCTGGTCCTGG-3′,引物2:5′-TTTAGAATTCGGAAGGTGCAT-TCTGCTTC-3′。上游和下游引物分别引入XhoⅠ、EcoRⅠ酶切位点(下划线),为了阅读框正确,引物2添加碱基G(加粗)。PCR产物经XhoⅠ、EcoRⅠ双酶切后与同样双酶切的pEGFP-N1相连。
1.3 穿梭质粒的构建 质粒pEGFP-N1-hITF与腺病毒穿梭质粒pAdTrack-CMV上具有相同的内切酶位点BglⅡ、NotⅠ,经相同的两种内切酶酶切后,两种质粒分别产生互补的粘性末端,在T4DNA连接酶的作用下,目的基因hITF与腺病毒穿梭质粒pAdTrack-CMV相连。转化DH5α感受态细胞,挑取卡那抗性菌落抽提质粒,并进行酶切和测序鉴定。
1.4 腺病毒同源重组穿梭质粒的构建 重组质粒pAdTrack-CMV-hITF 经PmeⅠ线性化,与骨架质粒pAdEasy-1在大肠杆菌BJ5183中同源重组,卡那霉素琼脂平板筛选,37 ℃过夜培养。挑阳性克隆提质粒,PacⅠ酶切鉴定。
1.5 重组腺病毒的包装 取5 μg的pAdEasy-hITF DNA用限制性内切酶PacⅠ消化,使用DNA纯化回收试剂盒,回收酶切产物,测量浓度后-20 ℃贮存备用。脂质体介导pAdEasy-hITF质粒转染HEK293细胞,剂量为5 μgPacⅠ酶切回收产物:10 μL Lipofectamine 2000脂质体,6 h后更换为完全培养基;脂质体转染腺病毒载体8~10 d之后可观察到细胞出现肿胀、变圆等典型CPE现象,即为第1代病毒;快速反复冻融4次后全部加入至6孔板的HEK293细胞中;2~3 d后细胞出现CPE现象,待大部分细胞变圆漂浮,按前述方法收集病毒上清,如此反复感染扩增,收集病毒,为第2代病毒;重复上述步骤将重组腺病毒在293细胞中反复扩增3轮后纯化,即得到高滴度的重组腺病毒。
1.6 腺病毒的滴度测定(TCID50法) 取病毒液200 μL,将病毒液用DMEM培养液稀释至10-1倍,病毒液的体积变为2 mL;从其中取出200 μL,将这200 μL 再稀释10倍,此时病毒液的体积为2 mL,而病毒液的浓度为原液的10-2倍;依次类推,直至稀释至10-10,共10管,各管有病毒液1.8 mL;在96孔培养板中培养293细胞;滴加病毒情况如下:第1行滴加10-10的病毒液,第2行滴加10-9,依次类推,到第8行时病毒液的稀释倍数为10-3,每行的第11、12列不加病毒液,以作对照用;于培养后第10天显微镜下观察各孔,以培养孔中出现CPE现象为阳性,计数阳性细胞孔数。根据Karbers公式计算所测样本病毒载体滴度:腺病毒载体滴度=101+1(阳性数-0.5) +1TCID50/mL=101+1(阳性数-0.5)+1-0.7pfu/mL。
1.7 重组腺病毒感染肠上皮细胞 HT-29细胞采用含100 mL/L FCS的DMEM培养液,青霉素、链霉素各100 U/mL,37 ℃、50 mL/L CO2培养,细胞隔天换液一次,每3~4 d进行传代,传代比例为1∶3,选取形态好的细胞用于实验研究。肠上皮细胞接种于6孔板细胞,以MOI值50计算所需病毒载体量;以新鲜培养液漂洗6孔板的细胞2次,将病毒加入至6孔板中,新鲜培养液补足至2 mL,37 ℃、50 mL/L CO2的培养箱培养;荧光显微镜观察荧光表达。
2 结 果
2.1 穿梭质粒pAdTrack-CMV-hITF的双酶切鉴定 将质粒pEGFP-N1-hITF、腺病毒穿梭质粒pAdTrack-CMV双酶切,连接过夜并转化E.coliDH5α感受态。随机挑选2个菌落提取质粒,经BglⅡ、NotⅠ双酶切后,切出996 bp大小的片段,证实为阳性克隆(图1)。
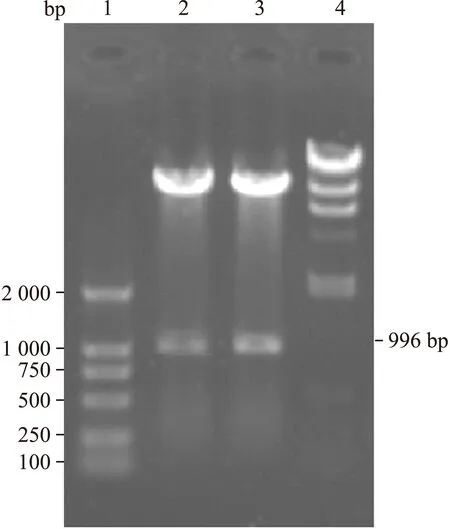
图1 重组质粒的酶切鉴定
Fig.1 Identification of recombinant plasmid with enzyme digestion
1:DL2000 Marker; 2, 3: Identification withBglⅡ andNotⅠ; 4:λDNA/HindⅢ。
2.2PacⅠ酶切鉴定 将穿梭质粒和骨架质粒同源重组后,长出数十个大中小号菌落,任意挑选8个中小号菌落摇菌、提质粒,用8 g/L琼脂糖凝胶进行电泳迁移率分析。结果8个重组质粒大小均和骨架质粒pAdEasy-1接近,考虑可能全部重组成功(图2)。任意挑选5号质粒用PacⅠ酶切进行鉴定。如果右臂和左臂同源重组,重组腺病毒质粒用PacⅠ酶切可产生4.5 kb左右的片段;如果右臂与ori同源重组,则PacⅠ酶切后产生大小约3.0 kb的片段。本实验酶切出一约3.0 kb大小的片段,故证明该腺病毒质粒重组成功,遂命名Ad-hITF(图3)。
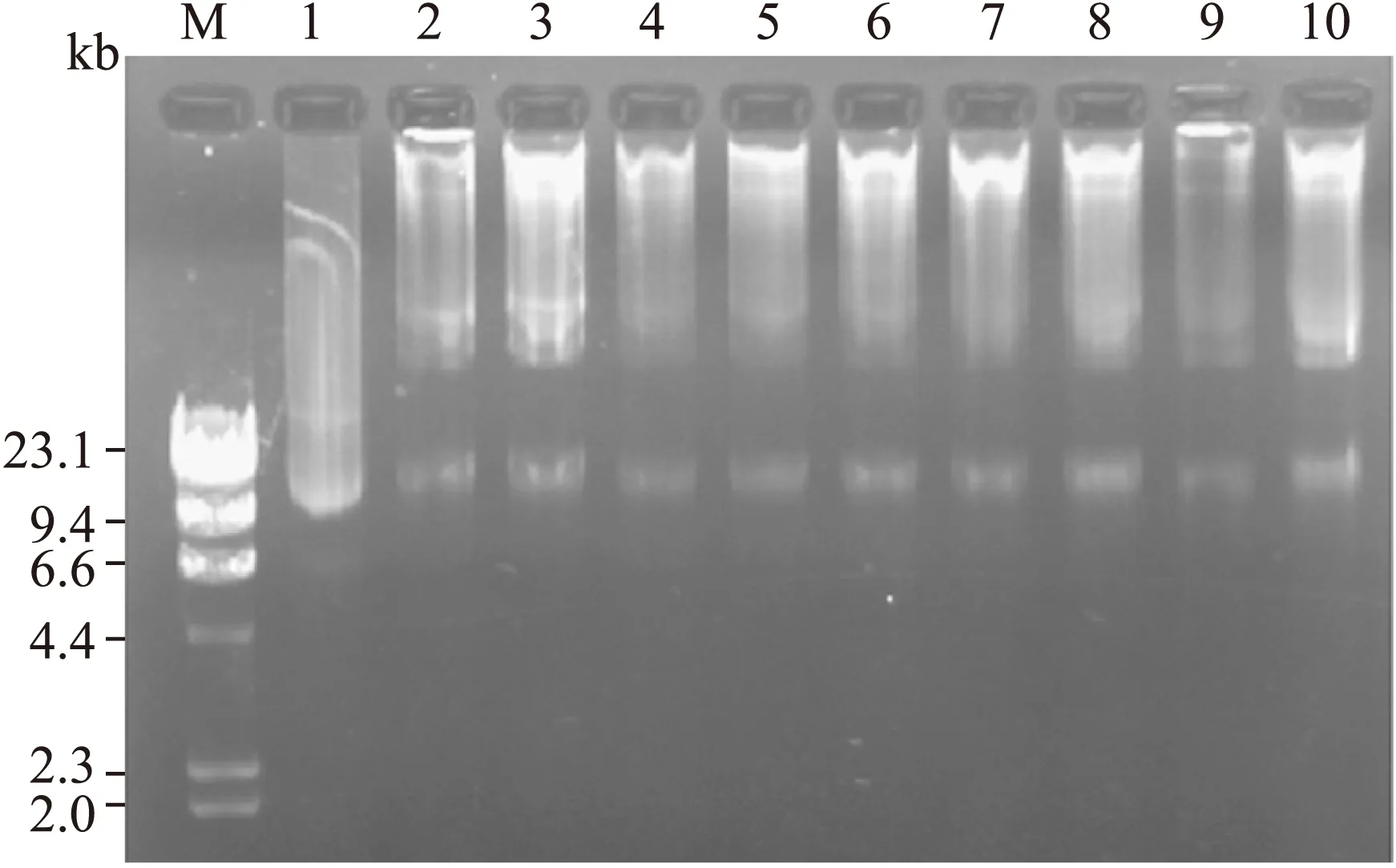
图2 重组腺病毒载体的电泳图
Fig.28 g/L agarose gel electrophoresis of recombinant adenoviral vector
M: λDNA/HindⅢ; 1: pAdTrack-CMV-hITF; 2~10: Ad-hITF。
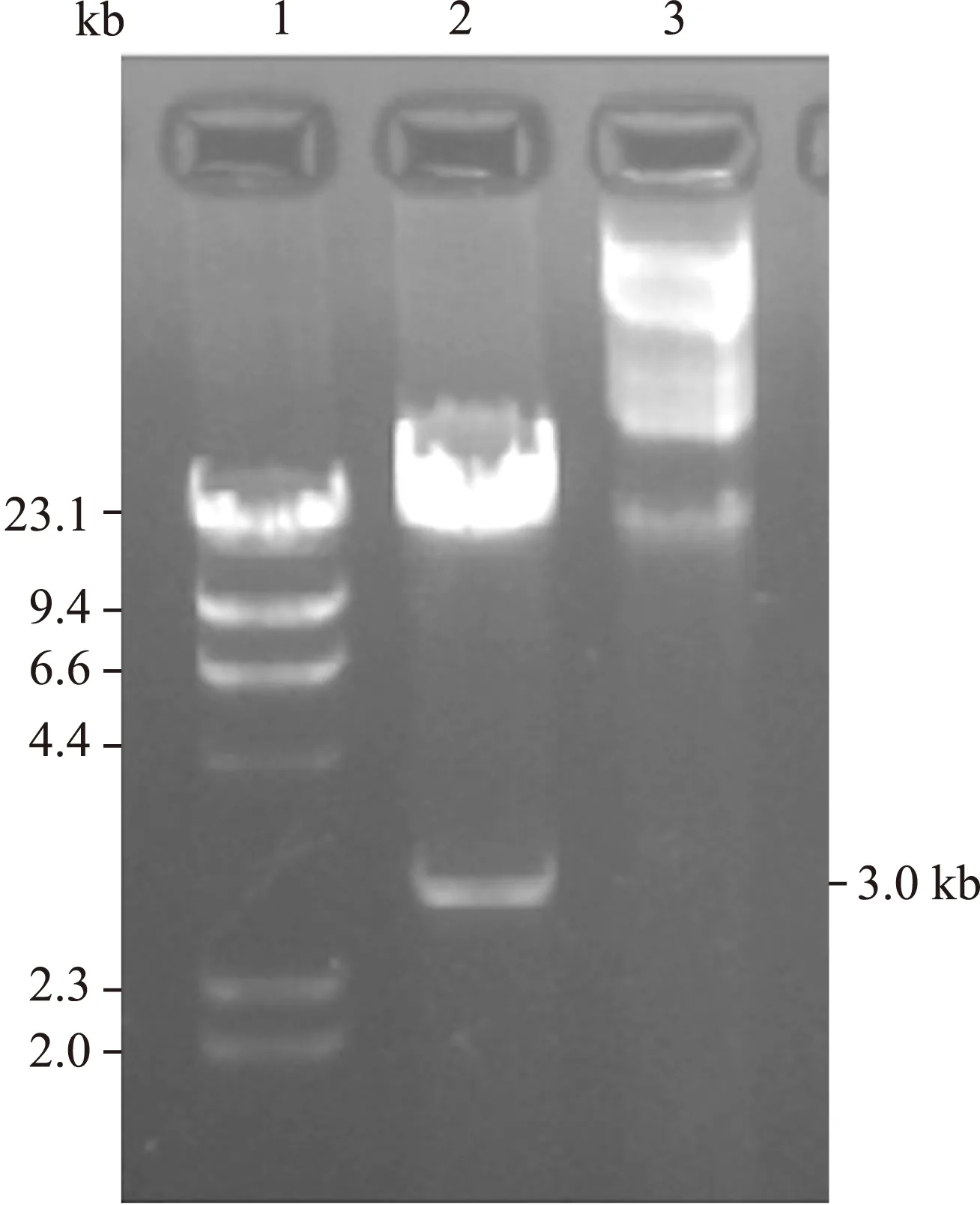
图3 重组质粒的酶切鉴定
Fig.3 Identification of recombinant plasmid with enzyme digestion
1: λDNA/HindⅢ; 2: Identification of Ad-hITF withPacⅠ; 3:Ad-hITF。
2.3 重组腺病毒的包装
2.3.1 第一轮(脂质体转染) 线性化的腺病毒载体在Lipofectamine2000介导下转染HEK293细胞,2 d后出现发绿色荧光细胞,此时光镜下部分细胞形态没有明显改变;5 d左右发光细胞大量增加,视野内荧光密集、明亮,成团出现;10 d之后全部细胞变成绿色,光镜下可观察到大量细胞出现肿胀、变圆等典型的细胞病变效应(cytopathic effect,CPE),部分细胞呈葡萄串样聚集,部分细胞变圆后漂浮(图4)。
2.3.2 第二轮 将第一轮包装病毒的上清液,继续感染 HEK293 细胞,以进一步提高滴度。如图所示,第二轮感染后1 d,出现较多的绿色细胞,此时细胞形态没有明显变化;2 d后,绿色细胞大量、成团出现,部分细胞肿胀、变圆;3 d后,几乎所有细胞变绿,荧光强度高,大量细胞变圆、漂起(图5)。
2.4 重组腺病毒滴度的测定 TCID50(Tissue culture infective dose 50,半数组织培养感染剂量),即指能在半数细胞培养板孔或试管内引起CPE的病毒量。本研究在HEK293细胞接种腺病毒后10 d,观察到在10-3、10-4稀释度的样本中全部HEK293细胞出现CPE现象,而10-10稀释度则没有出现CPE现象。按Karbers公式计算扩增所得腺病毒的滴度为=101+1(1+1+1+1+1+1+1+1+0.5+0-0.5)+1TCID50/mL=1010TCID50/mL或者=109.3pfu/mL=2×109pfu/mL。
2.5 荧光显微镜观察 重组腺病毒在MOI=50条件下感染HT-29细胞(3d),感染率较高,而细胞形态光镜下没有变化(图6)。
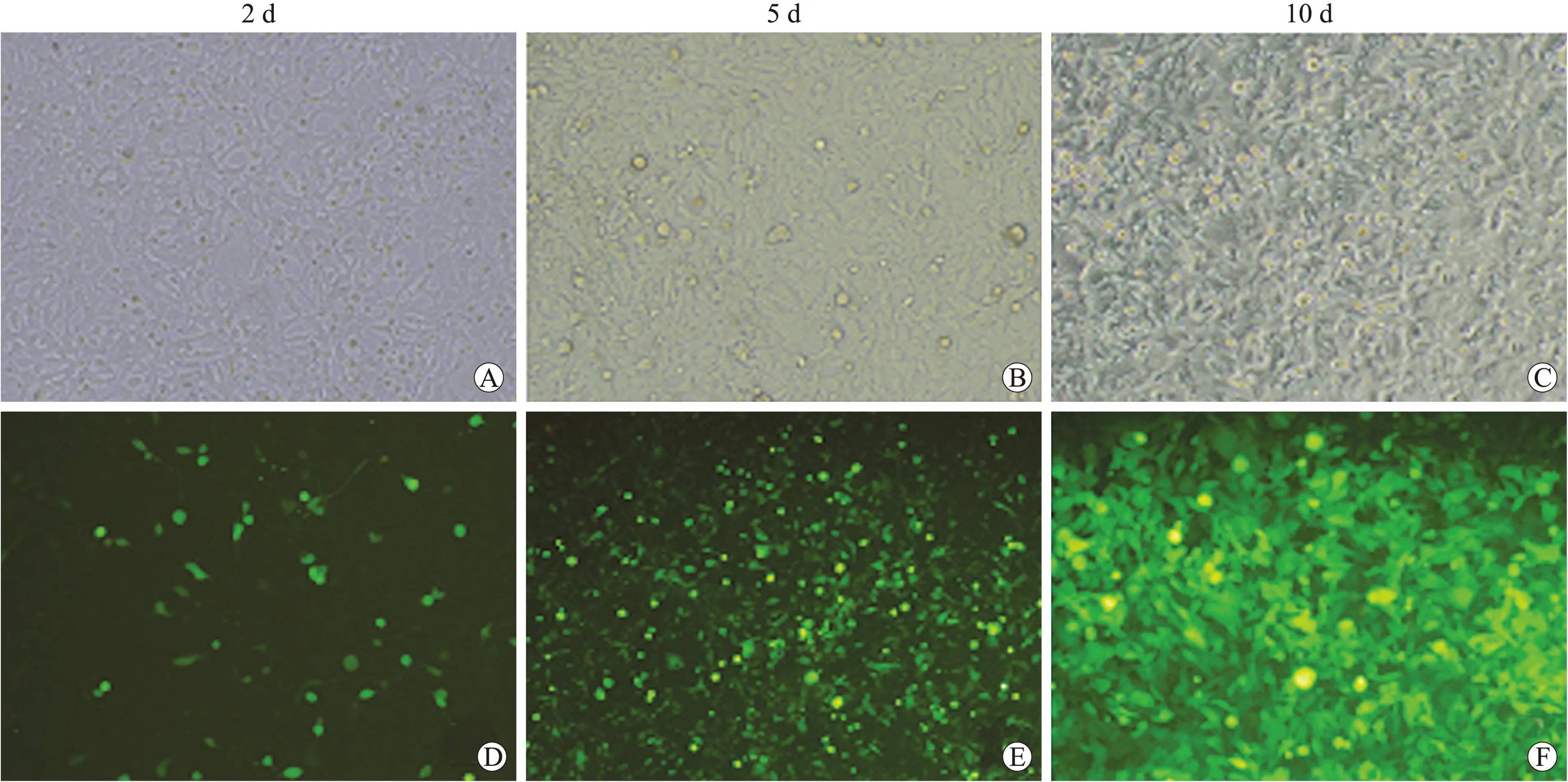
图4 重组腺病毒感染HEK293细胞(第一代)
Fig.4 Infection of HEK293 cell with recombinant adenoviruses (the first generation) (×100)
线性化的腺病毒载体在脂质体介导下转染HEK293细胞,照片拍摄于转染后2(A、D)、5(B、E)、10(C、F)d。A、B、C:为可见光;D、E、F:为绿色荧光。
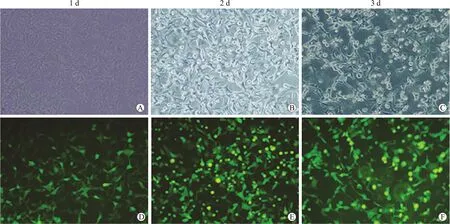
图5 重组腺病毒感染HEK293细胞(第二代)
Fig.5 Infection of HEK293 cell with recombinant adenoviruses (the second generation) (×100)
将第一代腺病毒继续感染HEK293细胞,用于制备第二代腺病毒,照片拍摄于感染后1(A、D)、2(B、E)、3(C、F)d;A、B、C:为可见光;D、E、F:为绿色荧光。
3 讨 论
本研究中我们使用的是第3代腺病毒,与其他类型基因传递载体比较,腺病毒载体具有以下优点:宿主范围广、安全、滴度高、多基因表达、稳定、外源基因容量大、可高水平介导外源基因表达、可感染增殖和非增殖细胞、与人类基因同源性以及免疫途径简便[8-10]。我们首先将hITF基因cDNA与穿梭质粒(pAdTrack-CMV)相连接,构建重组穿梭质粒pAdTrack-CMV-hITF。pAdTrack-CMV同样含有GFP报告基因,以方便检测与观察。然后将重组穿梭质粒线性化后与骨架质粒pAdEasy-1在大肠杆菌BJ5183中同源重组,构建重组腺病毒载体Ad-hITF。对于腺病毒的构建,以前多采用细胞内同源重组法重组腺病毒在MOI=50条件下感染HT-29细胞,感染后细胞形态无明显变化,照片拍摄于感染后3 d;A:绿色荧光;B:细胞核;C:A和B融合后。

图6 腺病毒Ad-hITF感染HT-29细胞(3 d)
Fig.6 Infection of HT-29 cell with recombinant Ad-hITF (3 d)
(双质粒共转染),即将带有目的基因的穿梭载体小质粒和带有腺病毒基因组的大质粒共同转染包装细胞:HEK293细胞,这两种质粒在293细胞内通过随机的同源重组,形成重组腺病毒载体基因组,并包装成具有感染性的复制缺陷型重组腺病毒。此方法的缺点是效率较低,费时费力。我们使用的AdEasyTM系统是新近构建的,即将含有外源基因的腺病毒穿梭质粒转化至携带有腺病毒骨架质粒的大肠杆菌,在细菌Cre重组酶的作用下发生同源重组,获得重组腺病毒载体质粒,重组质粒线性化后转染HEK293细胞,在其中包装成重组病毒颗粒。此方法重组过程在大肠杆菌内完成,操作相对简单、效率较高,同源重组率在60%以上,因而目前得到较广泛的应用[11-13]。
在成功构建并包装出重组腺病毒Ad-hITF后,我们将其感染人肠上皮细胞。人肠上皮细胞由于每天要经历频繁的机械摩擦和接触大量的刺激物质,如酸、碱、食物,甚至细菌,因此保证细胞间的紧密连接至关重要,肠上皮细胞的这种特征也决定了它的难转染性。预实验证明MOI=50的病毒滴度即可以达到最大的感染效率,而此时细胞也没有因为病毒感染产生病变。因此,我们选择MOI=50的病毒滴度进行细胞感染,荧光显微镜观察提示,此时重组腺病毒的感染率较高,同时细胞形态和正常细胞完全一样,生长速度、粘附力均未发生变化。
总之,本研究成功构建了含hITF基因cDNA的重组腺病毒载体并获得大量子代重组腺病毒,为腺病毒介导hITF基因治疗的应用打下基础。
[1] 孙勇,张勇,吕尚军,等. 肠三叶因子的纯化、理化性质及其稳定性分析[J].第四军医大学学报, 2009, 30(6):481-484.
[2] SUN Y, ZHU Y, WANG L, et al. Recombinant adenovirus-mediated intestinal trefoil factor gene therapy for burn-induced intestinal mucosal injury[J]. PLoS One, 2013, 8(4):e62429.
[3] YONG Z, LIN W, YONG S, et al. Kinetic characterization of an intestinal trefoil factor receptor[J]. PLoS One, 2013, 8(9):e74669.
[4] 成兵,农绍军,张跃平. 重组腺病毒介导白细胞介素18、12联合基因治疗前列腺癌的实验观察[J]. 中华医学杂志,2013,93(20):1590-1593.
[5] THUMANN G. Prospectives for gene therapy of retinal degenerations[J]. Curr Genomics, 2012, 13(5):350-362.
[6] XU C, SUN Y, WANG Y, et al. CEA promoter-regulated oncolytic adenovirus-mediated Hsp70 expression in immune gene therapy for pancreatic cancer[J]. Cancer Lett , 2012, 319(2):154-163.
[7] WESTPHAL M, YLA-HERTTUALA S, MARTIN J, et al. Adenovirus-mediated gene therapy with sitimagene ceradenovec followed by intravenous ganciclovir for patients with operable high-grade glioma (ASPECT): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2013, 14(9):823-833.
[8] WANG L, YAO B, LI Q, et al. Gene therapy with recombinant adenovirus encoding endostatin encapsulated in cationic liposome in coxsackievirus and adenovirus receptor-deficient colon carcinoma murine models[J]. Hum Gene Ther, 2011, 22(9):1061-1069.
[9] LEE WJ, KIM YO, CHOI IK, et al. Adenovirus-relaxin gene therapy for keloids: implication for reversing pathological fibrosis[J]. Br J Dermatol, 2011, 165(3):673-677.
[10] HASSAN MH, SALAMA SA, ZHANG D, et al. Gene therapy targeting leiomyoma: adenovirus-mediated delivery of dominant-negative estrogen receptor gene shrinks uterine tumors in Eker rat model[J]. Fertil Steril, 2010, 93(1):239-250.
[11] 张士龙,丁德刚,张祥生,等. 腺病毒靶向干扰S期激酶相关蛋白2基因对膀胱癌细胞生物学行为的影响[J]. 中华实验外科杂志, 2014, 31(02):353-355.
[12] 孙朋,杨吉成,谢宇锋,等. 腺病毒介导的白介素24联合放疗对CNE-2Z细胞株及其裸鼠移植瘤的抑瘤增效作用[J]. 中华耳鼻咽喉头颈外科杂志, 2013, 48(11):942-950.
[13] QI X, CHANG Z, SONG J, et al. Adenovirus-mediated p53 gene therapy reverses resistance of breast cancer cells to adriamycin[J]. Anticancer Drugs, 2011, 22(6):556-562.
(编辑 韩维栋)
Construction of recombinant adenovirus vector containing hITFand infection of intestinal epithelial cells
SUN Yong, CHEN Bao-jun, LE Juan, PAN Xiao-feng, ZHANG Fang
(1.Department of Burn Surgery, Huaihai Hospital Affiliated to Xuzhou Medical College,Xuzhou 221004; 2. Department of Burn Surgery, No.97 Hospital of PLA, Xuzhou 221004, China)
Objective To construct a recombinant adenovirus vector of human intestinal trefoil factor (hITF) and to determine its infection efficiency in human intestinal epithelial cells (HT-29). Methods The genomic fragment of hITF was amplified by PCR and subcloned into adenovirus shuttle plasmid to construct recombinant vector. Homologous recombination was performed by transferring the recombinant vector toE.coliBJ5183 containing the backbone pAd-Easy. The correct recombinant was selected and linearized withPmeⅠ, and then transfected into 293 cells for packaging and amplification. The titration of the recombinant adenovirus was determined. Human colon adenocarcinoma cell line (HT-29) was infected with recombinant adenovirus and infection efficiency was determined. Results The recombinant vector pAdTrack-CMV-hITF was constructed. After digestion with restriction enzymePmeⅠ, linearized recombinant vector was transformed into BJ5183 bacteria and the adenoviral plasmid Ad-hITF carrying hITF was generated with homologous recombination. The mature viruses would be packaged in 293 cells. The titer of the viruses was 2×109pfu/mL by TCID50 method. Transfection efficiency in HT-29 was high. Conclusion Recombinant adenovirus vector containing hITF gene has been successfully constructed and this research lays foundations for further application of hITF gene therapy.
intestinal trefoil factor; adenovirus; intestinal epithelial cell; gene therapy
2014-03-28
2014-06-09
国家自然科学基金资助项目(81100252);南京军区医学科研课题重点项目(12Z10) Supported by the National Natural Science Foundation of China (No.81100252) and the Scientific Research Funds of Nanjing Military Command (12Z10)
孙勇,博士,副主任医师,主要从事烧伤后胃肠黏膜损伤与修复的研究. E-mail: sunyong_97@sina.com
时间:2014-09-19 17∶16 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140919.1716.007.html
R379;R394.3
A
10.7652/jdyxb201406013

