1α, 25-二羟维生素D3对早期角膜移植小鼠Th17细胞的免疫调控作用*
吴 静, 张 瑾, 侯光辉, 崔裕波, 王 超, 陈 剑
(暨南大学 1医学院眼科研究所, 2附属第一医院眼科,广东 广州 510632;3珠海市人民医院眼科,广东 珠海 519000)
1α, 25-二羟维生素D3对早期角膜移植小鼠Th17细胞的免疫调控作用*
吴 静1△, 张 瑾2, 侯光辉3, 崔裕波2, 王 超2, 陈 剑2
(暨南大学1医学院眼科研究所,2附属第一医院眼科,广东 广州 510632;3珠海市人民医院眼科,广东 珠海 519000)
目的: 观察在同种异体角膜移植的小鼠模型中,1α, 25-二羟维生素D3对Th17细胞及其相关细胞因子的影响。方法: C57BL/6 小鼠作为受体,BALB/c小鼠作为供体,建立小鼠穿透性角膜移植术模型。术后隔日对角膜移植小鼠腹腔注射1.0 μg 1α,25二羟维生素D3(维生素D3干预组),模型组和正常对照组腹腔注射等量大豆油。在裂隙灯活组织镜下观察角膜移植物的透明情况,评估排斥反应的发生情况,并取角膜移植物做病理学检测。采用实时荧光定量PCR检测脾脏中IL-17、RORγt和IFN-γ的表达水平,Western blotting分析外周血中RORγt及IL-17的蛋白含量,流式细胞术检测外周血IL-17和IFN-γ细胞因子的表达情况。结果: 1α, 25-二羟维生素D3显著地抑制了同种异体角膜移植排斥反应,同时减少了角膜移植物的炎性渗出。应用1α, 25-二羟维生素D3治疗后,小鼠脾脏中IL-17、RORγt和IFN-γ的表达水平降低;外周血中IL-17、RORγt和IFN-γ的表达水平被下调。结论: 1α, 25-二羟维生素D3抑制小鼠同种异体角膜排斥反应的作用与IL-17及相关细胞因子RORγt细胞调节密切相关。
1α, 25-二羟维生素D3; 角膜移植术; 辅助性T细胞17; 白细胞介素17; 维甲酸相关孤儿受体γt
角膜病是最常见的致盲性眼病之一,角膜移植术是重建视力最主要的手段,在所有器官移植手术中成功率最高,因为角膜有自己独特的结构,缺乏血管和淋巴管,称为“免疫特权”[1]。尽管有这个“特权”,还是可以通过很多因素刺激角膜新生血管的增加和炎症细胞的浸润,引起角膜移植免疫排斥反应,导致再次致盲。当前角膜免疫排斥反应发生机制与多种细胞因子、炎症介质共刺激信号和信号转导通路有关。辅助T细胞17(T helper cell 17,Th17)是近几年发现的CD4+T细胞新亚群,与Th1细胞之间具有密切联系,通过产生促炎症细胞因子IL-17和IFN-γ等,诱发急、慢性炎症和组织损害[2-3],调节器官移植排斥反应的发生发展[4]。
为降低角膜移植术后排斥反应,目前临床上长期应用的传统免疫抑制剂有一定的局限性和毒副作用。如何低毒高效地降低角膜移植排斥反应,一直以来都受到研究者关注。 1α, 25-二羟维生素D3(1α, 25-dihydroxyvitamin D3)是维生素D3的活性形式。近年来认为其不仅具有调节钙磷代谢的作用,还可以通过维生素D受体作用于大多数免疫细胞,起着抗炎、下调MHCⅡ类分子和共刺激信号分子、促进外周T 淋巴细胞凋亡的作用[5-6]。我们设想通过建立小鼠穿透性角膜移植模型,以Th17细胞亚群为突破点,研究探讨1α, 25-二羟维生素D3干预角膜移植排斥反应的免疫机制,为低毒性控制角膜移植术后免疫排斥反应提供新思路。
材 料 和 方 法
1 实验动物与材料
健康SPF级雌性C57BL/6小鼠(n=30)作为受体,健康SPF级雌性BALB/c小鼠(n=10)作为供体,体重约(20±3)g,鼠龄6周,由广州省动物实验中心提供,动物许可证号为SCXK(粤)2008-0002。
将规格为每粒0.25 μg的1α,25-二羟维生素D3(Roche)液体稀释于无菌大豆油中,配成浓度为1 mg/L的腹腔注射液制品。兔抗小鼠RORγt抗体和兔抗小鼠IL-17抗体购自北京博奥森生物技术有限公司;抗β-actin抗体购自Santa Cruz;Trizol试剂购自Invitrogen;逆转录试剂盒及荧光定量PCR试剂盒购于日本东洋纺公司;引物均由上海捷瑞生物工程有限公司合成;荧光素标记抗小鼠单克隆抗体包括anti-IL-17-FITC、anti-IFN-γ-APC及同型对照购自BD。
JS-Power300电泳仪(上海培清);台式冷冻高速离心机(Eppendorf);眼科手术显微镜(苏州六六六视觉股份有限公司);微型PCR仪(BD);凝胶成像系统和流式细胞仪(BD)。
2 方法
2.1 穿透性角膜移植模型的建立和分组 动物适应性喂养1周后,从C57BL/6小鼠中随机抽取10只为正常对照组,其余小鼠行穿透性角膜移植术(penetrating keratoplasty,PKP)。以雌性BALB/c小鼠作为角膜供体,取双眼角膜后处死,雌性C57BL/6小鼠作为受体,术前用复方托吡卡胺滴眼液充分散瞳后,腹腔注入水合氯醛3 mL/kg全身麻醉,用环钻获取供体中央全层植片,置于受体角膜植床上,用11-0缝线行间断缝合6针,术后向前房内注入无菌空气。术毕,给移植眼结膜囊内涂左氧氟沙星凝胶。若出现明显的并发症及死亡,则进行补充,将建模成功的小鼠分为角膜移植组(PKP组,n=10)和VitD3干预组(PKP+ VitD3组,n=10)。术后1周内均用左氧氟沙星滴眼液点术眼,每天3次,术后对PKP+ VitD3组小鼠隔日腹腔注射1α, 25-二羟维生素D31.0 μg·kg-1·d-1,对照组(control)和PKP组小鼠隔日腹腔注射同等剂量的大豆油,连续2 周。
2.2 术后临床观察 术后每天在裂隙灯下观察角膜植片的透明程度,有无水肿及其程度,有无新生血管生成、数量和伸入达到植片象限范围的情况。
2.3 标本收集 于术后14 d随机处死每组小鼠,经心脏取其外周血、完整角膜和脾脏用于实验检测。
2.4 角膜病理学检查 将小鼠完整角膜(连角膜缘)置于4%多聚甲醛溶液固定,乙醇脱水、二甲苯透明后石蜡包埋,制成4 μm 石蜡切片,苏木精-伊红(HE)染色,在光镜下观察组织结构变化。
2.5 Real-time PCR检测RORγt、IL-17和IFN-γmRNA表达水平 取各组小鼠脾脏加入小鼠淋巴分离液充分研磨、离心,提取淋巴细胞,用Trizol法提取RNA,紫外分光光度仪测定A260/A280值并计算RNA浓度。取总RNA 1 μL合成产物cDNA。以此cDNA 1 μL为模版进行real-time PCR,反应体系20 μL,引物序列见表1。按下列条件进行扩增:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt法比较样本中靶基因的相对表达量。
2.6 Western blotting检测RORγt和IL-17的蛋白表达水平 取各组小鼠的外周血约2 mL,加入小鼠淋巴细胞分离液,离心后获得淋巴细胞。按比例加入裂解液,根据BCA蛋白定量试剂盒进行定量测定蛋白浓度,取总蛋白30 μL,SDS-PAGE分离目的蛋白,转膜,将膜浸在封闭液中37 ℃封闭1 h,再加入I抗(1∶1 000),4 ℃孵育过夜;PBST洗膜5 min 4次;将膜转入II抗(1∶30 000)中室温孵育1 h,PBST洗膜5 min 5次;ECL增强显色;凝胶图像分析仪曝光拍照,实验重复3次。采用ImageJ 软件对目的蛋白条带进行灰度扫描,以GAPDH作为内参照,结果以目的条带灰度值/同个样品GAPDH灰度值表示。
2.7 流式细胞术检测细胞内细胞因子IL-17和IFN-γ的比例 将各组小鼠外周血2 mL肝素化处理并分装于EP管中。每组样本接种于6孔培养板,加入佛波酯(PMA)、离子霉素(inomycin)和布雷菲德菌素A(BFA),在37 ℃、5% CO2条件下培养4 h,洗涤去上清;每管加anti-IL-17-FITC混匀,室温避光放置40 min,洗涤后去上清;使用破膜剂重悬细胞,具体操作按照试剂盒说明进行。加anti-IFN-γ-APC混匀,室温避光放置40 min,洗涤并重悬细胞,上机测定。采用FlowJo 7.3软件分析细胞内因子IL-17和IFN-γ的比例。
3 统计学处理
数据用均数±标准差(mean±SD)表示,应用SPSS 16.0软件进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 术后植片的观察
PKP组的角膜植片明显混浊,移植片边缘有新生血管长入,角膜移植免疫排斥反应发生;PKP+VitD3组的角膜植片水肿及混浊程度较前减轻,新生血管回退,角膜免疫反应减轻。
2 组织病理学结果
术后14 d, PKP组的角膜明显水肿增厚, 大量炎症细胞浸润,基质板层结构丧失,且有大量新生血管形成;PKP+VitD3组的角膜移植片水肿增厚程度较PKP组轻,少量炎症细胞浸润;正常对照组角膜无水肿,角膜各组织结构清晰有序,可见散在炎症细胞浸润,见图1。
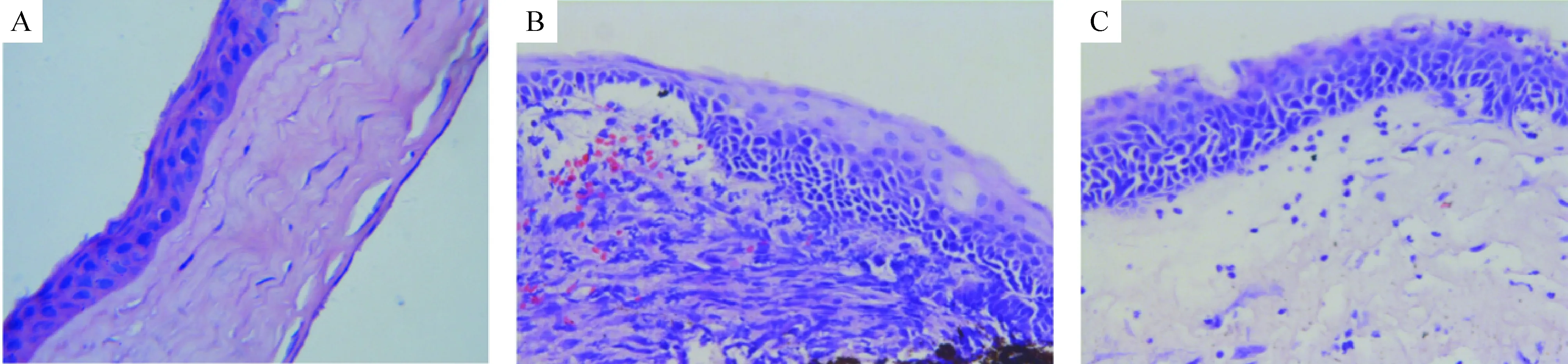
Figure 1.The pathological changes of cornea tissues in mice with different treatmens (HE staining,×400). A: control group; B: PKP group; C: PKP+VitD3group.
图1 各组小鼠角膜组织病理变化
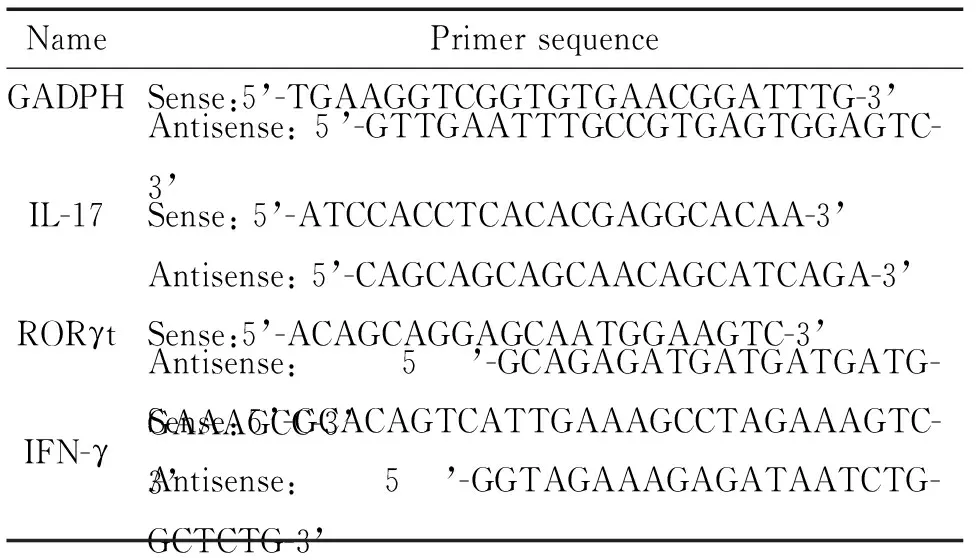
表1 引物序列
3 IL-17、RORγt和IFN-γ mRNA的表达水平
Real-time PCR检测结果显示与正常对照组比较,PKP组小鼠脾脏组织IL-17、IFN-γ及RORγt mRNA表达量均明显增高,差异均有统计学意义(P<0.05)。与PKP组比较,PKP+VitD3组的IL-17、IFN-γ及RORγt mRNA表达量均明显降低(P<0.05),见表2。
表2 各组小鼠脾脏组织细胞因子的real-time PCR结果
Table 2.The effect of VitD3on the mRNA expression of IL-17, RORγt and IFN-γ (Mean±SD.n=10)

GroupIL-17RORγtIFN-γControl1.02±0.261.06±0.121.03±0.32PKP28.08±0.72*4.45±0.44*29.87±0.15*PKP+VitD36.93±0.54*#2.26±0.21*#3.51±0.18*#
TableP<0.05vscontrol group;#P<0.05vsPKP group.
4 IL-17和RORγt的蛋白表达水平
Western blotting的检测结果可见正常对照组的IL-17蛋白表达量明显低于PKP组和PKP+VitD3组,而 PKP+VitD3组明显低于PKP组,差异有统计学意义(P<0.05)。PKP组的RORγt蛋白表达高于正常对照组和PKP+VitD3组,而PKP+VitD3组略高于正常对照组,差异有统计学意义(P<0.05),见图2。
5 外周血T淋巴细胞细胞因子IL-17及IFN-γ的表达水平
与正常对照组相比较,PKP组的IFN-γ表达显著升高,IL-17升高但没有IFN-γ显著;PKP+VitD3组的细胞因子IFN-γ表达高于正常对照组,但低于PKP组;细胞因子IL-17的表达低于PKP组,差异有统计学意义(P<0.05),而和正常对照组之间差异无明显统计学意义,见图3、表3。
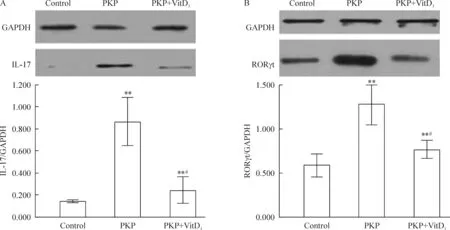
Figure 2.The protein expression of IL-17 (A) and RORγt (B) detected by Western blotting. The GAPDH was used as internal control.Mean±SD.n=10.**P<0. 01vscontrol group;#P<0. 05vsPKP group.
图2 Western blotting检测IL-17 和 RORγt蛋白水平的变化

Figure 3.The expression of IL-17 and IFN-γ in T cells in peripheral blood detected by flow cytometry. A: control group; B: PKP group; C: PKP+VitD3group.
图3 各组小鼠外周血T淋巴细胞中IL-17和IFN-γ的表达
讨 论
移植术后的排斥反应是角膜移植失败的主要原因,如何高效低度性控制角膜移植术后免疫排斥反应,提高角膜移植片的成活率以提高角膜盲的治愈率一直以来都倍受关注。众所周知目前传统抗排斥药物由于大剂量长时间使用,可造成不可忽视的神经毒性、肝肾功能损伤及高血压等毒副作用,并激发白内障和青光眼等并发症。因此,众多学者一直致力于高效低毒的免疫抑制物质的研发。
近年来, 1α, 25-二羟维生素D3除具有调节钙磷代谢的作用外,研究者们注意到了它在免疫调节中的重要角色和降低炎症反应的作用,并且作为一种新型的免疫调节剂被尝试性地应用到多种免疫相关性疾病的治疗研究中[7]。活性形式的维生素D3在炎症性肠病中作用于T细胞,促进辅助性T细胞2和调节性T细胞应答,抑制树突状细胞炎症活动,包括抗菌活性和调节促炎症细胞因子的产生[5]。在器官移植中应用1α, 25-二羟维生素D3后,移植物中IL-2 和 IFN-γ水平减少,IL-10 增加,抑制了适应性T细胞介导的急性排斥反应,从而延长移植物的存活时间[8]。所以我们把1α, 25-二羟维生素D3应用于角膜移植排斥反应中,看看是否可以抑制角膜免疫排斥反应。此外Th17 细胞参与了免疫排斥反应及炎症反应,但在角膜移植方面的研究相对较少,因此,我们想通过1α, 25-二羟维生素D3在角膜移植中对Th17细胞的影响,来验证是否可以抑制角膜移植免疫排斥反应。从实验结果中我们发现1α, 25-二羟维生素D3显著地改善了角膜病理组织表现,角膜混浊、水肿和新生血管的发生明显降低,减少了炎症细胞的浸润,维持角膜正常板层组织结构。同时1α, 25-二羟维生素D3可以降低Th17分泌的相关细胞因子,减轻了角膜移植免疫排斥反应。
表3 各组小鼠外周血T淋巴细胞内细胞因子IL-17和IFN-γ的表达
Table 3.The levels of intracellular IL-17and IFN-γ in T cells of the mice with different treatments (Mean±SD.n=10)

GroupIL-17IFN-γControl0.05±0.181.75±0.19PKP0.56±0.20*5.56±0.32*PKP+VitD30.14±0.11#2.83±0.53*#
*P<0.05vscontrol group;#P<0.05vsPKP group.
角膜免疫排斥反应的发生机制与免疫炎症反应的多种细胞因子、炎症介质密切相关。CD4+T细胞是介导排斥反应最主要的细胞群体,其失调是许多慢性炎症和自身免疫疾病发生的病理机制。Th17细胞是新近发现CD4+T细胞的一个细胞亚群,与自身免疫性疾病和移植免疫的发生密切相关,打破了以往Th1/Th2免疫调节模式。在角膜移植术后,Th17细胞通过分泌炎症因子调节免疫反应,介导组织损伤[9]。研究进一步确定了Th17细胞及其分泌的IL-17、IL- 6、TGF- β和IL- 21等细胞因子能促进炎症反应和器官移植免疫排斥反应[10]。IL-17是强有力的促炎症细胞因子,导致趋化因子表达、白细胞浸润和介导组织炎症,从而在急性炎症反应及移植免疫排斥反应中发挥重要作用[11]。IL-17的表达水平也与炎症反应发生程度密切相关。我们观察到,在角膜移植小鼠的血清及脾脏中IL-17的mRNA和蛋白表达量明显增高,注射1α, 25-二羟维生素D3以后,与角膜移植组相比显著减少,表明Th17细胞参与早期角膜免疫排斥反应;应用1α, 25-二羟维生素D3可以下调IL-17的蛋白翻译水平及转录水平,从而抑制角膜免疫排斥反应。同时在角膜移植术后早期出现高水平表达的IFN-γ,提示Th1细胞也参与了角膜移植免疫排斥反应的发生,与Th17细胞共同促进排斥反应的发生。应用1α, 25-二羟维生素D3不仅可以减少Th17细胞分泌IL-17等促炎症因子,也可以下调Th1细胞分泌的IFN-γ,表明1α, 25-二羟维生素D3对Th1细胞及Th17细胞均有抑制作用,比单一运用IL-17单克隆抗体抑制角膜排斥反应[12]的效果更好,对早期和后期角膜免疫排斥反应都有影响。
RORγt 是Th17细胞特征性转录因子,通过在分子水平调控T细胞和免疫器官的发育、成熟及细胞因子的产生,并诱导Th17细胞分泌IL-17,从而在T细胞分化调控中发挥关键作用[13]。RORγt不仅参与Th17细胞介导的器官移植急性排斥反应的发生,还可从调节IL-17分泌等方面促进排斥反应[14-15]。我们的研究结果显示,RORγt的蛋白和mRNA表达量越高,角膜组织炎症细胞浸润数量就越多,RORγt的变化情况与IL-17的变化趋势大致相同,从转录因子水平进一步佐证了Th17细胞与角膜移植排斥反应的严重程度相关。随着RORγt表达被1α, 25-二羟维生素D3干预下降的同时,角膜免疫排斥反应的症状也减轻了,通过降低RORγt表达而抑制Th17分化,导致Th17细胞分泌促炎症因子减少,这可能是1α, 25-二羟维生素D3参与抑制角膜免疫排斥反应发生的免疫机制。
总之,我们证实了1α, 25-二羟维生素D3对穿透性角膜移植模型小鼠体内的Th17细胞分化有潜在影响。Th17细胞在角膜移植免疫排斥反应中发挥了致病的作用,干扰Th17细胞的发生发展能影响小鼠角膜免疫排斥反应的发生。本研究提供了关于1α, 25-二羟维生素D3作为新型免疫抑制剂抑制角膜免疫排斥反应的新思路。然而,我们只证明了1α, 25-二羟维生素D3可以影响Th17的分化及其相关细胞因子的产生,从而减轻角膜免疫排斥反应发生,还需要更深层次地去探索其它基础免疫机制。
[1] Niederkorn JY. Corneal transplantation and immune privilege[J]. Int Rev Immunol, 2013, 32(1):57-67.
[2] 李庆山,杜庆华,谢健晋,等. 转录因子IRF8抑制Th17细胞分化并减轻T细胞免疫介导的小鼠结肠炎[J]. 中国病理生理杂志, 2014, 30(1):144-149.
[3] Weaver CT, Elson CO, Fouser LA,et al. The Th17 pathway and inflammatory diseases of the intestines, lungs, and skin[J]. Annu Rev Pathol, 2013, 8:477-512.
[4] Loverre A, Tataranni T, Castellano G, et al.IL-17 expression by tubularepithelial cells in renal transplant recipients with acute antibody-mediated rejection [J]. Am J Transpl, 2011, 11(6):1248-1259.
[5] Reich KM, Fedorak RN, Madsen K, et al.Vitamin D improves inflammatory bowel disease outcomes:basic science and clinical review[J]. World J Gastroenterol, 2014,20(17):4934-4947.
[6] Raman M, Milestone AN, Walters JR,et al.Vitamin D and gastrointestinal diseases:inflammatory bowel disease and colorectal cancer[J]. Ther Adv Gastroenterol, 2011, 4(1):49-62.
[7] Bock G, Prietl B, Mader JK, et al. The effect of vitamin D supplementation on peripheral regulatory T cells and β cell function in healthy humans: a randomized controlled trial[J]. Diabetes Metab Res Rev, 2011, 27(8):942-945.
[8] Yan G,Xi Y,Xu S,et al.Inhibiting accelerated rejection mediated by alloreactive CD4+memory T cells and prolonging allograft survival by 1α,25-dihydroxyvitamin D3in nude mice[J]. Immunol Lett, 2013, 149 (1-2):54-61.
[9] Xia Q, Duan L, Shi L, et al. High-mobility group box 1 accelerates early acute allograft rejection via enhancing IL-17+γδ T-cell response[J]. Transpl Int, 2014, 27(4):399-407.
[10]Chen H, Wang W, Xie H, et al. A pathogenic role of IL-17 at the early stage of corneal allograft rejection[J]. Transplt Immunol, 2009, 21(3):155-161.
[11]Vanaudenaerde BM, Dupont LJ, Wuyts WA, et al. The role of interleukin-17 during acute rejection after lung transplantation[J]. Eur Respir J, 2006, 27(4):779-787.
[12]Chen X, Zhao S, Tang X,et al. Neutralization of mouse interleukin-17 bioactivity inhibits corneal allograft rejection[J]. Mol Vis, 2011, 17:2148-2156.
[13]Isono F, Fujita-Sato S,Ito S.Inhibiting RORγt/Th17 axis for autoimmune disorders[J]. Drug Discov Today, 2014, 19(8):1205-1211.
[14]Fujita-Sato S, Ito S, Isobe T, et al. Structural basis of digoxin that antagonizes RORγt receptor activity and suppresses Th17 cell differentiation and interleukin (IL)-17 production[J]. J Biol Chem, 2011, 286(36):31409-31417.
[15]Yu Y, Wang D, Liu C, et al.Prevention of GVHD while sparing GVL effect by targeting Th1 and Th17 transcription factor T-bet and RORγt in mice[J]. Blood, 2011, 118(18):5011-5020.
Effect of 1α, 25-dihydroxyvitamin D3on T helper cell 17 and expression of related cytokines in penetrating keratoplasty in mice
WU Jing1, ZHANG Jin2, HOU Guang-hui3, CUI Yu-bo2, WANG Chao2, CHEN Jian2
(1InstituteofOphthalmology,SchoolofMedicine,2DepartmentofOphthalmology,TheFirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China;3DepartmentofOphthalmology,ZhuhaiPeople’sHospital,Zhuhai519000,China.E-mail:twujing@jnu.edu.cn)
AIM: To evaluate the effects of 1α, 25-dihydroxyvitamin D3on T helper cell 17 (Th17 cells) and its related cytokines in a mouse model of corneal allograft transplantation. METHODS: C57BL/6 mice were transplanted with corneal grafts from BALB/c mice and treated intraperitoneally with 1.0 μg 1α, 25-dihydroxyvitamin D3or soybean oil every other day after operation. The transparency of the corneal grafts was evaluated for potential rejection signs by slit lamp biomicroscopy and histopathology. The expression levels of IL-17, RORγt and IFN-γ in the spleen were measured by real-time PCR. Moreover, the protein expression of RORγt and IL-17 in the peripheral blood was analyzed by Western blotting. IL-17 and IFN-γ in peripheral blood were measured by flow cytometry. RESULTS: 1α, 25-dihydroxyvitamin D3significantly inhibited the rejection of the corneal allograft and reduced the numbers of inflammatory infiltrates in the corneal graft. In the spleen, 1α, 25-dihydroxyvitamin D3treatment reduced the expression levels of IL-17, RORγt and IFN-γ. In the peripheral blood, 1α, 25-dihydroxyvitamin D3treatment downregulated the expression levels of RORγt, IL-17 and IFN-γ. CONCLUSION: The effects of 1α, 25-dihydroxyvitamin D3on suppressing corneal transplantation-induced allograft rejection in mice are closely associated with its modulation on IL-17 and related cytokine RORγt.
1α, 25-Dihydroxyvitamin D3; Keratoplasty; T helper cell 17; Interleukin-17; Retinoid-related orphan receptor γt
1000- 4718(2014)12- 2226- 06
2014- 07- 17
2014- 10- 11
珠海市重点科技项目(No. 2013D 0401990017)
R363; R77
A
10.3969/j.issn.1000- 4718.2014.12.019
△通讯作者 Tel: 020-85226413; E-mail: twujing@jnu.edu.cn

