心脏移植术后早期原发性移植物功能衰竭的诊断标准、危险因素分析与治疗策略
杨守国 陈昊 王春生
原发性移植物功能衰竭(primary graft failure,PGF)是心脏移植术后早期主要的死亡原因和并发症之一[1-2]。在过去的20 年中,心脏移植术后早期生存率不断得到改善,药物治疗手段进步使急性排斥反应和感染等并发症导致的死亡减少,但PGF 导致的死亡却没有明显减少。国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)2010 年度统计数据显示,心脏移植术后1 个月受者死亡率为8%,其中由PGF导致的死亡占39%[1],是心脏移植术后第1 个月最常见死亡原因。此外,PGF 本身及其治疗措施可能与心脏移植受者术后并发感染、肾功能衰竭及晚期移植物血管病变相关。目前,我国正处于器官捐献人群转型的特殊时期,提高对PGF 的认识对于保障供器官质量及减少移植后PGF 发生具有重要意义。
1 PGF 定义与诊断标准
心脏移植后PGF 目前缺乏统一的临床定义。一般认为,PGF 是心脏移植术后早期移植心脏无法满足受者的循环需要,引起单个或两个心室功能不全的临床综合征,表现为低血压以及有足够的心脏充盈压时心输出量不足[3]。PGF 的诊断主要依据心脏移植术后第1 个24 h 内出现心功能不全的证据,包括左心、右心或全心衰竭;临床上表现为严重的血流动力学不稳定伴心源性休克,在排除如心包填塞或超急性排斥反应等其他原因所引起的急性移植物功能衰竭后即可诊断。具体的诊断标准见表1。根据受者恢复血流动力学稳定所需的循环支持治疗水平,可对心脏移植术后PGF 进行严重程度分级。2013 年第33 届ISHLT 年会中,根据71 位专家共识建立了初步的PGF 分级(见表2)。

表1 心脏移植术后原发性移植物功能衰竭诊断标准建议

表2 原发性移植物功能衰竭分级
2 发生率
不同移植中心报道的心脏移植术后PGF 发生率差异较大,为2.3% ~26.0%不等[4-5],原因在于各中心所采用的PGF 诊断标准不一致。美国器官资源共享网络(United Network for Organ Sharing,UNOS)的一项大规模回顾性研究以心脏移植术后90 d 内受者死亡或再次移植为标准诊断PGF,其发生率为2.5%[6];但有研究者认为该标准过于依赖“硬指标”,仅仅体现了临床上最坏的结果,低估了心脏移植术后PGF 的真实发生率[7]。如果以心脏移植术后早期需要大剂量正性肌力药物或机械辅助装置支持作为诊断标准,PGF 发生率为10% ~20%或更高[4,8-10]。在过去20 年中,心脏移植供、受者的人口构成变化也可能与PGF 发生率升高有关[5,10]。由于供心严重短缺以及等待心脏移植的患者不断增加,导致老年“边缘供者”和年轻供者的“不理想器官”的应用越来越多;此外,供者器官的长途转运导致心脏缺血时间延长;这两种危险因素结合在一起,极大地增加了心脏移植术后PGF 的发生风险和移植后死亡率[6,11]。
3 病因与发病机制
心脏移植术后PGF 发生的主要机制之一是移植术后急性缺血再灌注损伤导致的心肌顿抑。在整个移植过程中,供心要遭受脑死亡、热缺血、低温保存和再灌注等一系列损伤。不同供心的抗损伤能力有所不同,老龄供者供心的心脏移植受者更易发生PGF,根源在于老化的心肌细胞承受缺血再灌注损伤的能力下降[6,11-12]。首先,供者脑死亡后发生一系列事件往往导致心肌收缩力受损,包括脑死亡即刻儿茶酚胺快速释放造成心肌缺血、细胞内钙超载、蛋白酶激活以及收缩蛋白钙敏感性变化[13];同时,脑死亡即刻内源性“儿茶酚胺风暴”以及移植后心脏复苏过程中使用的外源性儿茶酚胺类药物可导致心肌β-肾上腺素能受体信号转导系统脱敏以及多种炎症介质激活[14]。此外,脑死亡后血清三碘甲状腺原氨酸、皮质醇(短暂升高后降低)、胰岛素等各类激素水平降低,均与心肌收缩力顿抑有关[15]。其次,大多数供心采用冷保存液存储和转运,但低温保存只能减缓细胞代谢速度而不能完全阻滞细胞代谢,因此长时间静态冷保存仍会导致心肌渐进性缺血损伤;同时,在冷保存期间,供心心肌细胞和血管内皮细胞缺乏正常的有氧代谢,导致跨膜钠钾泵功能障碍进而引起细胞肿胀,无氧代谢使高能磷酸化合物迅速减少最终产生乳酸性酸中毒[16]。最后,再灌注损伤进一步引发钙超载和氧化应激,均可造成心肌损伤[13,16]。因此,在心脏移植过程的每一个阶段,各类细胞应激对心肌功能的不利影响最终导致PGF 发生。
在供心无明显缺血再灌注损伤的情况下,心脏移植术后PGF 的发生主要与受者因素相关。临床上存在两种情况,第一种情况是受者存在不可逆性肺血管阻力升高,移植心脏无法克服受者过高的肺血管阻力带来的后负荷,随后出现单纯性右心功能衰竭或以右心衰竭为主的心功能衰竭。一项多中心研究发现,早期移植物功能衰竭是心脏移植受者死亡的主要原因之一,而由于该原因死亡的受者中43%(12/28)术前存在严重肺动脉高压,导致术后右心功能衰竭、心排出量下降进而全心功能衰竭[17]。第二种情况是受者存在多系统器官功能衰竭和败血症,并依赖机械通气和/或机械循环辅助而处于危重状态[2,4,6],受者恶劣的内环境是导致PGF 发生的原因;此种情况下发生PGF 的病理生理机制较复杂,可能涉及多种炎性细胞因子对移植心脏的共同作用。
多数情况下,心脏移植术后发生PGF 是供者、手术过程和受者多种因素综合作用导致的结果。例如,将一位老龄供者的心脏经较长时间保存后移植给一位肺血管阻力高的受者,则受者术后极有可能出现PGF;而如果供心来自一位年轻供者则受者术后可能不会出现PGF。另一方面,将一位老龄供者的心脏移植给血液动力学稳定且肺血管阻力低的受者,移植心脏往往可以充分发挥功能。因此,在考虑到PGF 危险因素的基础上合理匹配供、受者,对于最大限度地降低PGF 的发生至关重要。
4 危险因素分析
目前已经明确心脏移植术后发生PGF 的多个危险因素,分为供者、受者和移植手术因素[1],见表3。其中较为重要的一个危险因素是供、受者年龄老化,已被证实为心脏移植术后1 年死亡的主要危险因素[1]。供者年龄增长与PGF 发生密切相关,可能与随着年龄的增长心脏对缺血性损伤的耐受力降低,以及与年龄相关的心脏内源性病理改变增多有关[12]。
PGF 的另一重要危险因素为供心缺血时间,即心脏在供者体内停搏至移植入受者体内再灌注复跳的时间间隔。ISHLT 数据表明,供心缺血时间超过3 h 后,心脏移植术后1 年死亡率随缺血时间增加而升高[1]。Marasco 等[8]研究预测,供心缺血时间超过4 h 后每增加1 h,PGF 发生风险增加43%。有研究报道,供心缺血时间超过5 h 发生PGF 的风险增加了5 倍[5]。这些数据表明,目前供心获取和转运时所用保存技术的效果存在一定局限性,在心脏移植过程中供心缺血时间较长有时是不可避免的。因此,需要开发更为有效的保存技术,增强心脏保存液的心肌保护功效,使用含氧的体外灌注系统。
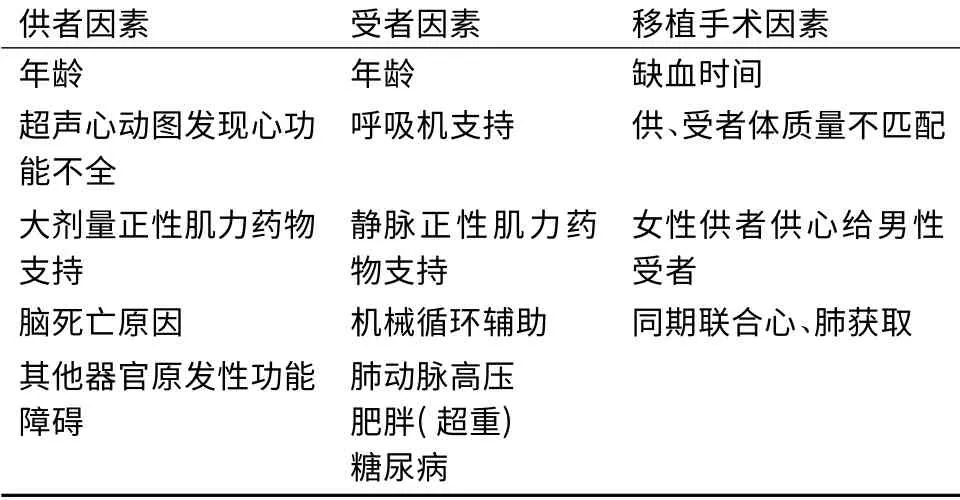
表3 心脏移植术后发生原发性移植物功能衰竭的危险因素
移植前供者存在心功能不全,即超声心动图提示左心室射血分数低、血流动力学不稳定或需要大剂量儿茶酚胺类药物支持也是发生PGF 的重要危险因素[2,4-5]。既往一旦供者出现这些迹象则被视为不适合移植,然而随着供心短缺问题日益突出,诸多中心开始利用这些“边缘供心”[4-5]。对于脑死亡供者,仍寄希望于由心肌顿抑所致的细胞功能障碍可在一段时间内恢复,尽管目前尚缺乏可靠的临床手段来区分脑死亡供者心肌细胞功能障碍是否可逆。我们认为,对一个潜在的心脏供者,即使其存在明显的心肌细胞功能障碍,年龄<30 岁和既往无任何心脏病史仍是决定使用该供者心脏最可靠的两项临床指标。
受者在移植前或移植时接受呼吸机支持或体外膜肺氧合(extracorporeal membrane oxygenator,ECMO)辅助是发生PGF 的重要危险因素[2,6]。这类受者通常病情危重,存在多器官功能障碍且常伴随败血症。如果采用有效措施如左心室辅助装置解决急性多器官功能障碍使受者状态保持稳定,移植将更安全。有报道接受植入式心室辅助装置治疗进行心脏移植前过渡的受者,移植术后PGF 发生呈上升趋势,但其移植术后生存率并未受到影响[6]。
供、受者体质量不匹配也是发生PGF 的重要危险因素。研究发现,供、受者体质量比值<0.8 且受者存在肺动脉高压(肺血管阻力>4 Wood 单位)与PGF 发生密切相关[6]。女性供者供心给男性受者,术后PGF 发生风险增加,且排斥反应增多,这可能与供、受者体质量不匹配相关,也可能与免疫过程有关[2]。此外,PGF 的发生与供者同期进行肺捐献也存在相关性,其机制可能为:供心和供肺获取过程中额外量的保存液冲洗可能造成右心室膨胀和功能障碍,心脏停搏时肺血管内细胞因子释放会导致心室功能不全[6]。同一供者进行多器官捐献与发生PGF 的相关性也有报道,更加突出了供者因素在PGF 发生中的潜在影响。
包括供者、受者和移植过程在内的多种因素参与了PGF 的发生,各危险因素并非独立作用。典型例子为Russo 等[11]报道的供者年龄和供心缺血时间之间的相互作用,供者年龄<20 岁时供心缺血时间对心脏移植术后受者生存率影响不大,供者年龄>20 岁时较长的供心缺血时间使受者生存率显著降低,当供者年龄>35 岁时这种相关性更为明显[3]。有学者综合已知的发生PGF 的危险因素建立了相应的风险预测工具和评分系统,即RADIAL 评分系统,其采纳的变量包括供者年龄≥30 岁和受者年龄≥60 岁、受者对正性肌力药物的依赖、受者右心房压力≥10 mmHg(1 mmHg =0.133 kPa)、受者合并糖尿病、供心缺血时间≥240 min[10]。虽然任何预测工具的效果都有一定局限性,但RADIAL 评分系统确实突出了合理匹配供、受者在预防心脏移植术后发生PGF 这一致命并发症方面的重要性。在不久的将来,随着对PGF 病因进一步深入研究以及对其危险因素的识别和确认,一个更加精确的预测评分系统或可期待。
5 治疗策略
心脏移植术后PGF 的治疗仍然极具挑战性,在术后30 d 内这段关键时期,尽管采用了高强度药物治疗以及机械循环辅助(主动脉内球囊反搏、ECMO及心室辅助装置),但PGF 病死率仍居高不下[1-2]。对于轻度PGF 患者,使用大剂量正性肌力药物可以恢复心肌收缩力并保持血流动力学稳定;各种正性肌力药物均可用于治疗PGF,包括儿茶酚胺类药物、磷酸二酯酶抑制剂以及左西孟旦。对于重度PGF患者,需要使用主动脉内球囊反搏或ECMO 支持来维持血流动力学稳定以及重要器官的灌注。使用ECMO 的决策需要早期做出,在手术室一旦尝试使用正性肌力药物和升压药物脱离体外循环困难时就应决定。早期使用ECMO 可以保证移植心脏有更多时间从遭受的多种损伤中恢复过来,并且能够预防因心源性休克未能及时纠正导致的继发多系统器官功能衰竭。近年来,ECMO 管路的改进使移植受者的生存率得到显著提高,与10 年前采用体外心室辅助装置行左心室支持、采用离心泵行右心室支持的技术相比,并发症反而更少[5,8,18]。ECMO 支持需持续使用至移植心脏功能改善,移植心脏功能可在术后1 ~7 d 恢复[5];大多数在72 h 内恢复。评估移植心脏功能恢复的时间点,通常通过每天床旁超声心动图检查时短暂减少ECMO 流量来判断。
对于心脏移植术前存在肺动脉高压的受者,PGF通常表现为移植后立即发生右心功能不全,处理措施包括应用特异性肺血管扩张剂(如吸入一氧化氮)降低肺血管阻力,有时可能需要机械循环辅助[18]。
6 预 后
PGF 是导致心脏移植术后30 d 内受者死亡的首要原因。文献报道心脏移植术后PGF 发生率越来越高[4-5],但有临床注册研究表明,过去的20 年中因PGF 导致的受者早期死亡数量并没有改变[1-2]。提示PGF 的预后在不断改善,可能得益于针对这些危重病例所采用的药物治疗和ECMO 支持的有效性和安全性不断改善[4-5]。PGF 对心脏移植1 个月以后的影响目前尚不清楚,有研究发现严重的缺血再灌注损伤可导致多种炎症介质上调而触发急性排斥反应[14],同时使受者易发生心脏移植物血管病[19],这两种情况均可能导致晚期移植物功能衰竭。
7 预防和展望
鉴于多种PGF 危险因素的影响具有叠加作用,对供、受者进行仔细匹配是将PGF 发生风险降至最低的关键。在供者脑死亡后至心脏获取前的时间间隔,供心功能可能迅速恶化,在这段期间内脑死亡供者的优化管理一直是一个难点。90%以上的脑死亡供者需要使用一种或以上的正性肌力药物或升压药物,最常用的是去甲肾上腺素。虽然低剂量输注儿茶酚胺类药物似乎是安全的,但大剂量输注会增加PGF 发生风险,因此应尽可能避免[4]。脑死亡后使用垂体激素优化供器官质量的相关研究是一个长盛不衰的课题,垂体加压素可有效替代去甲肾上腺素用于维持血压,减少去甲肾上腺素需要量的升级[20]。供心保存和转运的时间间隔为心脏移植医师介入处理供心提供了第2 次机会。目前大多数供心都置于低温心脏停搏/保存液中存放和运输,临床上多关注心脏停搏/保存液与缺血再灌注损伤的细胞和分子机制的复杂性,但对器官保存的最佳策略缺乏共识。自上世纪90 年代早期开始,Plegisol 液、Bretschneider 液和Celsior 液等心脏停搏/保存液在临床上已广泛使用,能为缺血时间<4 h 的标准供心提供足够保护[1]。但这些配方液的心肌保护能力并不是针对当前临床实践中使用越来越多的“边缘供心”,尤其是缺血时间较长供心的最优保存方案。另一种较有希望的保存方法是体外灌注技术,目前这种技术在心脏移植中的经验有限[21]。一项大规模随机对照试验发现,尸体供肾经机械灌注保存后,其对应受者移植后1 年原发性移植物功能不全的发生率显著减少,移植肾存活率明显提高[22]。
为满足日益增长的心脏移植需求,将越来越多地依赖于“边缘供者”,意味着PGF 仍将是心脏移植一个重要并发症。虽然针对PGF 的治疗方案已有明显改善,但其发生率和病死率仍相当高。尽管在一些情况下可以通过合理匹配供、受者从而减少PGF 发生,但完全预防PGF 发生需要确立更有效的供者管理方案和供心保存策略,这些仍将是当前基础和临床研究的最优先领域。
1 Stehlik J,Edwards LB,Kucheryavaya AY,et al. The Registry of the International Society for Heart and Lung Transplantation:twentyseventh official adult heart transplant report—2010[J]. J Heart Lung Transplant,2010,29(10):1089-1103.
2 Young JB,Hauptman PJ,Naftel DC,et al. Determinants of early graft failure following cardiac transplantation,a 10-year,multiinstitutional,multivariable analysis[J]. J Heart Lung Transplant,2001,20(2):212.
3 Segovia J,Pulpón LA,Sanmartín M,et al. Primary graft failure in heart transplantation:a multivariate analysis[J]. Transplant Proc,1998,30(5):1932.
4 D'Alessandro C,Golmard JL,Barreda E,et al. Predictive risk factors for primary graft failure requiring temporary extra-corporeal membrane oxygenation support after cardiac transplantation in adults[J]. Eur J Cardiothorac Surg,2011,40 (4):962-969.
5 Listijono DR,Watson A,Pye R,et al. Usefulness of extracorporeal membrane oxygenation for early cardiac allograft dysfunction[J]. J Heart Lung Transplant,2011,30(7):783-789.
6 Russo MJ,Iribarne A,Hong KN,et al. Factors associated with primary graft failure after heart transplantation[J]. Transplantation,2010,90(4):444-450.
7 Beiras-Fernandez A,Kaczmarek I,Weis F. Primary graft failure after heart transplantation:urgent need for a consensus guideline[J].Transplantation,2011,91(6):e31.
8 Marasco SF,Esmore DS,Negri J,et al. Early institution of mechanical support improves outcomes in primary cardiac allograft failure[J]. J Heart Lung Transplant,2005,24(12):2037-2042.
9 Oto T,Excell L,Griffiths AP,et al. Association between primary graft dysfunction among lung,kidney and heart recipients from the same multiorgan donor[J]. Am J Transplant,2008,8(10):2132-2139.
10 Segovia J,Cosío MD,Barceló JM,et al. RADIAL:a novel primary graft failure risk score in heart transplantation[J]. J Heart Lung Transplant,2011,30(6):644-651.
11 Russo MJ,Chen JM,Sorabella RA,et al. The effect of ischemic time on survival after heart transplantation varies by donor age:an analysis of the United Network for Organ Sharing database[J]. J Thorac Cardiovasc Surg,2007,133(2):554-559.
12 O'Brien JD,Ferguson JH,Howlett SE. Effects of ischemia and reperfusion on isolated ventricular myocytes from young adult and aged Fischer 344 rat hearts[J]. Am J Phys,2008,294(5):H2174-H2183.
13 Jahania MS,Mullett TW,Sanchez JA,et al. Acute allograft failure in thoracic organ transplantation[J]. J Card Surg,2000,15(2):122-128.
14 Pratschke J, Wilhelm MJ, Kusaka M, et al. Activation of proinflammatory genes in somatic organs as a consequence of brain death[J]. Transplant Proc,1999,31(1-2):1003-1005.
15 Novitzky D,Cooper DK,Rosendale JD,et al. Hormonal therapy of the brain-dead organ donor:experimental and clinical studies[J].Transplantation,2006,82(11):1396-1401.
16 Hicks M,Hing A,Gao L,et al. Organ preservation[J].Methods Mol Biol,2006,333:331-374.
17 Bourge RC,Naftel DC,Costanzo-Nordin MR,et al. Pretransplantation risk factors for death after heart transplantation:a multiinstitutional study. The Transplant Cardiologists Research Database Group[J]. J Heart Lung Transplant,1993,12(4):549-562.
18 Kavarana MN,Sinha P,Naka Y,et al. Mechanical support for the failing cardiac allograft:a single-center experience[J]. J Heart Lung Transplant,2003,22(5):542-547.
19 Day JD,Rayburn BK,Gaudin PB,et al. Cardiac allograft vasculopathy:the central pathogenetic role of ischemia-induced endothelial cell injury[J]. J Heart Lung Transplant,1995,14(6):S142-S149.
20 Pennefather SH,Bullock RE,Mantle D,et al. Use of low dose arginine vasopressin to support brain-dead organ donors[J].Transplantation,1995,59(1):58-62.
21 Jacobs S,Rega F,Meyns B. Current preservation technology and future prospects of thoracic organs. Part 2:heart[J]. Curr Opin Organ Transplant,2010,15(2):156-159.
22 Moers C,Smits JM,Maathuis MH,et al. Machine perfusion or cold storage in deceased-donor kidney transplantation[J]. New Engl J Med,2009,360(1):7-19.

