A-NK细胞抗口腔舌鳞状细胞癌的实验研究
刘 红 祝 军 张 真
A-NK细胞抗口腔舌鳞状细胞癌的实验研究
刘 红 祝 军△张 真
目的 观察黏附性自然杀伤(A-NK)细胞体外生长与增殖能力,探讨其治疗裸鼠舌鳞状细胞癌移植瘤的效果及其作用机制,为临床治疗鳞癌提供理论依据。方法抽取健康人外周血,分选出A-NK细胞和非黏附性自然杀伤(NA-NK)细胞体外培养,镜下观察细胞生长情况。建立裸鼠舌鳞癌皮下移植瘤模型,随机分成3组,每组7只小鼠,分别瘤旁注射生理盐水、A-NK细胞和NA-NK细胞,观察肿瘤体积变化,33 d后,处死裸鼠,剥离移植瘤,称瘤质量,绘制肿瘤生长曲线。结果镜下观察,A-NK细胞在第15天达到增殖高峰,NA-NK细胞于第12天达到增殖高峰。培养3周后,A-NK细胞共增加39.33倍,NA-NK细胞仅增加16.33倍。生理盐水组裸鼠口腔舌鳞癌移植瘤体积大于NA-NK细胞组和A-NK细胞组,NA-NK细胞组大于A-NK细胞组,3组裸鼠肿瘤体积在组间、时间和交互效应上差异均有统计学意义(P<0.01)。第33天,生理盐水组裸鼠瘤质量大于NA-NK细胞组和A-NK细胞组,NA-NK细胞组大于A-NK细胞组(P<0.05)。结论A-NK细胞和NA-NK细胞均可在裸鼠体内诱导明显的抗肿瘤效应,且A-NK的抑瘤作用大于NA-NK细胞。
杀伤细胞,天然;舌肿瘤;癌,鳞状细胞;A-NK细胞;NA-NK细胞;裸鼠移植瘤;抗肿瘤效应
口腔舌鳞状细胞癌是口腔颌面部发病率较高的恶性肿瘤,侵袭性强,局部复发与远处转移率高,患者预后较差,生存率低,严重危害人类健康。免疫治疗在肿瘤综合序列治疗中作为继手术、放疗与化疗之后的又一种新型治疗手段,越来越受到重视。但由于口腔舌鳞癌细胞缺乏特异性的肿瘤抗原,因而免疫治疗仍处于瓶颈时期[1],亟待研究和开发新型免疫治疗方法和靶点。自然杀伤(natural killer cell,NK)细胞及其在抗肿瘤免疫效应机制中的作用是近年来研究的热点[2-3],黏附性自然杀伤(adherent natural killer cell,A-NK)细胞被认为是一类表型和功能独特的NK细胞亚群,具有高水平的NK细胞毒性和增殖能力。本课题旨在探索A-NK细胞在口腔舌鳞癌治疗中的作用效果,为A-NK细胞的临床应用提供动物实验基础。
1 材料与方法
1.1 材料、仪器及试剂 人舌鳞状细胞癌细胞系Tca8113-Tb(上海交通大学医学院附属第九人民医院肿瘤生物实验室);裸鼠,SCID/BG系,SPF级,4~5周龄,体质量10~20 g,雌性,购自上海斯莱克实验动物有限公司;磁珠分选仪(国美天旎生物技术有限公司);淋巴细胞分离液(sigma公司),rhIL-2(南京军区军事医学研究所);RPMI1640培养液(Gibco)。
1.2 实验方法
1.2.1 NK细胞的分离纯化 无菌抽取正常人群外周血,用淋巴细胞分离液分离出单个核细胞,经贴壁黏附和尼龙毛柱黏附去除单核细胞和B细胞。将上述分离去除单核细胞和B细胞后取得的单个核细胞(PBMC)溶红素处理,平衡盐充分洗涤后,加入到CD56单抗包被的磁珠系统中孵育,平衡盐再次洗涤,于miniMACS分离器磁场中上柱分选,平衡盐洗柱收集细胞。免疫磁珠仪检测所得细胞表面CD3、CD56分子,分析NK细胞回收率和纯化率。
1.2.2 A-NK和非黏附性NK(NA-NK)细胞的分离 取免疫磁珠分选的高纯度NK细胞,用α-MEM培养基调整细胞浓度为2×106/mL,置于无菌塑料平皿中,与6 000 U/mL IL-2水平培养3 h(37℃5%CO2)。用温α-MEM培养基洗脱收集NA-NK 4次。加入PBS(含0.02 W/V EDTA)4℃放置10 min,冷α-MEM洗3次,收集A-NK细胞。
1.2.3 A-NK细胞和NA-NK细胞的体外扩增 分别将收集的A-NK细胞和NA-NK细胞,用α-MEM培养基调整细胞浓度为2×106/mL,加入200 U/mL IL-2,培养于24孔板中。每3 d更换新鲜培养液,补充细胞因子,保持细胞因子终浓度不变,细胞浓度在(3~4)×106/mL,并计数细胞,绘制细胞生长曲线。
1.2.4 人舌鳞癌细胞皮下成瘤裸鼠模型的建立 取指数增殖期Tca8113细胞,用0.25%胰蛋白酶消化制成单细胞悬液,调整细胞密度至1.0×107/mL,台盼蓝染色计数活细胞占95%以上。于每只裸鼠右前肢背部皮下接种2.0×106个(0.2 mL)细胞,33 d后处死,分离移植瘤,10%福尔马林固定、脱水、石蜡包埋、制片(4 μm厚),HE染色,光学显微镜下观察。
1.2.5 A-NK细胞免疫功能增强对口腔癌的效应 动物接种Tca8113细胞方法同人舌鳞癌细胞皮下成瘤裸鼠模型的建立。接种后第3天,将裸鼠随机分为3组,每组7只,分别为对照组、NA-NK细胞组和A-NK细胞组。对照组每2 d于接种肿瘤细胞的局部皮下注射0.1 mL生理盐水,NA-NK细胞组和A-NK细胞组每2 d于接种肿瘤细胞的局部皮下分别注射相应细胞0.1 mL(5.0×106个),共注射3次。于接种肿瘤细胞2周后每3 d用游标卡尺测量移植瘤的最小径a、最大径b,计算出移植瘤体积V=a2·b/2,并得出裸鼠移植瘤体积生长曲线。第33天断颈处死小鼠,剥取移植瘤称质量。
1.3 统计学方法 应用SPSS 18.0软件进行数据处理,计量资料采用±s表示,2组间比较采用独立样本t检验,不同时期计量资料之间比较采用重复测量资料的方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 分离A-NK细胞和NA-NK细胞 血样标本显示5×107个外周血单个核细胞经免疫磁珠分选后,可得到1.6×107个NK细胞(其中A-NK细胞为41%,NA-NK细胞为59%),流式细胞仪检测细胞存活率达98.6%,NK细胞的纯度由纯化前的(29.66± 2.31)%增加至(95.37±1.93)%。
2.2 A-NK细胞的体外增殖能力 A-NK细胞在α-MEM培养基中生长良好,细胞透亮有光泽,贴附于器皿底部,见图1。加入IL-2刺激因子后,A-NK细胞于0~15 d增殖速度较快,NA-NK细胞于0~12 d增殖速度较快,以后增殖速度均减慢,培养3周后,A-NK细胞共增加39.33倍,NA-NK细胞仅增加16.33倍,见图2。
Fig.1 A-NK cells cultured in vitro(×20)图1 A-NK细胞的体外培养(×20)

Fig.2 The growth culture of A-NK cells vesus with NA-NK cells图2 A-NK细胞与NA-NK细胞生长曲线比较
2.3 人舌鳞癌细胞皮下成瘤裸鼠模型的建立 刚接种舌鳞癌细胞的裸鼠均可见圆形小皮丘,第2天后消退,接种肿瘤细胞2周后,肿瘤开始缓慢生长,于18 d后出现快速生长期。HE染色可见大量的舌鳞状细胞癌细胞,细胞巢状排列,呈多角型,核大、深染,部分肿瘤细胞蜕变坏死,并伴有淋巴细胞浸润,提示建模成功,见图3。
2.4 A-NK细胞对裸鼠移植瘤的抑制作用 局部应用A-NK细胞和NA-NK细胞对裸鼠口腔鳞癌移植瘤均有明显的抑制作用,且A-NK细胞组对肿瘤的抑制作用强于NA-NK细胞组,见图4。
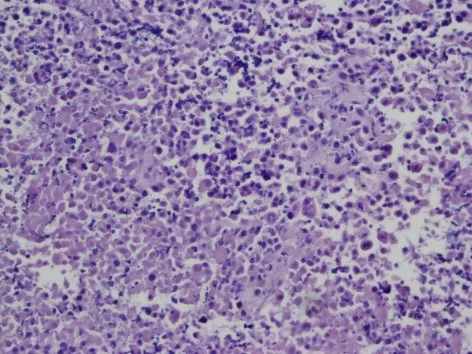
Fig.3 HE staining of tongue squamous cancer cells(×200)图3 舌鳞癌细胞的HE染色(×200)
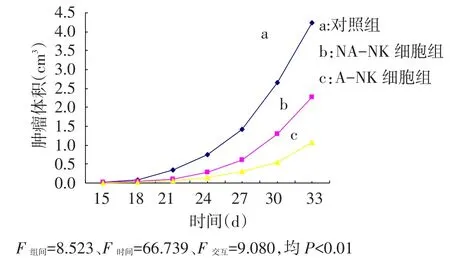
Fig.4 Growth curve of transplanted tumors in nude mice图4 裸鼠移植瘤体积生长曲线
2.5 2组裸鼠的瘤质量比较 第33天,3组裸鼠瘤质量差异均有统计学意义(F=19.333,P<0.01),对照组大于NA-NK细胞组和A-NK细胞组(g:3.74± 1.22 vs 2.03±0.71 vs 0.96±0.38),NA-NK细胞组大于A-NK细胞组(均P<0.05)。
3 讨论
口腔舌鳞状细胞癌占口腔鳞癌第一位,由于恶性程度高,术后预后差,近年探索其新型有效的治疗方法成为研究热点[4]。NK细胞具有较高的体外增殖能力和抗肿瘤能力[5],能够侵入到实体瘤内部杀伤肿瘤细胞,为口腔舌鳞状细胞癌治疗带来了新的希望。
3.1 A-NK细胞和NA-NK细胞的体外增殖能力 NK细胞以22 μmol/L IL-2诱导下是否能迅速黏附到实体表面的能力被分为A-NK细胞和NANK细胞,它们均具有高水平的NK细胞毒性和增殖能力。但其在人体血液中数量较少,需体外扩增以达到临床级别的细胞数量[6]。体外培养NK细胞主要分为2个过程:贴壁和生长,细胞黏附至培养介质上,进而铺展,这是贴壁细胞生长的必要条件。须珏华等[7]对兔骨髓间充质干细胞在DMEM高糖培养基(DMEM-HG)、DMEM低糖培养基(DMEM-LG)、α-MEM三种培养基中贴壁效果进行实验研究,发现α-MEM有利于细胞贴附。本研究中采用α-MEM培养基,A-NK和NA-NK细胞贴附于培养基底,生长状态良好。A-NK细胞具有强大的体外扩增能力,有研究报道在IL-2参与下96 h A-NK细胞增殖快于NA-NK细胞[8],本研究中A-NK细胞和NA-NK细胞培养3周后,A-NK细胞共增加39.33倍,NA-NK细胞仅增加16.33倍,提示A-NK细胞的增殖能力强于NA-NK细胞,也证实了这一实验研究。
3.2 SCID/BG小鼠移植瘤模型的建立 本研究选用的是SCID/BG小鼠,它是BALB/c-beige/beige同源近交系小鼠将beige基因引入C.B-17 SCID小鼠体内,研究表明其体内各项免疫指标均低于实验常用的SCID(Severe Combined Immune-deficiency)小鼠和BALB/c nu-nu小鼠,可成为肿瘤免疫治疗的良好活体承载系统[9]。本研究中SCID/BG小鼠接种肿瘤细胞2周后,肿瘤开始缓慢生长,18 d后出现快速生长期,HE染色可见大量的舌鳞状细胞癌细胞,证明其可为本实验提供较可靠的移植瘤模型。
3.3 A-NK细胞与NA-NK细胞抗肿瘤的可能机制 本研究结果提示局部应用A-NK细胞和NANK细胞对裸鼠口腔舌鳞癌移植瘤均有明显的抑制作用,且A-NK细胞组对肿瘤的抑制作用强于NANK细胞组。分析原因,A-NK细胞可能通过多种机制抑制肿瘤细胞:(1)通过穿孔素和颗粒酶介导途径,二者的协同作用可使A-NK细胞产生最佳效应的细胞毒作用。(2)直接接触肿瘤细胞发挥杀伤作用,NK细胞表达的肿瘤坏死因子(TNF)死亡配体可与肿瘤表面的死亡受体相结合发挥杀伤效应。(3)细胞因子介导途径,A-NK细胞分泌多种细胞因子,通过破坏肿瘤微循环或改变靶细胞表面的pH值、糖代谢等方式杀死肿瘤细胞。(4)在A-NK细胞刺激下,其他的内源性效应细胞和细胞毒分子渗出,引起肿瘤出血坏死[10]。本实验中发现肿瘤细胞凋亡与坏死同时存在,推断可能是多种机制共同作用的结果。
本研究提示A-NK细胞能有效抑制裸鼠舌鳞癌移植瘤的生长,但目前国内外对其研究还停留在基础实验阶段,其具体作用机制尚不明确,因此还需对A-NK细胞免疫功能重建进行深入研究。
[1]Chakraborty K,Bose A,Goswami KK,et al.Dysregulated CC receptor/ligand in monocytes/macrophages from tongue squamous cell carcinoma patients is partially rectified by interferon α-2b[J].Hum Immunol,2012,73(1):38-47.doi:10.1016/j.humimm.2011.10.015.
[2]Lee SW,Park HJ,Park SH,et al.Immunomodulatory effect of polyγ-glutamic acid derived from Bacillus subtilis on natural killer dendritic cells[J].Biochem Biophys Res Commun,2014,443(2):413-421.doi:10.1016/j.bbrc.2013.11.097.
[3]Bae S,Oh K,Kim H,et al.The effect of alloferon on the enhance-ment of NK cell cytotoxicity against cancer via the up-regulation of perforin/granzymeB secretion[J].Immunobiology,2013,218(8):1026-1033.doi:10.1016/j.imbio.2012.12.002.
[4]Tao J,Tao S,Han J.RECQL1 plays an important role in the development of tongue squamous cell carcinoma[J].Cell Physiol Biochem, 2014,33(5):1579-1590.doi:10.1159/000358721.
[5]Sarker MM,Zhong M.Keyhole limpet hemocyanin augmented the killing activity,cytokine production and proliferation of NK cells,and inhibited the proliferation of Meth A sarcoma cells in vitro[J].Indian J Pharmaco,2014,46(1):40-45.doi:10.4103/0253-7613.125164.
[6]Wei J,Satomi M,Negishi Y,et al.Effect of sera on the adhesion of natural killer cells to the endothelium in severe pre-eclampsia[J].J Obstet Gynaecol Res,2006,32(5):443-448.
[7]Xu JH,Hu JB,Zhou Y,et al.Effects of culture mediums on the proliferation and differentiation of rabbit mesenchymal stem cells[J]. Journal of Clinical Rehabilitative Tissue Engineering Research,2007, 11(3):467-470.[须珏华,胡静波,周燕,等.培养基对兔骨髓间充质干细胞扩增与分化的影响[J].中国组织工程研究与临床康复,2007, 11(3):467-470.]doi:10.3321/j.issn:1673-8225.2007.03.021.
[8]Ohata K,Espinoza JL,Lu X,et al.Mycophenolic acid inhibits natural killer cell proliferation and cytotoxic function:a possible disadvantage of including mycoph-enolate mofetil in the graft-versushost disease prophylaxis regimen[J].Biol Blood Marrow Transplant, 2011,17(2):205-213.doi:10.1016/j.bbmt.2010.08.014.
[9]Xu WJ,Guo JG,Wu YQ.The part of the immune indexes determination and comparison of Specific Pathogen Free in SCID/bg mice, BALB/c nude mice and SCID mice[J].Laboratory Animal and Comparative Memcine,2013,33(2):153-156.[许文静,郭建光,吴艳秋. SPF级SCID.BG小鼠与BALB/c裸小鼠、SCID小鼠部分免疫指标的测定与比较[J].实验动物与比较医学,2013,33(2):153-156.] doi:10.3969/j.issn.1674-5817.2013.02.015.
[10]Chan CJ,Smyth MJ,Martinet L.Molecular mechanisms of natural killer cell activation in response to cellular stress[J].Cell death and differentiation,2013,21(1):5-14.doi:10.1038/cdd.2013.26.
(2014-02-27收稿 2014-07-15修回)
(本文编辑 李鹏)
Study of Anti-Tumor Effect of NK Cells on Oral Tongue Squamous Cell Carcinoma
LIU Hong,ZHU Jun△,ZHANG Zhen
Department of Stomatology,Affiliated Traditional Chinese Medicine Hospital,Xinjiang Medical University, Xinjiang 830000,China
△
E-mail:ZJ29518@126.com
ObjectiveTo explore the treatment effect and mechanism of A-NK cells on the subcutaneous transplanted tumor of oral tongue squamous cell carcinoma in nude mice through observing the external growth and hyperplasia of A-NK cells and to provide theoretical evidence for squamous cell carcinoma treatment.MethodsA-NK cells and NA-NK cells were both derived from healthy human peripheral blood and cultured in vitro.Cell growth was observed under microscope.The squamous cell carcinoma model in nude mice was established through subcutaneous implanting of Tca8113 cells. Then they were randomly assigned into three groups who were injected with either saline solution,or A-NK cells or NA-NK cells paraneoplastically.All animals were sacrificed after 33 days when tumor were isolated then weight and change in tumor size were assessed.Finally curve of tumor growth was drawn.ResultsUnder the microscope,the proliferation of A-NK cells peak in 15 days and NA-NK cells peak in 12 days.After 3 weeks,the number of A-NK cells increased by 39.33 times while the number of NA-NK cells increased by 16.33 times.The Volume of tongue squamous cell carcinoma in saline solution group was larger than that in A-NK cells and NA-NK cells groups,and volume in the NA-NK cells group was larger than that in A-NK cells group.The volume of tongue neoplasms in different groups,time,and interaction effects are statistically significant(P<0.01).The tongue neoplasms weight in the saline solution group was greater than that in the A-NK cells and NA-NK cells group,and the weight in NA-NK cells group was greater than that in A-NK cells group,and the difference are statistically significant(P<0.05).ConclusionA-NK cells and NA-NK cells can significantly inhibit the subcutaneous transplanted tumors in nude mice and the anti tumor effect of A-NK group is stronger than NA-NK.
killer cells,natural;tongue neoplasms;carcinoma,squamous cell;A-NK cells;NA-NK cells;nude mice model;anti-tumor effect
R739.8
A
10.3969/j.issn.0253-9896.2014.12.010
自治区科技支疆项目(201191158)
新疆医科大学附属中医医院口腔科(邮编830000)△
E-mail:ZJ29518@126.com

