针对人SND1基因两个AUG的细胞应激分析
高星杰何津岩葛林张毅付雪尹洁张纬史雪彬苏征姚智杨洁,△
细胞与分子生物学
针对人SND1基因两个AUG的细胞应激分析
高星杰1何津岩2葛林2张毅3付雪1尹洁1张纬2史雪彬2苏征2姚智2杨洁1,2△
目的针对人SND1基因2个蛋白翻译起始密码子AUG构建真核表达质粒pCMV-N-Flag-SND1-No1/ 2,并分析2个AUG在SND1应激颗粒形成中的作用。方法以SND1全长转录本为模板,PCR法扩增含BamHⅠ和EcoRⅠ酶切位点的目的基因SND1-No1/2,双酶切法分别酶切目的基因片段和线性pCMV-N-Flag,以T4-DNA连接酶将两者连接成pCMV-N-Flag-SND1-No1/2重组质粒,然后将构建的重组质粒转染入HeLa细胞内,以Western印迹法检测Flag标签(DYKDDDDK)与SND1-No1/2的融合表达,最后以细胞免疫荧光实验检测在氧化应激状态下Flag-SND1-No1/2融合蛋白与内源性SND1应激颗粒的胞内共定位情况。结果以单/双酶切及基因测序法鉴定构建的重组质粒无误,Western印迹结果检测到融合蛋白Flag-SND1-No1/2的表达;细胞免疫荧光结果显示Flag-SND1-No1/2均可与内源性SND1应激颗粒共定位。结论重组pCMV-N-Flag-SND1-No1/2质粒构建成功,SND1基因第1个AUG的缺失并不影响SND1应激颗粒的形成。
重组融合蛋白质类;应激;质粒;基因表达;SND1;AUG;应激颗粒
人类SND1(staphylococcal nuclease domain containing 1)蛋白,又称为p100或Tudor-SN(Tudor staphylococcal nuclease),参与基因转录、细胞应激、pre-mRNA剪切等多种生物学过程[1-3]。研究发现,多个物种的SND1基因序列中存在2个蛋白翻译起始密码子AUG[4-5],而目前对于它的功能探讨尚少见。本课题针对人类SND1基因的两个AUG,分别构建pCMV-N-Flag-SND1-No1/2重组质粒,在真核细胞内融合表达N端携带Flag标签的SND1-No1蛋白(以第1个AUG为起始点)与SND1-No2蛋白(以第2个AUG为起始点),继而进行细胞免疫荧光实验,从细胞应激角度分析两个AUG在SND1应激颗粒形成中的作用。
1 材料与方法
1.1 材料
1.1.1 质粒、细胞及菌株pCMV-N-Flag载体购自碧云天公司;SND1全长转录本FL23924购自美国复能基因;HeLa细胞来自本实验室;Trans1-T1感受态细胞购自北京全式金生物技术有限公司。
1.1.2 试剂与仪器Taq酶购自北京鼎国昌盛生物技术公司;限制性内切酶BamHⅠ、EcoRⅠ、T4 DNA连接酶、辣根过氧化物酶标记的抗鼠源IgG二抗购自Fermentas公司;T/A载体(pEASY-T1)购自北京全式金生物技术有限公司;质粒快速小提试剂盒购自北京索来宝科技有限公司;DNA快速凝胶回收试剂盒购自北京博大泰克生物基因技术有限公司;Lipofectamine 2000、Alexa Fluor 555标记的驴抗羊IgG荧光二抗、Alexa Fluor 488标记的驴抗鼠IgG荧光二抗购自Invitrogen公司;去内毒素质粒提取试剂盒购自Promega公司;BCA蛋白测定试剂盒购自Pierce公司;多克隆羊源抗SND1抗体、DAPI染料购自Santa公司;LumiGLo化学发光底物购于KPL公司;单克隆鼠源抗Flag抗体、单克隆鼠源抗β-actin一抗、亚砷酸盐购自Sigma公司;激光共聚焦皿购自NEST公司;激光共聚焦荧光显微镜(基础医学研究中心)购自日本Olympus公司;引物合成及基因测序工作由北京天一辉远公司完成。
1.2 方法
1.2.1 获取目的基因片段首先根据SND1的蛋白编码区序列(NM_014390.2)设计含有BamHⅠ和EcoRⅠ限制性内切酶位点的引物序列,见表1。再以质粒快速小提试剂盒提取包含SND1全长转录本的FL23924质粒,并以其为模板,PCR扩增目的片段,条件为95℃预变性5 min,95℃30 s,60℃50 s,72℃3 min,进行35个循环,72℃延伸10 min。将PCR产物进行琼脂糖凝胶电泳鉴定,紫外灯下切割含有目的条带的凝胶块,利用凝胶回收试剂盒进行目的片段回收,在T4 DNA连接酶作用下,与pEASY-T1(T/A载体)25℃连接15 min。连接产物转化Trans1-T1感受态细胞,在含有氨苄/卡那霉素的LB平板上筛选克隆。挑取阳性克隆,摇菌扩增并提取质粒。以BamHⅠ和EcoRⅠ进行双酶切,凝胶回收试剂盒回收并纯化各目的片段。
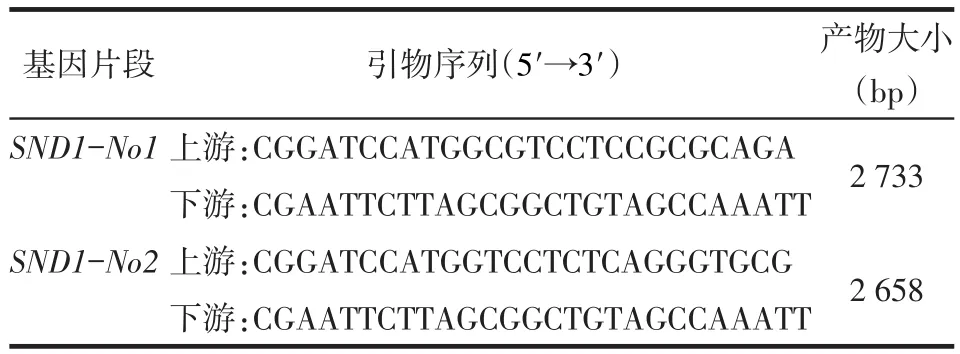
Tab.1 The primer sequences of SND1-NO1/2 gene fragment表1 SND1-No1/2基因片段引物序列
1.2.2 线性pCMV-N-Flag的获取以质粒快速小提试剂盒提取pCMV-N-Flag质粒,进行BamHⅠ和EcoRⅠ双酶切后,完整切下线性pCMV-N-Flag质粒载体,0.75%琼脂糖电泳分离。凝胶回收试剂盒回收得到4 321 bp的线性pCMV-NFlag。
1.2.3 重组真核表达质粒pCMV-N-Flag-SND1-No1/2的构建在T4 DNA连接酶作用下,将线性pCMV-N-Flag质粒载体与具有相同黏性末端的SND1-No1/2功能片段进行22℃连接过夜。连接产物转化Trans1-T1感受态细胞,在含有卡那霉素的LB平板上筛选克隆。挑取阳性克隆,摇菌扩增并提取重组质粒。
1.2.4 酶切及基因测序鉴定用BamHⅠ和EcoRⅠ对重组质粒pCMV-N-Flag-SND1-No1/2进行单、双酶切,并以0.75%的琼脂糖凝胶电泳验证片段的大小。同时,对重组质粒进行基因测序鉴定。
1.2.5 细胞转染及Western印迹检测以去内毒素质粒提取试剂盒提取无内毒素pCMV-N-Flag-SND1-No1/2重组质粒。HeLa细胞接种至激光共聚焦皿中,置于含10%胎牛血清的DMEM高糖培养基,37℃5%的CO2培养箱中培养,至细胞80%汇合时,依据产品说明书进行脂质体瞬时转染重组质粒。分别转染pCMV-N-Flag-SND1-No1/2重组质粒以及pCMV-N-Flag空载对照质粒后48 h,先以预冷的1×PBS溶液洗涤转染后HeLa细胞3次,加入预冷的1×NP-40裂解液裂解细胞,晃动培养板数次以确保裂解液完全覆盖细胞,用无菌的细胞刮刮取细胞并转移至一个1.5 mL Eppendorf管中,冰浴20 min。超声破碎细胞后4℃、12 000 r/min离心10 min,取上清获得全细胞裂解液,以BCA蛋白测定试剂盒测定总蛋白浓度。裂解液中加入SDS上样缓冲液(50 mmol/L Tris-Cl pH6.8,2%SDS,0.1%溴酚蓝,10%甘油,2.5%β-巯基乙醇),99℃热变性5 min,进行6%SDS-PAGE电泳。电泳结束后,以半干转法将凝胶上蛋白转移至PVDF膜,用含5%脱脂奶粉的TBST溶液室温封闭2 h,分别加入单克隆鼠源抗Flag一抗,单克隆鼠源抗β-actin一抗(1∶1 000),4℃孵育过夜。TBST溶液洗膜3次,每次10 min,加入辣根过氧化物酶标记的抗鼠源IgG二抗(1∶15 000)室温孵育1 h,TBST溶液再次洗膜3次,每次10 min。加入LumiGLo化学发光底物后暗室曝光。
1.2.6 细胞免疫荧光实验转染pCMV-N-Flag-SND1-No1/2重组质粒后48 h,分为正常组与应激组(0.5 mmol/L亚砷酸盐,1 h)。4%多聚甲醛室温固定10 min,加500 μL 1 g/L DAPI室温避光孵育3 min,PBS洗涤3次,5 min/次;0.2%通透液(含0.2%Triton X-100的PBS)室温静置通透10 min;再加入1% BSA封闭1 h。加入多克隆羊源抗SND1一抗和单抗体鼠源抗Flag一抗的混合液(1∶100)4℃孵育过夜。PBS洗涤3次,10 min/次。再加入Alexa Fluor 555标记的驴抗羊IgG荧光二抗与Alexa Fluor 488标记的驴抗鼠IgG荧光二抗的混合液(1∶800),4℃孵育8 h。PBS洗涤3次,10 min/次。最后以激光共聚焦荧光显微镜观察细胞内的荧光信号。每组实验检测50个细胞,分别重复3次。
2 结果
2.1PCR扩增目的片段以SND1全长转录本为模板,针对2个AUG进行PCR扩增,以0.75%的琼脂糖凝胶电泳鉴定PCR产物,结果在2 700 bp左右观察到与目的片段长度相符的荧光条带,其中SND1-No2条带位置比SND1-No1略低,见图1。

Fig.1 The obtaining of targeting SND1-No1/2 fragment图1 目的片段SND1-No1/2的获取
2.2 线性pCMV-N-Flag质粒载体的获取采用BamHⅠ和EcoRⅠ双酶切pCMV-N-Flag质粒,切下完整的线性pCMV-N-Flag质粒载体,见图2。经0.75%的琼脂糖凝胶电泳,可在4 300 bp左右出现条带,见图3。纯化回收后用于后续的连接反应。

Fig.2 The map of pCMV-N-Flag vector图2 pCMV-N-Flag载体图谱
2.3 重组真核表达质粒pCMV-N-Flag-SND1-No1/ 2的鉴定将重组质粒分别进行BamHⅠ和EcoRⅠ的单、双酶切,经0.75%的琼脂糖凝胶电泳,产生的条带大小与预期相符,见图4,重组质粒基因测序结果也正确。

Fig.3 The obtaining of linear pCMV-N-Flag vector图3 线性pCMV-N-Flag质粒载体的获取
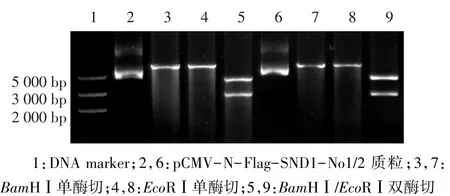
Fig.4 Single/double enzyme digestion of pCMV-N-Flag-SND1-No1/2图4 pCMV-N-Flag-SND1-No1/2的单、双酶切鉴定图
2.4Western印迹法检测融合蛋白表达收集转染有pCMV-N-Flag-SND1-No1/2和pCMV-N-Flag空载(vector)的HeLa细胞,分别以鼠源抗Flag抗体检测融合蛋白Flag-SND1-No1/2的表达,以抗β-actin抗体检测内源性β-actin的表达。其中Flag-SND1-No1/2蛋白分子质量分别为102.0 ku,99.7 ku。Western印迹法检测出与目的融合蛋白分子质量相符的蛋白条带,见图5。

Fig.5 The data of Western blotting assay图5 Western印迹结果
2.5 荧光共定位分析见图6。将pCMV-N-Flag-SND1-No1/2重组质粒转染入HeLa细胞,以抗Flag抗体和抗SND1抗体进行免疫荧光分析,激光共聚焦荧光显微镜下可见正常组中Flag-SND1-No1/2主要分布于细胞浆中;当给予0.5 mmol/L亚砷酸盐氧化应激处理时,两者均可呈颗粒状分布,且与内源性的SND1应激颗粒呈共定位关系。

Fig.6 Cellular co-localization analysis of Flag-tagged SND1-No1/2 and endogenous SND1 protein图6 Flag-SND1-No1/2与内源性SND1的细胞内应激共定位分析
3 讨论
多功能SND1蛋白首次是作为EB病毒细胞核抗原2(Epstein-Barr virus nuclear protein 2,EBNA2)的转录调控激活因子被发现的[4],与过敏[1]、乳腺癌[6]、肝癌[7]等多种临床疾病密切相关。研究证实,人类SND1蛋白(NP_055205.2)由N端4个重复葡萄球菌核酸酶样(Staphylococcal nucleases-like,SN-like)的SN(1~4)结构域及C端的SN5a-Tudor-SN5b(TSN)结构域组成,其中SN结构域主要参与细胞应激、基因转录等过程,而TSN结构域则主要参与premRNA的剪切过程[1-3]。目前从SND1基因多样性角度分析SND1蛋白的多功能性较受学者关注。如斑马鱼SND1基因被报道存在两个选择性剪接异构体SND1L和SND1S,其中SND1L占多数,即为SND1基因全长;SND1S则仅含SN1~3和部分SN4基因[8]。人类SND1 mRNA基因(NM_04390.2)5′端有两个AUG,两者之间相差75个bp,理论上分别以第1、2 个AUG为起始密码子所翻译的SND1-No1和SND1-No2蛋白的相对分子质量相差25个氨基酸。然而,最初人们对于SND1基因的研究多始于第2个AUG,随着研究的深入,第1个AUG才被确认[1-5]。SND1基因的两个AUG是否具有一定的生物学意义尚不明确。本实验中笔者以pCMV-N-Flag载体为基础,分别针对人类SND1基因的两个AUG设计引物,构建pCMV-N-Flag-SND1-No1/2重组质粒,后者可在真核细胞中特异表达N端携带有Flag标签的SND1-No1/2蛋白。
本研究针对SND1基因的第2个AUG构建了pERFP-SND1重组质粒,转染入HeLa细胞后成功表达红色荧光蛋白标记的SND1蛋白;当给予细胞0.5 mmol/L亚砷酸盐氧化应激处理后,SND1蛋白可在胞浆中形成“应激颗粒”[3]。“应激颗粒”是在细胞受到氧化应激、热休克、紫外线照射、渗透压休克和病毒感染等各种刺激时在胞浆中产生的颗粒状结构,是细胞的一种重要保护机制,与多种临床疾病相关[9]。本实验即是从“细胞应激”角度探讨第1个AUG是否在SND1蛋白应激颗粒形成中发挥作用。结果表明以2 个AUG为起始密码子所翻译的Flag-SND1-No1和Flag-SND1-No2蛋白均可介导细胞SND1应激颗粒的形成,说明第1个AUG在SND1应激颗粒形成中的作用是冗余的。
虽然笔者针对SND1基因的2个AUG也进行了“Kozak规则”的初步分析,并没有发现两者明显的差异,但仍然无法排除两个AUG在SND1基因转录调控或选择性剪接中发挥作用的可能性,这需要更多的实验证据。本实验所构建的pCMV-N-Flag-SND1-No1/2真核重组质粒有助于今后进行此方面的探索。
[1]Valineva T,Yang J,Palovuor IR,et al.The transcriptional co-activator protein p100 recruits histone acetyl transferase activity to STAT6 and mediates interaction between the CREB-binding protein and STAT6[J].J Biol Chem,2005,280(15):14989-14996.doi: 10.1074/jbc.M410465200.
[2]Gao X,Zhao X,Zhu Y,et al.Tudor staphylococcal nuclease(Tudor-SN)articipates in small ribonucleoprotein(snRNP)assembly viainteracting with symmetrically dimethylated Sm proteins[J].J Biol Chem,2012,287(22):18130-18141.doi:10.1074/jbc.M111.311852.
[3]Gao X,Ge L,Shao J,et al.Tudor-SN interacts with and co-localizes with G3BP in stress granules under stress conditions[J].FEBS Lett,2010,584(16):3525-3532.doi:10.1016/j.febslet.2010.07.022.
[4]Tong X,Drapkin R,Yalamanchili R,et al.The Epstein-Barr virus nuclear protein 2 acidic domain forms a complex with a novel cellular coactivator that can interact with TFIIE[J].Mol Cell Biol,1995, 15(9):4735-4744.
[5]Abe S,Wang PL,Takahashi F,et al.Structural analysis of cDNAs coding for 4SNc-Tudor domain protein from fish and their expression in yellowtail organs[J].Mar Biotechnol(NY),2005,7(6):677-686.doi:10.1007/s10126-004-5137-z.
[6]Blanco MA,Aleckovic M,Hua Y,et al.Identification of Staphylococcal Nuclease Domain-containing 1(SND1)as a Metadherin-interacting Protein with Metastasis-promoting Functions[J].J Biol Chem,2011,286(22):19982-19992.doi:10.1074/jbc.M111.240077.
[7]Santhekadur PK,Das SK,Gredler R,et al.Multifunction protein staphylococcal nuclease domain containing 1(SND1)promotes tumor angiogenesis in human hepatocellular carcinoma through novel pathway that involves nuclear factor κB and miR-221[J].J Biol Chem,2012,287(17):13952-13958.doi:10.1074/jbc.M111.321646.
[8]Zhao CT,Shi KH,Su Y,et al.Two variants of zebrafish p100 are expressed during embryogenesis and regulated by Nodal signaling[J]. FEBS Lett,2003,543(1-3):190-195.doi:10.1016/S0014-5793(03) 00445-9.
[9]Anderson P,Kedersha N.Stress granules:the Tao of RNA triage[J]. Trends Biochem Sci,2008,33(3):141-150.doi:10.1016/j.tibs.2007. 12.003.
(2014-02-11收稿2014-03-19修回)
(本文编辑魏杰)
Analysis of Cellular Stress Response in Two AUG of Human SND1 Gene
GAO Xingjie1,HE Jinyan2,GE Lin2,ZHANG Yi3,FU Xue1,YIN Jie1,ZHANG Wei2,SHI Xuebin2,SU Zheng2, YAO Zhi2,YANG Jie1,2
1Research Center of Basic Medical Science,2 Basic Medical Collgee,3 College of Pharmacy,Tianjin Medical University, Tianjin 300070,China
YANG Jie,E-mail:yangj@tijmu.edu.cn
ObjectiveTo construct eukaryotic Flag(DYKDDDDK)expressing recombinant plasmids,pCMV-NFlag-SND1-No1/2,which contain the coding sequence of human SND1-No1(from 1stAUG)or SND1-No2(from 2ndAUG), and perform the cellular localization analysis of Flag-tagged SND1-No1/2 under stress condition to study the function of the two AUG in the SND1 containing stress granules formation.MethodsThe gene fragments of SND1-No1/2 were amplified by PCR from the whole SND1 transcript and inserted into pCMV-N-Flag expressing vector through BamHI/EcoRI double enzyme digestion and T4 DNA Ligase connection.The recombinant pCMV-N-Flag-SND1-No1/2 plasmids were transfected into HeLa cells and the expression of Flag-SND1-No1/2 fusion proteins was examined by Western blotting assay.Immunofluorescence assay was performed to detect the co-localization of Flag-SND1-No1/2 with endogenous SND1 granule.ResultsThe pCMV-N-Flag-SND1-No1/2 were sequenced and digested correctly by restriction single/double enzyme.The Flagtagged SND1-No1/2 fusion proteins were also detected in transfected HeLa cell by Western blotting assay.Both of them showed the co-localization with endogenous SND1 granule.ConclusionThe recombinant eukaryotic plasmids of pCMV-N-Flag-SND1-No1/2 were constructed successfully and expressed effectively.The depletion of 1stAUG failed to affect the formation of SND1 containing stress granules.
recombinant fusion proteins;stress;plasmids;gene expression;SND1;AUG;stress granules
Q784,Q513
A
10.3969/j.issn.0253-9896.2014.07.001
国家自然科学基金资助项目(31100967,31170830, 31370749,21305103);国家杰出青年基金项目(31125012)
1天津医科大学基础医学研究中心(邮编300070),2基础医学院,3药学院
△通讯作者E-mail:yangj@tijmu.edu.cn

