自噬抑制剂对乙醇诱导的肝星状细胞活化作用的影响
何月贾宝辉刘曼罗文张吉翔△
自噬抑制剂对乙醇诱导的肝星状细胞活化作用的影响
何月1贾宝辉1刘曼2罗文2张吉翔2△
目的观察自噬抑制剂3-甲基腺嘌呤(3-MA)对乙醇诱导的肝星状细胞(HSC)活化作用,并探讨其作用机制。方法体外培养大鼠肝星状细胞株HSC-T6,设立空白对照组、阳性对照组(乙醇刺激组)、低剂量组(5 mmol/L 3-MA+100 mmol/L乙醇)、高剂量组(10 mmol/L 3-MA+100 mmol/L乙醇)。RT-PCR分析各组HSC活化标志蛋白α-平滑肌肌动蛋白(α-SMA)及Ⅰ型胶原基因表达,Western blot法检测各组HSC中自噬水平标志蛋白LC3Ⅱ、α-SMA、Ⅰ型胶原表达;MTT法检测3-MA对乙醇诱导的HSC增殖的影响。结果与空白对照组比较,阳性对照组中α-SMA、Ⅰ型胶原mRNA和蛋白表达及LC3Ⅱ表达量明显增加(P<0.05),高剂量组却显著减少(P<0.01);与阳性对照组比较,低剂量组和高剂量组中α-SMA、Ⅰ型胶原mRNA和蛋白表达及LC3Ⅱ表达量逐渐减少(P<0.05);与低剂量组比较,高剂量组中α-SMA、Ⅰ型胶原mRNA和蛋白表达及LC3Ⅱ表达减少(P<0.05)。与阳性对照组比较,加入3-MA处理后的HSC增殖显著减少(P<0.05)。结论3-MA可抑制乙醇诱导的HSC-T6细胞中LC3Ⅱ蛋白的表达、α-SMA、Ⅰ型胶原mRNA及蛋白的表达,抑制HSC增殖,且高剂量的作用更明显。
自噬;乙醇;肝硬化,酒精性;3-甲基腺嘌呤;肌动蛋白类;胶原Ⅰ型;肝星状细胞
酒精性肝纤维化(alcoholic liver fibrosis,ALF)是长期过量饮酒导致的一种慢性肝脏疾病,最初表现为酒精性脂肪肝,进而发展为酒精性肝炎、肝纤维化乃至肝硬化[1]。ALF是肝癌死亡的主要原因之一,是多基因、多阶段、多途径的复杂过程,然而至今仍缺乏早期、有效的治疗措施,故探讨ALF的发病机制及治疗靶点尤为重要。自噬(autophagy)是指从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新,在细胞生长发育、蛋白质代谢平衡及细胞内环境稳态的维持等过程中发挥着重要的调控作用[2]。在肝纤维化发生过程中,各种致病因素刺激下HSC活化,细胞内储存的脂滴消失后,表型向肌纤维母细胞转化,表达其活化标志蛋白α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)并大量分泌以I型胶原蛋白为主要成分的细胞外基质并最终导致肝内基质沉积。目前关于自噬的研究多集中于炎症、肿瘤、神经退行性疾病等领域[3],而自噬在乙醇诱导的肝星状细胞活化进而发生肝纤维化中的作用研究甚少。本实验使用不同剂量的自噬抑制剂3-甲基腺嘌呤(3-MA)作用于乙醇刺激后的肝星状细胞(HSC),观察其HSC活化水平,并探讨其作用机制。
1 材料与方法
1.1 材料大鼠肝星状细胞系HSC-T6购自湘雅细胞库,3-MA购自Sigma公司,培养基DMEM购自HyClone公司。胰蛋白酶、胎牛血清、四甲基偶氮唑蓝(MTT)购自Solarbio公司。TRIzol、DMSO购自北京全式金生物技术公司。逆转录试剂盒购自TaKaRa公司。引物由上海生工生物工程公司合成。2×PCR MasterMix购自北京全式金生物技术公司。总蛋白提取试剂盒购自北京普利莱基因技术有限公司。兔抗LC3多克隆抗体、兔抗SMA多克隆抗体、兔抗COL1A2多克隆抗体、小鼠抗β-肌动蛋白(actin)单克隆抗体(mAb)购自Proteintech公司,辣根过氧化物酶标记的山羊抗兔二抗及山羊抗小鼠二抗购自北京中杉金桥公司。
1.2 方法
1.2.1 3-MA储存液的配制3-MA粉末按100 mmol/L溶解在1×无菌PBS溶液中,-20℃避光保存。使用时用含有100 mL/L胎牛血清的DMEM培养液稀释至所需浓度。
1.2.2HSC-T6培养HSC-T6复苏后置于含10%胎牛血清、双抗(100 U/mL的青霉素和100 mg/L的链霉素)的高糖DMEM培养基的培养瓶中,37℃、饱和空气湿度和5%的CO2孵箱内培养。设定4个不同处理组,分别为空白对照组、阳性对照组(乙醇刺激组)、低剂量组(5 mmol/L 3-MA+100 mmol/L乙醇)、高剂量组(10 mmol/L 3-MA+100 mmol/L乙醇)。
1.2.3RT-PCR检测3-MA对乙醇诱导后的HSC中α-SMA、Ⅰ型胶原蛋白mRNA表达的影响采用Trizol提取RNA,合成cDNA后PCR扩增目的基因,同一样本以β-actin为内参。根据GenBank上公布的大鼠的α-SMA、Ⅰ型胶原mRNA序列,应用Primer Primier 5软件设计引物。引物序列:α-SMA引物上游5′-GAAGCTGCTCCAGCTATGTGT-3′,下游5′-CAACCATCACTCCCTGG-3′,126 bp;Ⅰ型胶原引物上游5′-GATGGACTCAACGGTCTCCC-3′,下游5′-CGGCCACCATCTTGAGACTT-3′,185 bp;β-actin引物上游5′-CACCCGCGAGTACAACCTTC-3′,下游5′-CCCATACCCACCATCACACC-3′,221 bp。α-SMA和β-actin的反应条件:94℃预变性5 min,94℃变性35 s,退火35 s(α-SMA、β-actin为60℃,Ⅰ型胶原蛋白为62℃),72℃延伸35 s,35个循环;最后72℃7 min。取5 μL PCR产物进行1.5%琼脂糖凝胶电泳,用暗箱式紫外透射仪观察电泳结果并拍照。结果用BANDLEAD 3.00软件,以目的条带/β-actin的光密度(OD)值进行分析。实验均重复3次。
1.2.4Western blot法检测3-MA对乙醇诱导后的HSC中α-SMA、Ⅰ型胶原蛋白、LC-3Ⅱ蛋白表达的影响采用蛋白抽提液分别提取各组细胞的总蛋白,全自动生化分析仪(Beckman,USA)测定蛋白浓度。取20~40 μg细胞总蛋白经5×上样缓冲液和30 g/L SDS配平蛋白至同体积后进行100 g/L SDS-PAGE,转移至PVDF膜上。以50 g/L脱脂奶粉4℃封闭过夜,分别与兔抗LC3多克隆抗体(1∶800)、兔抗SMA多克隆抗体(1∶800)、兔抗COL1A2多克隆抗体(1∶800)、小鼠抗β-actin单克隆抗体(1∶1 000)孵育过夜,洗涤后分别加入辣根过氧化物酶标记的山羊抗兔二抗或山羊抗小鼠二抗,加入底物化学发光试剂后X线片曝光,曝光显影的目的条带用Quatity one 4.62软件进行半定量分析,以内参为参考标准计算出目的条带标准化后的OD值,以此判断蛋白相对表达量。每次检查均采用不同样本重复3次。
1.2.5MTT法检测HSC增殖水平收集对数期细胞,调整细胞悬液浓度,每孔加入200 U,铺板使细胞密度为1×104/孔浓度接种于96孔板中,空白调零孔只加不含细胞的培养基。实验处理后,每孔加入5 g/L MTT溶液20 μL,继续培养4 h后弃上清,加入150 μL DMSO,避光振荡15 min,酶标仪测定492 nm处各孔OD值,计算各组的平均值。每组6复孔,计算各组的平均值。
1.3 统计学方法应用SPSS 13.0进行统计分析,数据采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3-MA抑制乙醇诱导的HSC中α-SMA和Ⅰ型胶原mRNA表达与空白对照组比较,阳性对照组中α-SMA、Ⅰ型胶原的mRNA表达明显增加,高剂量组表达明显减少;与阳性对照组比较,低剂量组、高剂量组表达减少;与低剂量组比较,高剂量组表达明显减少,见表1。
2.2 3-MA抑制乙醇诱导的HSC中α-SMA、Ⅰ型胶原和LC3Ⅱ蛋白表达与空白对照组比较,阳性对照组中α-SMA、Ⅰ型胶原、LC3Ⅱ的蛋白表达明显增加,高剂量组表达明显减少;与阳性对照组比较,低剂量组、高剂量组表达减少;与低剂量组比较,高剂量组表达明显减少,见表2、图1。
2.3 细胞增殖活力的变化与空白对照组比较,阳性对照组中细胞增殖活力明显增加,高剂量组明显减少;与阳性对照组比较,低剂量组、高剂量组减少;与低剂量组组比较,高剂量组明显减少,见表2。
Tab.1 Comparison of differential expressions of α-SMA mRNA and typeⅠcollagen mRNA in HSC between four groups表1 各组HSC中α-SMA,Ⅰ型胶原的mRNA表达量的比较(n=3,±s)
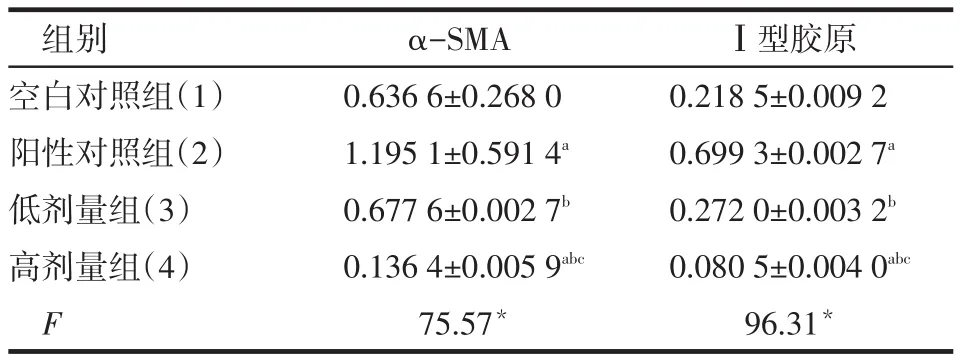
Tab.1 Comparison of differential expressions of α-SMA mRNA and typeⅠcollagen mRNA in HSC between four groups表1 各组HSC中α-SMA,Ⅰ型胶原的mRNA表达量的比较(n=3,±s)
*P<0.05;a与(1)组比较,b与(2)组比较,c与(3)组比较,P<0.05;表2同
?
Tab.2 Comparison of differential expressions of α-SMA,typeⅠcollagen and LC3 proteins,and OD value in HSC between four groups表2 各组HSC中α-SMA、Ⅰ型胶原和LC3的蛋白表达量及OD值的比较(n=3,±s)

Tab.2 Comparison of differential expressions of α-SMA,typeⅠcollagen and LC3 proteins,and OD value in HSC between four groups表2 各组HSC中α-SMA、Ⅰ型胶原和LC3的蛋白表达量及OD值的比较(n=3,±s)
组别空白对照组(1)阳性对照组(2)低剂量组(3)高剂量组(4)F α-SMA 1.507 1±0.298 2 2.339 7±0.177 2a1.612 3±0.200 3b0.687 2±0.218 8abc89.71*Ⅰ型胶原0.184 1±0.144 5 0.675 5±0.243 5a0.153 5±0.298 1b0.090 5±0.251 9abc93.93*组别空白对照组(1)阳性对照组(2)低剂量组(3)高剂量组(4)F LC3Ⅱ1.107 6±0.173 3 1.702 7±0.234 1a0.896 1±0.107 6b0.521 6±0.274 8abc79.07*细胞增殖活力(OD)0.62±0.08 2.24±0.12a1.42±0.36b0.25±0.09abc103.76*
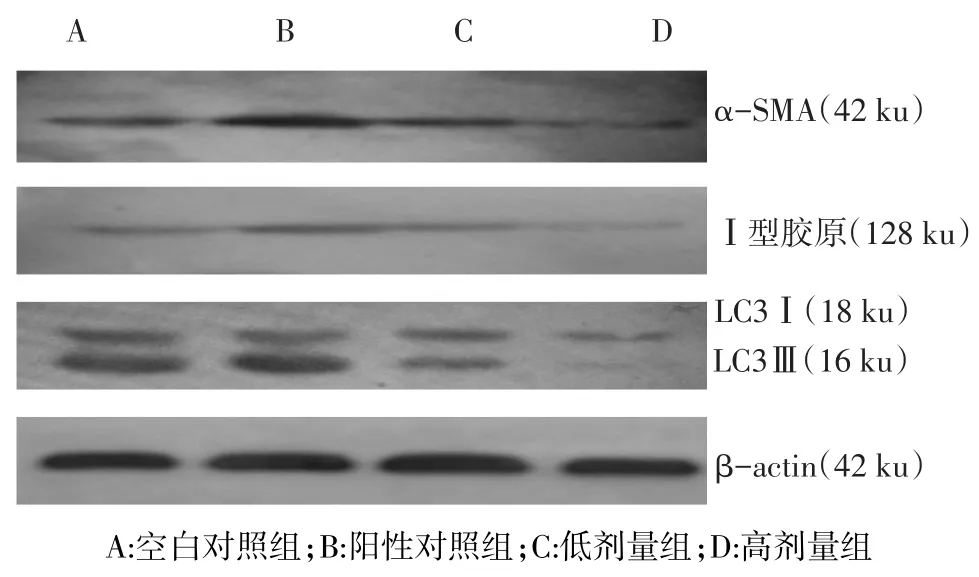
Fig.1 The expression of α-SMA,typeⅠcollagen and LC3Ⅱat the protein level图1 α-SMA、Ⅰ型胶原和LC3Ⅱ蛋白的表达
3 讨论
肝纤维化是酒精性肝病发病过程中的转折点,如能及时去除导致肝纤维化的不利因素则有可能中止肝纤维化的进程,甚至使病变向良性方面转归。一旦发展成肝硬化,病变则不可逆转[4]。酒精性肝纤维化是多因素疾病,在肝纤维化发展过程中,乙醇代谢相关的氧化应激,谷胱甘肽耗竭,蛋氨酸代谢异常,营养不良,Kupffer细胞激活所致的大量炎性细胞因子释放,肝星状细胞激活,免疫反应及遗传多态性等诸多因素均起到重要作用[5]。研究认为,HSC的增殖和激活是各类慢性肝病包括酒精性肝病发生肝纤维化的中心环节[6]。
当细胞处于缺氧、能量代谢异常时,常常通过自噬提高其自噬水平来维持细胞内能量代谢供给[7]。Thoen等[8]研究发现,HSCs活化过程中伴有其自噬水平的升高,若抑制HSCs自噬将显著抑制其活化。Hernández-Gea等[9]发现自噬作为细胞内大分子物质及细胞器,参与自我更新及能量代谢的重要生物学过程,在促进HSC中能量代谢并维持HSC活化状态中发挥了重要作用。刘曼等[10]研究证实3-MA能影响HSC增殖活化,然而,乙醇刺激HSC后,HSC的活化水平如何,自噬水平是否会发生改变仍然未知。因此若能有效控制乙醇诱导的肝纤维化的发生,将为治疗酒精性肝硬化发生带来的新希望。
本研究所用的HSC-T6,系SV40转染SD大鼠HSC而成,具有活化HSC的表型,能表达高水平的Ⅰ型胶原蛋白mRNA等,能检测出自噬标志性蛋白LC3Ⅱ的表达,表明HSC-T6本身有一定的自噬水平。加入乙醇刺激后,自噬标志性蛋白LC3Ⅱ的表达增加,表明乙醇刺激HSC-T6后能增加其自噬水平。3-MA是自噬调控信号通路Ⅲ型PI3K(hVps34)抑制剂,能抑制胞质型LC3Ⅰ向自噬体膜蛋白LC3Ⅱ的转化,从而抑制自噬水平[11]。本研究结果发现,3-MA作用HSC-T6后,自噬水平随着剂量的增加而下降,而α-SMA、Ⅰ型胶原的mRNA及蛋白的表达量亦随自噬水平的降低而相应的减少。这表明HSC自噬水平在维持其活化状态中起到重要作用。为了明确自噬抑制剂对乙醇诱导的HSC的增殖情况,本实验采用了MTT法检测不同剂量的自噬抑制剂对乙醇诱导的HSC增殖水平,结果表明,3-MA能显著抑制HSC的增殖,并随着浓度的升高,其抑制效应越强。
然而,自噬抑制剂对乙醇诱导的HSC活化的抑制作用是通过何种途径实现仍不明确。有研究表明,乙醇所致氧化应激是激活HSC的重要因素,过度摄入的乙醇及其代谢产物是引起肝脏内氧化应激的主要介质[12],这些代谢产物可以直接攻击HSC促其活化,也能通过诱导转化生长因子(TGF)-β、p38、NF-κB、JNK等信号通路和AP-1、MAPK等炎症信号通路激活HSC细胞[13-14]。
Komatsu等[15]发现,自噬基因atg7敲除后小鼠自噬水平显著下降,并伴有P62大量积聚,P62可进一步同Nrf2竞争性结合Keap1,促使Nrf2与Keap1解偶联并发生核转位,激活Nrf2下游抗氧化反应元件ARE调控的抗氧化基因转录,从而保护细胞免受氧化应激损伤。即抑制自噬可通过上调P62水平发挥对Nrf2-keap1-ARE信号通路的活化作用来降低乙醇诱导的氧化应激水平。
[1]Lewis DF,Ioannides C,Parke DV.Cytochromes P450 and species differences in xenobiotic metabolism and activation of carcinogen [J].Environ Health Perspect,1998,106(10):633-641.
[2]Huang WP,Klionsky DJ.Autophagy in yeast:a review of the molecular machinery[J].Cell Struct Funct,2002,27(6):409-420.
[3]Dey S,Tameire F,Koumenis C.PERK-ing up autophagy during MYC-induced tumorigenesis[J].Autophagy,2013,9(4):612-614. doi:10.4161/auto.23486.
[4]Barbero-Becerra VJ,López-Velázquez JA,Sánchez-Valle V,et al. Alcohol effects on liver diseases:good or bad buddy[J]?Ann Hepatol,2012,11(6):944-948.
[5]Lieber CS.Alcoholic fatty liver:its pathogenesis and mechanism of progression to inflammation and fibrosis[J].Alcohol,2004,34(1):9-19.
[6]Zhao Q,Qin CY,Zhao ZH,et al.Epigenetic modifications in hepatic stellate cells contribute to liver fibrosis[J].Tohoku J Exp Med, 2013,229(1):35-43.
[7]Christian P,Sacco J,Adeli K.Autophagy:Emerging roles in lipid homeostasis and metabolic control[J].Biochim Biophys Aeta,2012, 1831(4):819-824.doi:10.1016/j.bbalip.2012.12.009.
[8]Thoen LF,Guimarães EL,Dollé L,et al.A role for autophagy during hepatic stellate cell activation[J].J Hepatol,2011,55(6):1353-1360.doi:10.1016/j.jhep.2011.07.010.
[9]Hernández-Gea V,Ghiassi-Nejad Z,Rozenfeld R,et al.Autophagy releases lipid that promotes fibrogenesis by activated hepatic stellate cells in mice and in human tissues[J].Gastroenterology,2012, 142(4):938-946.doi:10.1053/j.gastro.2011.12.044.
[10]刘曼,何月,张吉翔.自噬抑制剂3-甲基腺嘌呤对肝星状细胞增殖活化的影响[J].细胞与分子免疫学杂志,2013,29(08):809-817.
[11]Li J,Hou N,Faried A,et al.Inhibition of autophagy by 3-MA enhances the effect of 5-FU-induced apoptosis in colon cancer cells [J].Ann Surg Oncol,2009,16(3):761-771.doi:10.1245/s10434-008-0260-0.
[12]Cederbaum AI.Alcohol metabolism[J].Clin Liver Dis,2012,16(4): 667-685.doi:10.1016/j.cld.2012.08.002.
[13]Szuster-Ciesielska A,Mizerska-Dudka M,Daniluk J,et al.Butein inhibits ethanol-induced activation of liver stellate cells through TGF-β,NFκB,p38,and JNK signaling pathways and inhibition of oxidative stress[J].J Gastroenterol,2013,48(2):222-237.doi:10. 1007/s00535-012-0619-7.
[14]Wang JH,Batey RG,George J.Role of ethanol in the regulation of hepatic stellate cell function[J].World J Gastroenterol,2006,12(43): 6926-6932.
[15]Komatsu M,Kurokawa H,Waguri S,et al.The selective autophagy substrate P62 activates the stress responsive transcription factor Nrf2 through inactivation of Keap1[J].Nat Cell Biol,2010,12(3): 213-223.doi:10.1038/ncb2021.
(2013-11-05收稿2014-03-07修回)
(本文编辑魏杰)
The Effects of Autophagy Inhibitor on Activation of Alcohol induced Hepatic Stellate Cells
HE Yue1,JIA Baohui1,LIU Man2,LUO Wen2,ZHANG Jixiang2
1Department of Intensive Care Unit,The Fourth Affiliated Hospital,Nanchang University,Nanchang 330003,China;2Department of Gastroenterology,The Second Affiliated Hospital,Jiangxi Province Key Laboratory of Molecular Medicine, Nachang University
ZHANG Jixiang,E-mail:jixiangz@tom.com
ObjectiveTo observe the effect of autophagy inhibitor on the activation of alcohol induced hepatic stellate cells,and the mechanisms thereof.MethodsHSC-T6 cells were cultured in vitro and divided into four groups,including blank control group,alcohol group,5 mmol/L 3-MA+alcohol group(low alcohol group)and 10 mmol/L 3-MA+alcohol group(high alcohol group).RT-PCR was used to detect the expression levels of α-smooth muscle actin(α-SMA)and typeⅠcollagen.The levels of LC3Ⅱ,α-SMA and typeⅠcollagen were detected by Western blot assay.The cell viability of HSCT6 was detected by MTT assay.ResultsThe mRNA expressions of α-SMA,typeⅠcollagen and the protein of expressions α-SMA,typeⅠcollagen and LC3Ⅱwere significantly up-regulated in alcohol group compared with those of control group (P<0.05),while the expressions of those parameters were significantly down-regulated in 10 mmol/L 3-MA+alcohol group (P<0.01).The mRNA and protein levels of α-SMA and typeⅠcollagen were significantly decreased in two 3-MA-treated groups compared with those in alcohol group(P<0.05).Meanwhile,compared with the 5 mmol/L 3-MA+alcohol group,the protein expressions of α-SMA,typeⅠcollagen and LC3Ⅱwere significantly decreased in10 mmol/L 3-MA+alcohol group (P<0.05).Compared with the alcohol group,there was significantly lower proliferation activity in all two 3-MA-treated groups(P<0.05).Conclusion3-MA can inhibit the protein expression of LC3Ⅱ,α-SMA and typeⅠcollagen induced by alcohol in HSC-T6 cells,and inhibit the proliferation of HSC cells.
autophagy;ethanol;liver cirrhosis,alcoholic;3-methyladenine;actins;collagen typeⅠ;hepatic stellate cells
R575,R34
A
10.3969/j.issn.0253-9896.2014.07.002
国家自然科学基金资助项目(30360037)
1南昌大学第四附属医院重症医学科(邮编330003);2南昌大学第二附属医院消化科、江西省分子医学重点实验室
△通讯作者E-mail:jixiangz@tom.com

