亚甲基蓝测定微量肝素钠的研究
亓培培
(淮北市环保局 环境检测站,安徽 淮北 235000)
肝素(Hep)为葡糖胺聚糖,是蛋白多糖的一种.在人体内由肥大细胞分泌而自然存在于血液中,在体内外均有延缓或阻止血液凝固的作用[1].作为经典的抗凝血药物,肝素在临床上的应用已达60年之久,目前仍是心血管和血栓病人的首选抗凝血药[2].
肝素是由葡萄糖胺磺酸、葡萄糖醛酸、艾杜糖醛酸组成的,具有不同链长的多糖链混合物.在水溶液中由于其酸性基团的离解而成为带多个负电荷的大阴离子.肝素的检测方法有多种,总的分属于生物方法[3]和化学方法两大类.生物方法是法定方法,因受生物个体的影响较大,不易掌握.化学方法有分光光度法[4-8]、HPLC法[9]、毛细管电泳法[10]、电化学传感器[11]等.其中分光光度法因具有操作简便、快速、仪器价廉、灵敏度较高的优点而得到广泛的应用.因此进一步研究灵敏度高、选择性好的新分光光度法有重要的意义.实验结果发现,在pH为1.4~5.8的缓冲溶液中肝素钠能与亚甲基蓝发生缔合,使溶液出现明显的褪色,溶液吸光度的减少与肝素钠浓度成正比,建立了测定肝素钠浓度的分光光度法.该方法稳定性好,而且反应的pH值范围宽.用于注射用肝素钠浓度的测定结果满意.
1 实验部分
1.1 试剂和仪器
TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);pHs-3型酸度计(上海第二分析仪器厂).
肝素钠标准溶液:准确称取1.000 g肝素钠固体(中国医药集团上海化学试剂公司),用去离子水溶解稀释,定容于1 000 mL容量瓶中,其质量浓度为1.00 mg/ mL,备用.再准确量取5.00 mL 上述标准溶液,用去离子水稀释,定容于1 000 mL 容量瓶中,制得5.00 mg/L 的标准溶液.亚甲基蓝溶液:浓度为5.0×10-4mol/L作为储备液,再稀释成2.0×10-5mol/L使用.
乙酸-乙酸钠缓冲溶液:准确称取2.736 g乙酸钠,量取3 mL 36.5%的乙酸溶液用去离子水稀释定容于100 mL容量瓶中,备用.根据体积比配成pH 4.6的缓冲溶液或用酸度计调制成pH 4.6的缓冲溶液.
上述所需试剂均为分析纯或优级纯,配制溶液用去离子水.
1.2 实验方法
在25 mL的比色管中依次加入pH为4.6的乙酸-乙酸钠缓冲溶液2.0 mL,亚甲基蓝溶液1.0 mL和肝素钠标准溶液10.0 mL,稀释至刻度,摇匀,放置10 min 后,以水为参比,测定664 nm 处样品溶液吸光度A;同时做试剂空白,吸光度值为A0,并计算吸光度差值ΔA=A0-A.
2 结果和讨论
2.1 吸收光谱
分别对未加肝素钠的1.0 mL 亚甲基蓝标准溶液和加入20 μg、40 μg、60 μg、80 μg 肝素钠的亚甲基蓝标准溶液在200~800 nm的波长范围内进行扫描所得的吸收光谱如图1所示.亚甲基蓝溶液在664 nm处的吸收峰出现最大值,加入肝素钠后,肝素钠与亚甲基蓝作用使溶液褪色,不加肝素钠和加入肝素钠所测得的吸光度之差ΔA在一定范围内与肝素钠含量呈线性关系.
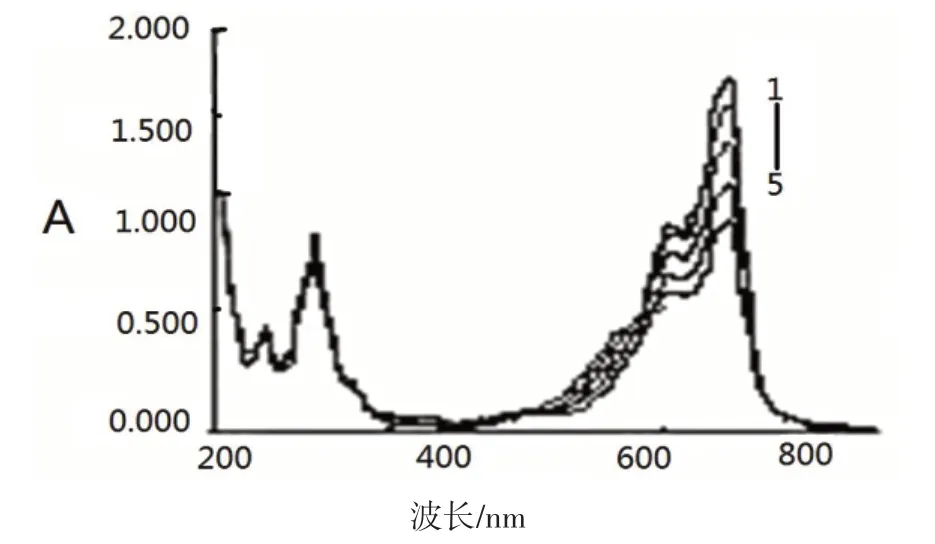
图1 吸收光谱(1-5肝钠素浓度)
2.2 缓冲溶液pH对体系的影响
按实验方法改变缓冲溶液的pH 进行实验,结果见表1.由表1可知,在缓冲溶液的pH维持在4.6时肝素钠和亚甲基蓝的吸收强度下降显著,所以本实验选用pH为4.6的缓冲溶液.

表1 缓冲溶液pH对体系的影响
2.3 缓冲溶液用量对体系的影响
按实验方法改变缓冲溶液的用量进行实验,结果如图2所示.由图2可知,在缓冲溶液用量为2.0 mL时肝素钠和亚甲基蓝的吸收强度下降显著,所以本实验选用pH值为4.6的缓冲溶液最佳用量为2.0 mL.

图2 缓冲溶液的用量/(V/mL)
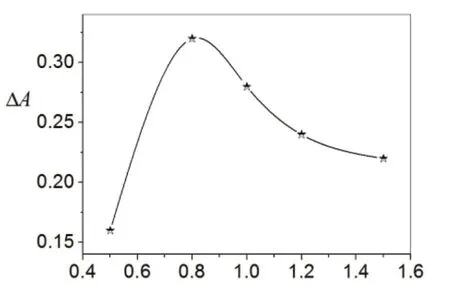
图3 亚甲基蓝的用量/(V/mL)
2.4 亚甲基兰用量对体系的影响
按实验方法改变亚甲基蓝的用量进行实验,结果如图3.由图3可知,在2×10-5mol/L亚甲基蓝用量为0.80 mL时的吸收强度下降最大,因此亚甲基蓝最佳用量可以选择为0.80 mL.
2.5 试剂加入顺序的影响
实验过程中,考察了3 种试剂加入顺序对体系的影响.实验结果表明,试剂加入顺序对体系没有影响.
2.6 反应时间的影响
在最佳实验条件下反应时间的影响结果如图4所示.由图4可知,亚甲基蓝与肝素钠反应瞬间完成,且吸收强度在1 h内保持稳定;而空白溶液吸收强度基本保持稳定不变,5 min以后吸收强度逐渐减小,但减小程度变化缓慢,对实验产生的影响不大,选择放置5 min.
2.7 干扰实验
对多种可能共存物的干扰进行了实验.实验可知,当DNA的浓度大于11 μg/ mL时对肝素钠的测定产生干扰.RNA对肝素钠产生干扰的最大浓度为5 μg/ mL.
2.8 工作曲线
按照实验步骤在最佳条件下测吸光度绘制工作曲线(见图5),由图5可知,0~1.6 mg/L范围内有良好的线性关系.线性方程:ΔA=0.191 2c-0.002 9,相关系数r=0.996 4.检出限是 10 μg/25 mL,对于0.8 mg/L的肝素钠5次测定的相对标准偏差为0.8%,说明本法准确可行.尽管本法灵敏度不是太高,但有使用仪器较简单、药品易得且廉价,实验方法简便、快速、选择性较好等优点.
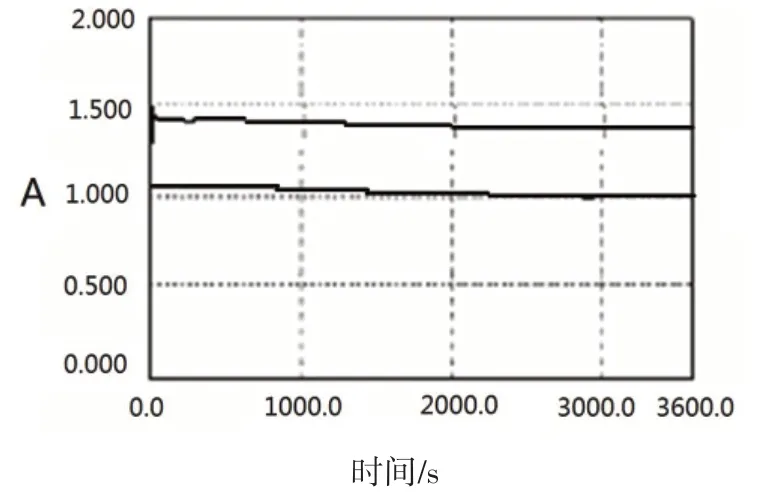
图4 时间扫描图
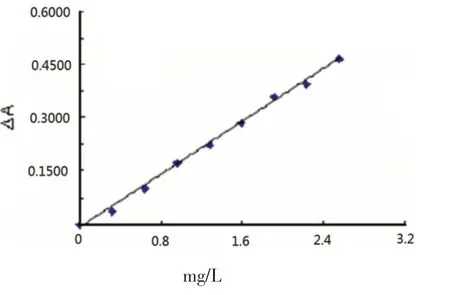
图5 标准曲线
2.9 合成样品的分析
配制了3个合成试样进行测定,结果见表2.
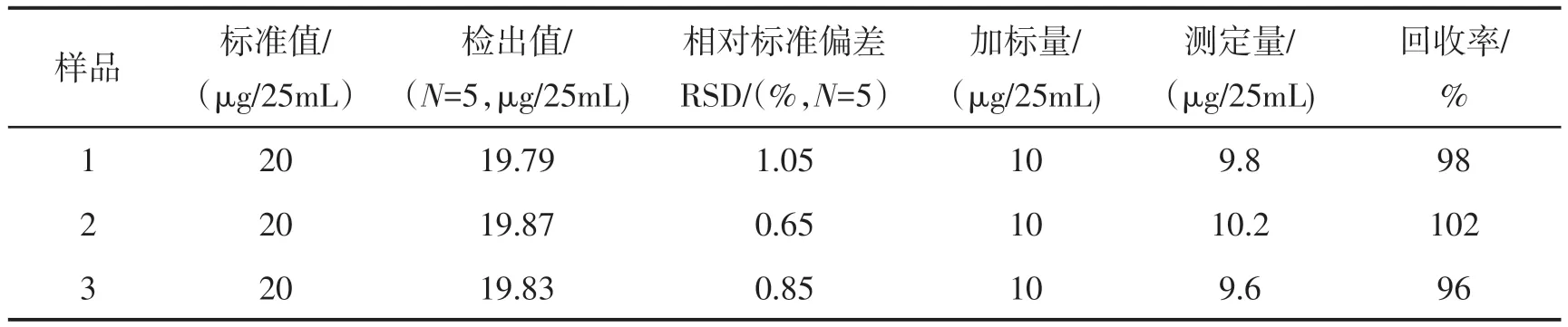
表2 合成样品的分析
[1]周自永.新编常用药手册[M].北京:金盾出版社,1987.
[2]姬胜利,张天民.肝素与低分子肝素的研究进展[J].中国生化药物杂志,1996,17(5):216-218.
[3]中华人民共和国卫生部药典委员会.中华人民共和国药典(第二部)[M].北京:化学工业出版社,1995:307.
[4]BAND P,LUKTON A.The specific assey of heparin by its chemical properties[J].Anal Biochem,1982,120(1):19-21.
[5]王云志,黄喜茹,侯海妮,等.用次甲基蓝测定肝素钠注射液的效价[J].河北医学院学报,1992,13(2):65-67.
[6]JIAO Q C,LIU Q,SUN C,et al.Investigation on the binging site in heparin by spectrophometry[J].Talanta,1999,48:1095-1101.
[7]JIAO Q C,LIU Q.Mechanism of interference and a zura response in the heparinassay[J].Analytical Letters,1998,31(8):1311-1323.
[8]NMCOVA I,RYCHLOVSKY P,HAVELCOVA M,et al.Determination of heparin using flow injection analysis with spectro⁃phometric detection[J].Anal Chm Acta,1999,401:223-228.
[9]毛平,黄晓兰,李翠贞,等.高效液相色谱法测定血浆肝素含量[J].中华医学检验杂志,1995,18(6):358-360.
[10]AMDOFO S A,WANG H M,LINHARDT R J.Disaccharide compositional analysis of heparin sulfate using capillary zone electrophoresis[J].Anal Biochem,1991,199(2):249-255.
[11]MA S H,YANG V C,MEYERHOFF M E.Heparin responsive electrochemical sensor:A preliminary study[J].Anal Chem,1992,64(6):694-697.

