荷斯坦奶牛干扰素tau 基因的克隆表达及生物活性分析
张 灿
(青岛农业大学动物科技学院,山东 青岛 266109)
Ⅰ型干扰素包括多个成员,具有抗病毒、抗细胞增殖和免疫调节的功能,并具有种属特异性。干扰素tau(IFN-tau)作为Ⅰ型干扰素的一种,与其他Ⅰ型干扰素具有共同的特性,但与其他Ⅰ型干扰素不同的是,IFN-tau仅在反刍动物妊娠发育初期的胚胎滋养层细胞中表达,是反刍动物妊娠识别信号,有抗黄体溶解的作用。Ⅰ型干扰素其他成员如IFN-α、IFN-β和IFN-ω 均需要诱导产生,而IFN-tau的产生无需诱导,但是其抗病毒活性较弱[1]。IFN-α、IFN-β均具有抗病毒活性,可用于抗病毒药物的开发,但是存在细胞毒性,而IFN-tau虽然抗病毒活性较弱,但是不会产生细胞毒性[2]。在Ⅰ型干扰素中,IFN-tau与IFN-ω 同源性最高(70%~75%),与IFN-α、IFN-β也有一定的同源性[3]。
Ⅰ型干扰素的抗病毒作用主要是通过阻断病毒复制完成的。据报道,羊的IFN-tau能够诱导干扰素刺激因子(ISG)如 STAT-1、STAT-2、β-微球蛋白、IRF-1、UCRP、MX-1以及 OAS的表达,从而达到抗病毒的目的[4]。Kang D 等[5]检测了牛IFN-tau诱导MDBK细胞产生的ISG,发现 MX-1和OAS表达量增高,而IRF-1的表达量没有变化。
本研究克隆了BoIFN-tau基因,使用原核表达系统表达重组蛋白,并检测其抗病毒活性以及诱导ISG表达的情况,以期为IFN-tau抗病毒产品的开发提供依据。
1 材料与方法
1.1 材料
荷斯坦奶牛外周血采自青岛奥特奶牛场。表达载体pET-30a(+)、大肠埃希菌BL21、牛肾细胞/水疱性口炎病毒(MDBK/VSV)由青农大预防兽医学实验室保存;pGEM T-easy,Promega公司产品;RT-PCR提取试剂盒、DNA 限制性 内切酶、T4 DNA连接酶、ExTaq DNA聚合酶、IFN-α标准品,宝生物工程(大连)有限公司产品;ProBondTM Purification System试剂盒,Invitrogen公司产品。
1.2 方法
1.2.1 编码BoIFN-tau基因的克隆 从荷斯坦奶牛外周血提取总RNA,根据GenBank中牛IFN-tau序列(GI:AY996048)设计引物,RT-PCR 扩 增BoIFN-tau基因,引物序列为:上游5′-ATG GCC TTC GTG CTC TCT ACT-3′;下游5′-TCA AAG TGA GTT CAG ATC TCC-3′,反应体系 25μL,Tm为57℃,30个循环。参照Promega公司pGEM T-easy载体使用说明书将扩增产物连接到pGEM T-easy载体上,构建重组质粒BoIFN-tau/T。对重组质粒进行酶切、PCR和测序鉴定。测序正确的BoIFN-tau序列用SignaI P3.0Server在线分析软件预测其信号肽序列长度。BoIFN-tau成熟肽序列与GenBank发表的序列进行同源性比对(大额牛:AY665674;亚洲水牛:AY535404;山羊:DQ154135;林麝:DQ139308;长颈鹿:U55050;牦牛:JH884172;绵羊:AY499657;美洲野牛:AY643747),DNASTAR软件进行进化分析。
1.2.2 BoIFN-tau基因原核表达载体的构建 以测序正确的BoIFN-tau/T质粒为模板,设计引物扩增BoIFN-tau成熟肽基因,引物序列如下:上游5′-CTA GAA TTC GGA CGA TCT CTG GGT TGT TAC-3′;下游5′-TTA CTC GAG AGT TAG CGA GAG TCA TCT CAA AG-3′,分别在5′和3′端引入EcoRⅠ和XhoⅠ酶切位点(划横线部分)。将扩增得到的编码成熟肽的序列插入载体pET-30a(+),构建重组质粒pET/BoIFN-tau,对重组质粒进行双酶切和PCR鉴定。
将 pET/BoIFN-tau 质粒转化到 E.coli BL21(DE3)中,在含100g/mL Amp的LB培养基中于30℃条件下培养至A 600为0.6,1mmol/L的IPTG诱导表达5h,取样1mL,离心收集菌体,进行SDSPAGE和Western blot分析。表达菌所用一抗为鼠抗His单克隆抗体,二抗为辣根过氧化物酶HRP标记的兔抗鼠IgG抗体。用ProBondTM Purification System试剂盒纯化诱导表达的重组蛋白BoIFN-tau。
1.2.3 重组蛋白BoIFN-tau抗病毒活性测定 采用细胞病变抑制法在牛肾细胞(MDBK)/VSV系统上测定重组蛋白BoIFN-tau的抗病毒活性,同时设立IFN-α标准品作为对照[6]。以能抑制50%细胞病变的BoIFN-tau最高稀释度为1单位。
1.2.4 BoIFN-tau刺激因子 Mx-1和 OAS表达量的检测 用6孔培养板培养MDBK细胞,在培养液中添加BoIFN-tau(250ng/mL),设置未诱导对照孔及IFN-α(5ng/mL)诱导对照孔。继续培养9h,离心收集细胞提取总RNA。RT-PCR扩增管家基因GAPDH(引物及反应参数见表1),根据电泳结果调整RNA模板量达到一致。参考Kang D等[5]发表的引物,扩增Mx-1和OAS基因(引物及反应参数见表1),分析比较Mx-1及OAS的表达量。

表1 BoIFN-tau刺激因子引物序列及PCR反应参数Table1 The BoIFN-tau stimulation factor primers and PCR reaction parameter
2 结果
2.1 BoIFN-tau基因的克隆及其同源性分析
重组质粒BoIFN-tau/T PCR鉴定和酶切鉴定结果显示获得了582bp的目的片段,测序结果表明获得了正确的基因序列。重组表达质粒pET/BoIFN-tau的PCR鉴定和双酶切鉴定显示目的片段大小为525bp,与预期结果相符(图1)。经SignaI P3.0Server在线分析软件预测,BoIFN-tau序列的1位~19位氨基酸组成信号肽,其余的174个氨基酸组成成熟肽。通过Blast分析不同反刍动物IFN-tau成熟肽序列同源性,用DNA Star进行系统演化分析,并绘制进化树(图2)。从图2可以看出,林麝的IFN-tau单独成一支,牦牛、荷斯坦奶牛、大额牛和亚洲水牛的组成一支,绵羊、山羊、美洲野牛和长颈鹿的组成一支。
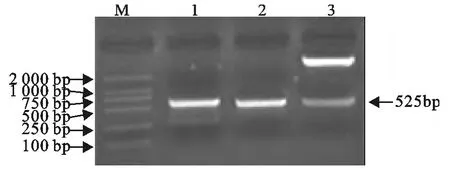
图1 重组质粒BoIFN-tau/T及pET/BoIFN-tau鉴定Fig.1 Identification of the recombinant plasmid BoIFN-tau/T and pET/BoIFN-tau
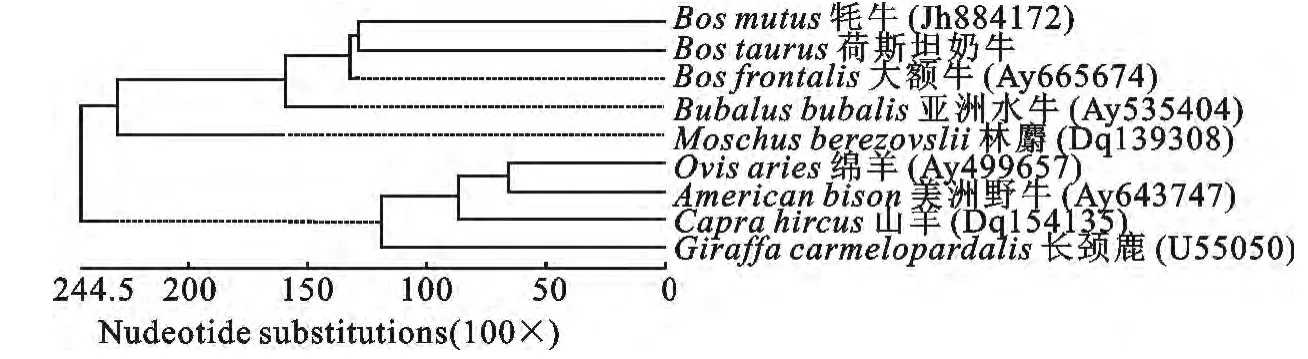
图2 BoIFN-tau成熟肽序列进化树分析Fig.2 Phylogenetic tree analysis of BoIFN-tau mature peptide sequence in Holstein cow
2.2 重组蛋白BoIFN-tau的表达、鉴定和纯化
用IPTG诱导重组蛋白BoIFN-tau在大肠埃希菌BL21中表达,SDS-PAGE与 Western blot分析结果显示,获得的目的蛋白条带占菌体总蛋白的30%左右,大多以不溶性包涵体形式存在,大小约为23ku,与预期结果一致 (图3)。纯化的目的蛋白浓度达0.57mg/mL。
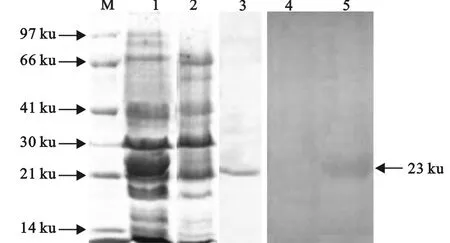
图3 重组BoIFN-tau蛋白的SDS-PAGE和Western blot检测Fig.3 SDS-PAGE and Western-blot of the recombinant BoIFN-tau protein
2.3 重组蛋白BoIFN-tau抗病毒活性测定
在MDBK/VSV细胞系上,采用细胞病变抑制法测定大肠埃希菌表达的BoIFN-tau蛋白抗病毒活性。BoIFN-tau活性为1.09×105IU/mL,IFN-α活性为6.49×105IU/mL。半定量PCR法检测IFN-tau诱导的Mx-1和OAS表达量(图4)。与未诱导对照比较,BoIFN-tau能够诱导 Mx-1和OAS的表达量显著升高;与IFN-α对照比较,Mx-1和OAS的表达量没有明显区别。

图4 半定量RT-PCR检测重组蛋白BoIFN-tau诱导的ISG表达量Fig.4 Analysis of ISG expression induced by BoIFN-tau by semiquantitative RT-PCR
3 讨论
本研究克隆了BoIFN-tau基因并在原核系统成功表达。测序结果显示,BoIFN-tau序列全长582bp,编码193个氨基酸组成的前体蛋白。起始的19个氨基酸为信号肽序列,成熟蛋白包含174个氨基酸。NCBI数据库Blast序列比对发现其与大多数奶牛编码IFN-tau的序列差异很小,与IFN-tau(HQ235019)序列的同源性为100%。与其他物种比较,与牦牛、大额牛和亚洲水牛的亲缘关系较近。
Ⅰ型干扰素具有抗病毒的作用。其作用机制为Ⅰ型干扰素与受体结合后,能够通过Jak-STAT信号通道激活干扰素刺激因子的合成,如 Mx-1、2′-5′寡聚腺苷酸合成酶(OAS)等[7]。Mx-1是Ⅰ型干扰素诱导产生的抗病毒产物,具有GTP酶活性,能直接发挥抗病毒作用[8]。动物模型试验表明,在没有IFN-α或IFN-β诱导产生其他蛋白的情况下,Mx-1能够有效阻断病毒的复制[9-10]。OAS通过介导细胞内信号转导,能够引起病毒RNA的降解,从而达到抗病毒的目的[11]。本研究检测了BoIFN-tau诱导下OAS和Mx-1的表达情况,结果表明与未诱导对照相比,BoIFN-tau能够使OAS和 Mx-1基因的表达量增加,说明BoIFN-tau的抗病毒活性机制与其他Ⅰ型干扰素抗病毒活性机制相似。与IFN-α对照比较,BoIFN-tau诱导的OAS和 Mx-1基因的表达量没有明显区别,表明BoIFN-tau在诱导抗病毒蛋白的表达量上与IFN-α没有区别,但是其最终抗病毒活性弱于IFN-α,这可能与IFN-α比IFN-tau在MDBK细胞中与受体的亲和力更高有关[12],其原因需要进一步分析验证。
研究表明,IFN-α、IFN-β具有高效的抗病毒活性,能够有效的抑制多种病毒的复制和转录[13-14],但是在作为药物治疗过程中有副作用,能够引起急性细胞因子中毒的症状[15]。IFN-tau作为Ⅰ型干扰素同样具有抗病毒活性,且IFN-tau副作用比IFN-β的小[15]。因此,在反刍动物抗病毒治疗中,IFN-tau与IFN-α、IFN-β相比,具有更高的安全性和更广泛的临床应用价值。本研究为Bo IFN-tau抗病毒产品的开发奠定了基础。
[1]Robinson R S,Mann G E,Lamming G E,et al.The effect of pregnancy on the expression of uterine oxytocin,oestrogen and progesterone receptors during early pregnancy in the cow[J].J Endocrinol,1999,160:21-33.
[2]Soos J M,Subramaniam P S,Hobeika A C,et al.The IFN pregnancy recognition hormone IFN-tau blocks both development and superantigen reactivation of experimental allergic en-cephalomyelitis without associated toxicity[J].J Immunol,1995,155:2747-2753.
[3]Roberts R M,Liu L,Alexenko A.New and atypical families of type I interferons in mammals:comparative functions,structures,and evolutionary relationships[J].Prog Nucleic Acid Res Mol Biol,1997,56:287-325.
[4]Stewart M D,Johnson G A,Bazer F W,et al.Interferon-tau(IFNtau)regulation of IFN-stimulated gene expression in cell lines lacking specific IFN signaling components[J].Endocrinology,2001,142:1786-1794.
[5]Kang D,Ryoo S,Chung B,et al.Amino acid differences in interferon-tau(IFN-s)of Bos taurus Coreanae and Holstein[J].Cytokine,2012,59:273-279.
[6]付加雷,宋长征,张更林.干扰素-tau的原核表达、纯化和活性测定[J].中国生物工程杂志,2007,27(3):6-11.
[7]Uze G,Schreiber G,Piehler J,et al.The receptor of the type I interferon family[J].Curr Top Microbiol Immunol,2007,316:71-95.
[8]孙业平,高 福.天然免疫抗病毒效应分子 Mx蛋白的结构与功能研究进展[J].生物化学与生物物理进展,2010,37(7):699-706.
[9]Arnheiter H,Frese M,Kambadur R,et al.Mx transgenic mice-animal models of health[J].Curr Top Microbiol Immunol,1996,206:119-147.
[10]Haller O,Frese M,Kochs G.Mx proteins:mediators of innate resistance to RNA viruses[J].Rev Sci Tech,1998,17:220-230.
[11]Rebouillat D,Hovanessian A G.The human 2′-5′oligoadenylate synthetase family:interferon induced proteins with unique enzymatic properties[J].J Interferon Cytokine Res,1999,19:295-308.
[12]Subramaniam P S,Khan S A,Pontzer C H,et al.Differential recognition of the type I interferon receptor by interferons tau and alpha is responsible for their disparate cytotoxicities[J].Proc Natl Acad Sci U S A,1995,92:12270-12274.
[13]Schaefer C,Hidalgo T R,Cashion L,et al.Genebased delivery of IFN-beta is efficacious in a murine model of experimental allergic encephalomyelitis[J].J Interferon Cytokine Res,2006,26:449-454.
[14]Soos J M,Mujtaba M G,Subramaniam P S,et al.Oral feeding of interferon tau can prevent the acute and chronic relapsing forms of experimental allergic encephalomyelitis[J].J Neuroimmunol,1997,75:43-50.
[15]Soos J M,Johnson H M.Interferon-tau:prospects for clinical use in autoimmune disorders[J].Bio Drugs,1999,11:125-135.

