马尾藻多糖脂质体对免疫抑制小鼠免疫器官的影响
尹 丹,郝祝兵,胡雯月,刘姗姗,韦英益,胡庭俊*
(1.广西大学动物科学技术学院,广西 南宁 530005;2.郑州大学生命科学学院,河南 郑州 450001)
1 材料与方法
1.1 材料
1.1.1 药品和试剂 马尾藻多糖脂质体5mg/mL,由广西大学动科院药理实验室制备;环磷酰胺,江苏恒瑞医药产品(批号10082521);白蛋白、总蛋白、溶菌酶检测试剂盒,南京建成生物工程研究所产品。
1.1.2 仪器设备 AB104-L分析天平,瑞士梅特勒公司产品;UV-1800型紫外可见光分光光度计,北京瑞利分析仪器公司产品;DK-98-Ⅱ型电热恒温水浴锅、尼康YS100生物显微镜,购自天津泰斯特仪器有限公司。
1.1.3 实验动物 6周龄昆明种小鼠60只,18g~22g,雌雄各半,购自广西医科大学动物实验中心。
1.2 马尾藻多糖脂质体的制备及测定
1.2.1 马尾藻多糖脂质体(SPL)的制备 采用乙醇注入法,将多糖溶于PBS,加入吐温80,沸水浴3min,置于磁力搅拌机上搅拌。将磷脂、胆固醇溶于无水乙醇,用5mL注射器吸取后缓慢加入到多糖溶液中,高速搅拌,持续搅拌1h待乙醇蒸发,即可得到马尾藻多糖脂质体混悬液。
1.2.2 SPL包封率的测定 采用超速离心法[13]测定SPL的包封率,苯酚-硫酸法[14]测定多糖含量。计算公式:包封率= (W总-W 游离)/W总×100%,其中,W游离为游离多糖含量,W总为脂质体中包封的多糖与游离多糖之和。采用苯酚-硫酸法测定糖含量。
1.2.3 粒径测定 采用激光纳米粒度分析仪测定马尾藻多糖脂质体的粒径。
1.2.4 实验动物分组与处理 将60只小鼠随机分为6组,每组10只,雌雄各半,分笼饲养。设生理盐水对照组A:第1天~第7天以生理盐水灌胃。免疫抑制(模型)组B:第1天~第7天每天腹腔注射Cy(30mg/kg);低剂量SPL+Cy组C:第1天~第7天每天腹腔注射Cy(30mg/kg),并每天以5mg/mL SPL灌胃(50mg/kg)。中剂量SPL+Cy组D:第1天~第7天每天腹腔注射Cy(30mg/kg),并每天以5mg/mL SPL灌胃(100mg/kg)。高剂量SPL+Cy组E:第1天~第7天每天腹腔注射Cy(30mg/kg),并每天以5mg/mL SPL灌胃(200mg/kg)。SPL对照组F:第1天~第7天每天以5mg/mL SPL灌胃(200mg/kg)。
1.2.5 检测项目及方法 用药后第8天小鼠称重、眼眶采血后颈椎脱臼处死,取脾脏和胸腺称重,计算脾脏、胸腺指数;按试剂盒操作说明测定血液中溶菌酶活性、总蛋白、白蛋白、球蛋白含量;进行白细胞总数计数及白细胞分类计数。胸腺指数(TI)=胸腺重(mg)/第8d体重(g);脾脏指数(SI)= 脾脏重(mg)/第8天体重(g)。
此类问题在成果数据中出现的频率较高。无论作业还是检查中,应重点对人类活动频繁、易发生变化的区域进行细致排查,如城镇及其周边,大型的工程建设等周围。
1.2.6 脾脏、胸腺组织学观察 将所取脾脏、胸腺投入盛有40g/L中性甲醛液中固定,经过流水冲洗,梯度乙醇脱水,二甲苯透明,常规石蜡包埋,切片,厚度为6μm,苏木精伊红(HE)染色,光学显微镜下观察并照相。
1.2.7 数据处理 试验数据采用SPSS 16.0软件进行分析,并进行单因素方差分析和多重比较,结果以“平均数±标准差”表示。
2 结果
2.1 马尾藻多糖脂质体(SPL)的包封率及粒径
经测定结果表明,SPL的包封率为38.6%,较为理想。马尾藻多糖脂质体粒径范围为91nm~531nm,平均粒径为203nm。呈正态分布。
2.2 SPL对小鼠胸腺及脾脏指数的影响
由表1可见,与生理盐水对照组A相比,腹腔注射环磷酰胺能显著降低小鼠的脾脏指数(P<0.05),极显著降低小鼠的胸腺指数(P<0.01),说明利用环磷酰胺成功建立了免疫抑制模型。与Cy模型组B相比,高剂量SPL(200mg/kg)能提升免疫功能低下小鼠的脾脏指数,各剂量SPL均能升高免疫低下小鼠的胸腺指数。单用SPL(200mg/kg)能极显著升高正常小鼠的脾脏指数,降低胸腺指数(P<0.01)。
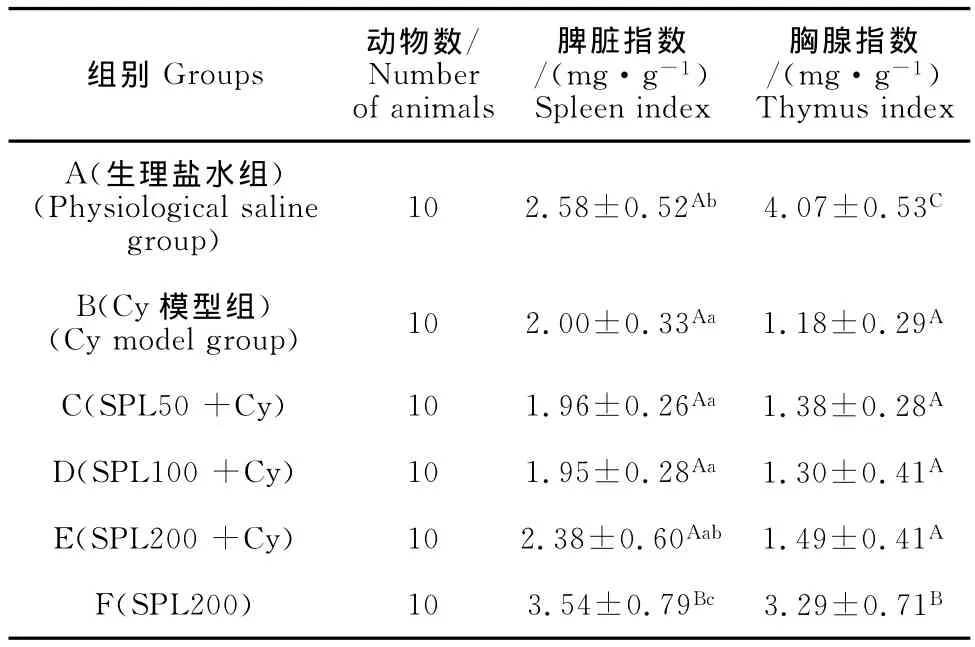
表1 不同浓度SPL对小鼠胸腺及脾脏指数的影响Table1 Effect of Sargassum polysaccharide liposome(SPL)on the spleen and thymus indexes in mice mg/g
2.3 SPL对小鼠总蛋白、白蛋白和溶菌酶的影响
由表2可见,与生理盐水对照组A相比,Cy模型组的总蛋白和白蛋白浓度均无显著变化(P>0.05),而溶菌酶的浓度极显著降低(P<0.01)。与Cy模型组相比,高剂量SPL(200mg/kg)能极显著提高免疫抑制小鼠血液中总蛋白的浓度(P<0.01),显著提高免疫抑制小鼠血液中溶菌酶的含量(P<0.05)。与生理盐水组相比,200mg/kg SPL能显著提高小鼠血液中总蛋白的浓度(P<0.05)。
2.4 白细胞总数及分类计数
由表3可见,与生理盐水组A相比,Cy组的白细胞总数极显著降低(P<0.01),淋巴细胞比例降低,说明环磷酰胺免疫抑制模型建立成功。与Cy组相比,不同剂量SPL均能显著提升免疫抑制小鼠的白细胞总数(P<0.05),其中高、中剂量组差异极显著(P<0.01)。同时,不同剂量SPL均能升高免疫抑制小鼠血液中淋巴细胞比例。
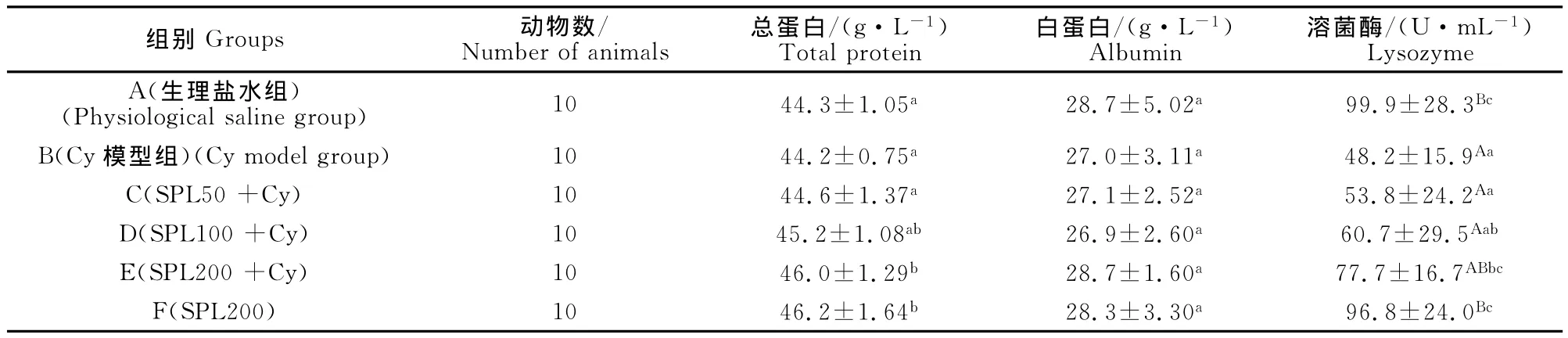
表2 不同处理组小鼠血液总蛋白、白蛋白和溶菌酶含量Table2 The contents of total protein,albumin and lysozyme in mice with blood in different treatments
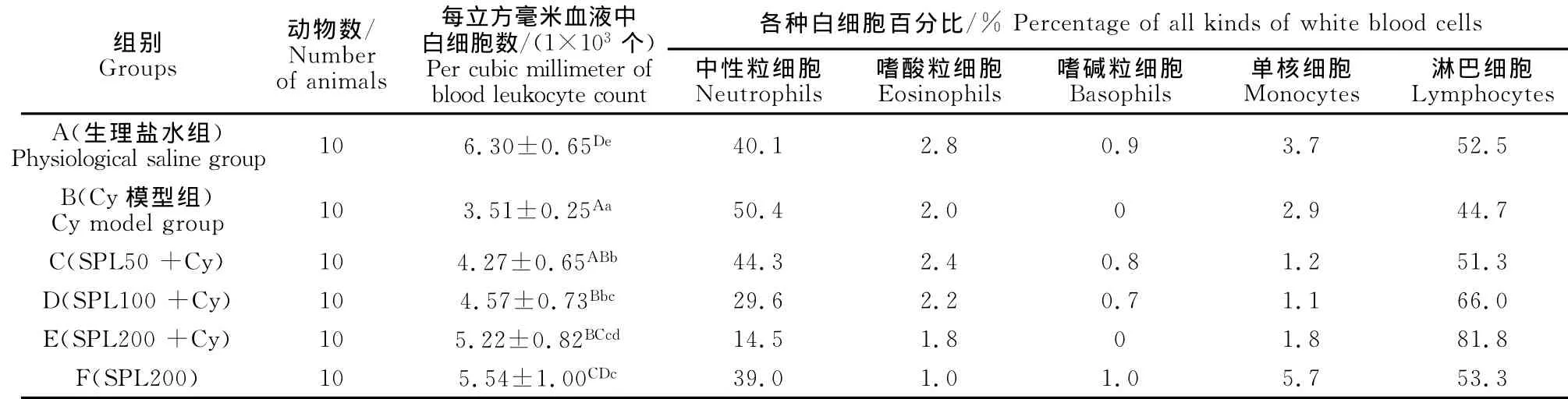
表3 不同处理组小鼠血液白细胞总数及分类计数情况Table3 The total number and the percentage of white blood cells in mice with different treatment
2.5 小鼠脾脏和胸腺的组织学观察
小鼠脾脏的组织学观察结果显示,生理盐水组小鼠脾脏结构清晰,淋巴细胞密集(图1-A),而Cy组小鼠脾脏红髓、白髓分界不清晰,脾小体变小,轮廓模糊,淋巴细胞减少,形态不规则(图1-B)。与Cy组相比,不同剂量SPL+Cy组小鼠脾白髓、红髓界限可见,脾小体较大,细胞数量有所增加,细胞形态较规则(如图1-C、D、E)。SPL组与生理盐水组相比,脾小体增多,白髓比例较高,淋巴细胞密集,细胞结构清晰,形态规则(图1-F)。
小鼠胸腺组织观察结果看出,生理盐水组小鼠胸腺分叶清晰,皮质厚而淋巴细胞密度高,染色深(图2-A)。Cy组小鼠胸腺显著萎缩,皮质和髓质分界不清,皮质薄且细胞稀疏(图2-B)。与Cy组相比,不同剂量SPL+Cy组小鼠胸腺有所萎缩,但分叶较清楚,皮质较Cy组厚,细胞密度有所增加(图2-C、D、E)。与生理盐水组相似,SPL组小鼠胸腺小叶分化明显,界限清楚,皮质面积增大,淋巴细胞密集(图2-F)。
3 讨论
3.1 环磷酰胺免疫抑制模型的建立
Cy作为一种免疫抑制剂,给药剂量和给药时间在建立免疫抑制模型的过程中十分关键。Cy的给药剂量过低,不仅不能抑制机体免疫功能,反而可能会对其有促进作用。本试验根据预试验的结果,每天选用30mg/kg的剂量连续7d腹腔注射Cy来建立免疫抑制模型,结果显示,Cy能显著降低正常小鼠的脾脏和胸腺指数,减少血液、脾脏、胸腺的淋巴细胞数量,说明免疫抑制模型建立成功。
3.2 SPL对小鼠免疫器官指数的影响
脾脏和胸腺是机体重要的免疫器官。脾脏是最大的外周淋巴组织器官,是机体细胞免疫和体液免疫的中心。机体受抗原刺激后,参与细胞免疫和体液免疫的T细胞、B细胞大量增生,导致脾滤泡增大,脾脏体积增大;而受到免疫抑制影响时,淋巴组织萎缩,导致脾脏体积减小,因此免疫器官的质量指数可以反映机体免疫器官的发育状况。本试验结果显示,各水平的SPL不能显著提高免疫功能低下小鼠的脾脏指数(P>0.05),但SPL能极显著提高正常小鼠的脾脏指数(P<0.01)。可能与其他研究报道的脾脏质量是免疫毒性一个不敏感的指标有关[15]。各水平SPL均能提升高免疫功能低下小鼠的胸腺指数,说明SPL能拮抗Cy所致的胸腺萎缩,增强免疫功能。
3.3 SPL对小鼠总蛋白、白蛋白和溶菌酶的影响
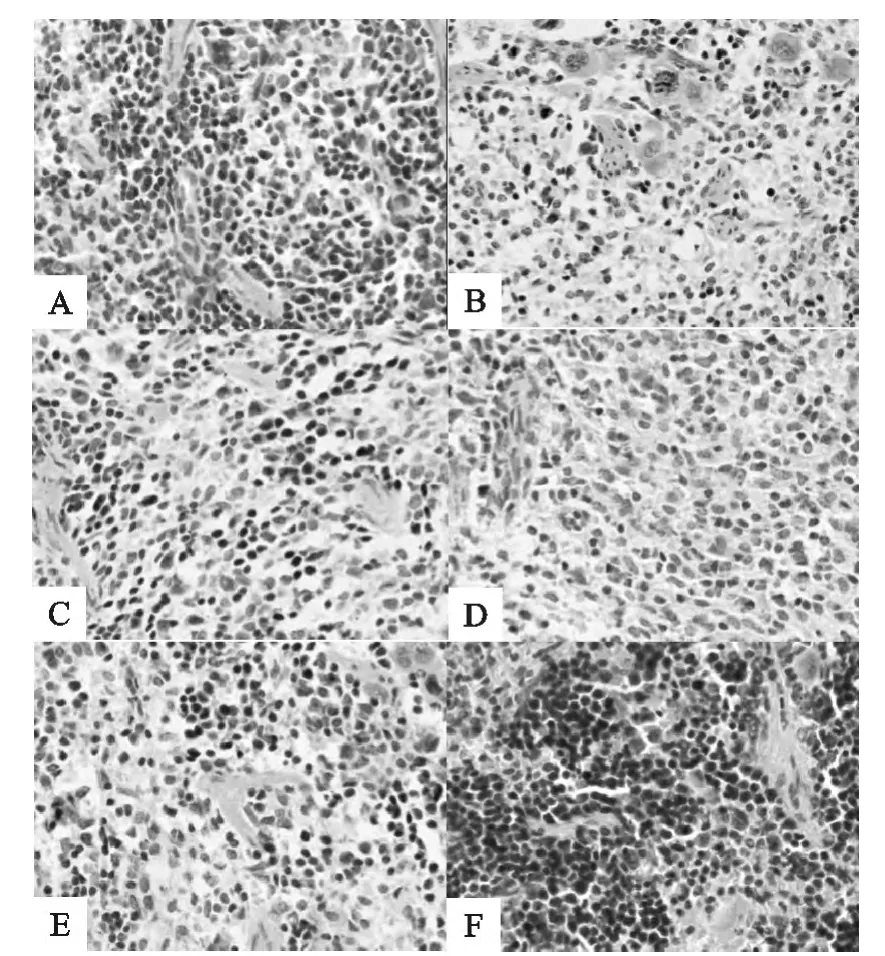
图1 小鼠脾脏组织切片(HE,200×)Fig.1 Spleen tissue sections of mice(HE,200×)
血浆总蛋白主要由白蛋白和球蛋白组成,其中白蛋白占比例较大,占血浆总蛋白的40%~60%,而球蛋白是由淋巴细胞产生,当机体循环抗体水平升高时,球蛋白数量增加,其能与外来的特异性抗原起(200mg/kg)能极显著提高免疫抑制小鼠血液中总蛋白的浓度,但各剂量组的白蛋白水平无显著性差异,表明SPL能通过提高球蛋白含量提高机体循环抗体水平,从而提高免疫抑制小鼠免疫功能。
溶菌酶是一种能水解致病菌中黏多糖的碱性酶,主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂、内容物逸出而使细菌溶解。溶菌酶作为一种存在于机体正常体液及组织中的非特异性免疫因素,在机体的炎症过程、修复再生等过程中发挥重要的调节作用。血浆溶菌酶的活力是反映机体非特异性免疫力的重要指标。本试验研究发现,高剂量SPL(200mg/kg)能显著提高免疫抑制小鼠血液中溶菌酶的含量,表明SPL能对抗环磷酰胺的免疫抑制作用,激活并提高免疫抑制小鼠非特异性免疫反应。
3.4 SPL对小鼠血液白细胞数和淋巴细胞比例的影响
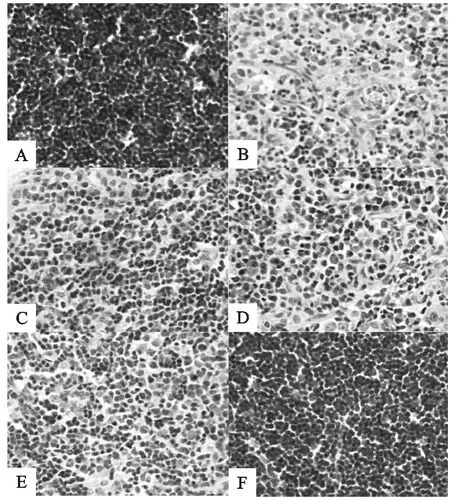
图2 小鼠胸腺组织切片(HE,200×)Fig.2 Thymus tissue sections of mice(HE,200×)
白细胞是机体抵御病原微生物等异物入侵的主要防线。白细胞计数反映了血液中的白细胞数量。血液中的主要白细胞有5类,即中性粒细胞(N)、嗜酸粒细胞(E)、嗜碱粒细胞(B)、淋巴细胞(L)和单核免疫反应而保护机体,其含量的高低可在一定程度上反映动物的免疫水平,它的含量的升高也可引起总蛋白含量上升[16]。本试验研究发现,高剂量SPL细胞(M),化验时用特殊的染色法可予以鉴别。中性粒细胞占白细胞总数的50%~70%,淋巴细胞占20%~40%,单核细胞占3%~8%,嗜酸粒细胞占1%~5%,嗜碱粒细胞不超过1%。淋巴细胞在机体的免疫应答过程中起核心作用,血液白细胞中淋巴细胞的比例是衡量机体免疫状况的一个指标。在本试验中,腹腔注射Cy可造成小鼠白细胞数量减少,并降低血液白细胞中淋巴细胞的比例,说明免疫抑制模型建立成功。研究发现,不同剂量SPL均能升高免疫抑制小鼠的白细胞总数到趋近于正常水平,同时升高白细胞中淋巴细胞的比例,表明SPL能拮抗环磷酰胺对小鼠免疫系统的抑制作用。
3.5 SPL对免疫抑制小鼠脾脏和胸腺的组织学影响
脾脏是免疫应答的重要场所,胸腺的结构分为皮质和髓质,胸腺皮质由大量密集的胸腺细胞(即T淋巴细胞的前身)和少量巨噬细胞等,染色较深;胸腺髓质染色较淡,内含大量上皮细胞和一些T细胞、巨噬细胞等。侵入机体的病原体可引起脾内发生免疫应答,脾的体积和结构也发生变化,脾小结增多增大,脾索内浆细胞增多;细胞免疫应答时,动脉周围淋巴鞘显著增厚[4]。在本试验中,小鼠腹腔注射环磷酰胺后,脾脏和胸腺的组织结构都发生很大的变化,主要表现为:脾脏皮质和髓质分界不清,脾小结变小,轮廓模糊,淋巴细胞减少,巨噬细胞增多;胸腺皮质萎缩,髓质增多,皮质和髓质分界不清,融为一体,皮质淋巴细胞减少,说明环磷酰胺免疫抑制模型建立成功。而SPL灌胃后,免疫器官的上述损伤和变化减轻,表明SPL对Cy所致的免疫器官损伤有较好的拮抗和修复作用。此外,与生理盐水组相比,SPL组(F)小鼠脾脏淋巴小结增生,白髓面积增大并向外扩散;胸腺皮质面积增大,髓质面积变小,皮质淋巴细胞增多,表明SPL能增强机体的免疫功能。
总之,马尾藻多糖脂质体通过增强免疫器官的功能和增加免疫细胞的数量,从而拮抗环磷酰胺对小鼠免疫系统的抑制作用。
[1]Chen X M,Nie W,Yu G,et al.Antitumor and immunomodulatory activity of polysaccharides from Sargassum fusiforme[J].Food and Chem Toxicol,2012,50(3):695-700.
[2]Wang W,Lu J B,Wang C,et al.Effects of Sargassum fusiforme polysaccharides on antioxidant activities and intestinal functions in mice[J].Inter J Biol Macromol,2013,58:127-132.
[3]Sinha S,Astani A,Ghosh T,et al.Polysaccharides fromSargassum tenerrimum:Structural features,chemical modification and anti-viral activity[J].Phytochemistry,2010,71(2):235-242.
[4]张 玲,胡庭俊,陈炳全.马尾藻多糖对鸡脾脏淋巴细胞增殖及氧化应激影响的实验观察[J].西南农业学报,2011,24(5):1967-1971.
[5]韦英益,胡庭俊,苏子杰,等.马尾藻多糖对猪脾细胞免疫活性及其抗病毒活性的影响[J].南京农业大学学报,2012,35(2):120-124.
[6]陈忠伟,高建峰,胡庭俊,等.马尾藻多糖对小鼠免疫功能调节作用的研究[J].中国畜牧兽医,2009,36(1):57-59.
[7]Chen X,Nie W,Fan S,et al.A polysaccharide fromSargassum fusiforme protects against immunosuppression in cyclophosphamide-treated mice[J].Carbohyd Poly,2012,90(2):1114-1119.
[8]Motoyoshi Y,Kaminoda K,Saitoh O,et al.Different mechanisms for anti-tumor effects of low and high dose cyclophosphamide[J].Oncol Rep,2006,16(1):141-146.
[9]Wang H,Wang M,Chen J,et al.A polysaccharide from Strongylocentrotus nudus eggs protects against myelosuppression and immunosuppression in cyclophosphamide-treated mice[J].Int Immunopharmacol,2011,11(11):1946-1953.
[10]李 丽,刘 哲.杨树花水提物对免疫抑制小鼠免疫功能的影响[J].动物医学进展,2013,34(8):66-70.
[11]王思芦,汪开毓,陈德芳.食用真菌多糖免疫调节作用及其机制研究进展[J].动物医学进展,2013,33(11):104-108.
[12]范云鹏,王德云,胡元亮,等.黄芪多糖脂质体对鸡淋巴细胞增殖的影响[J].南京农业大学学报,2011,34(4):95-99.
[13]张晓伟.离心法测定隐丹参酮脂质体包封率[J].晋城职业技术学院学报,2009,2(1):71-73.
[14]齐明玉,刘 敏.荜茇多糖提取与含量测定[J].中国民族民间医药杂志,2013(1):32-33.
[15]Sellers R S,Mortan D,Michael B,et al.Society of toxicologic pathology position paper:organ weight recommendations for toxicology studies[J].Toxicol Pathol,2007,35(5):751-755.
[16]林 谦,戴求仲,宾石玉,等.益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J].饲料工业,2012(14):31-36.

