猪繁殖与呼吸综合征病毒TJM株5′和3′非翻译区克隆与测序
刘 莹,王凤雪,温永俊*,武 华
(1.中国农业科学院特产研究所特种经济动物分子生物学国家重点实验室-省部共建,吉林 长春 130112;2.华威特(北京)生物科技有限公司,北京 100085)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)又称猪蓝耳病,是一种由猪繁殖与综合征病毒(PRRSV)引起的猪的接触性传染病,能引起母猪流产、死胎、弱胎、木乃伊胎以及仔猪呼吸困难、败血症等,范围波及全世界,造成了严重的影响。该病传播快、传染性强,被世界动物卫生组织列入法定报告动物疫病之一。2006年,我国暴发了高致病性猪繁殖与呼吸综合征(HPPRRS),它具有更高的发病率和病死率,给我国的养猪业带来了巨大的经济损失[1]。
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是PPRS的病原体,属于套式病毒目,是单股正链RNA病毒[2]。PRRSV的复制,表现出一种独特的转录方式,即亚基因组mRNA的不连续性。它以负链RNA转录产生重叠的亚基因组mRNA套式系列,它们具有共同的3′末端,即3′非翻译区(3′untranslated region,3′UTR),约169bp[3-5]。这一系列的mRNA都有一段来源于基因组5′非翻译区(5′untranslated region,5′UTR)的共同部分,长约189bp~190bp,它们位于每个亚基因组RNA的上游,用以翻译病毒的结构蛋白[6-7]。有关研究表明,5′UTR在病毒基因组复制以及亚基因组mRNA转录过程中起到了核心的作用[8-10]。可见,对于套式病毒目的病毒,位于编码序列两端,对病毒复制过程起到调控作用的UTR十分重要。
HP-PRRS暴发之时,本实验室从天津某猪场分离到1株病毒[11],命名为TJ株,经鉴定其Nsp2序列缺失第481位和第532-560位,为 HP-PRRSV。将TJ株在Marc-145上连续传代,传到第92代时,致病性充分减弱,命名为TJM株[12]。在基因工程研究中,分析基因全长cDNA序列十分重要,但一般RT-PCR很难从mRNA扩增到全基因组两端的片段。RACE(rapid amplification of cDNA ends)技术由Frohman M A等[13]首次提出,是一种以PCR反应为基础,应用通用引物和特异引物从低丰度转录本中快速扩增已知cDNA片段旁侧5′和3′末端的简单而有效的方法。这种获得cDNA的5′和3′末端的方法,也被称为锚定PCR(anchored-PCR)或单边PCR(one-sided PCR),得到cDNA的3′和5′末端的技术分别称之为3′RACE和5′RACE[14-15]。本试验为弄清TJM株两端UTR序列,为全长感染性克隆的构建打好基础,并确定与TJ株及其他毒株的差异,采用5′和3′RACE方法获得两端序列。
1 材料与方法
1.1 材料
1.1.1 病 毒 PRRSV TJM 株 和 MARC-145 细胞,由中国农业科学院特产研究所特种经济动物分子生物学国家重点实验室保存。
1.1.2 主要试剂 RNA 提取试剂 Trizol,Invitrogen公司产品;M-MLV、RNase Inhibitor,Promega公司产品;DNA纯化试剂盒,Axygen公司产品;Phusion High-Fidelity DNA polymerase,NEB公司产品;ExTaq,宝生物工程(大连)有限公司产品;5′/3′RACE Kit,Roche公司产品。
1.1.3 载体和菌种 克隆载体pEASY-Blunt Simple Cloning Kit、感受态大肠埃希菌Trans 5α,北京全式金生物技术有限公司产品。
1.2 方法
1.2.1 引物的设计与合成 采用Primer Premier 5软件,根据GenBank中已发表的PRRSV TJ株(EU860248.1)序列,设计3′RACE和5′RACE的特异引物。引物序列见表1,由英维捷基(上海)贸易有限公司合成。
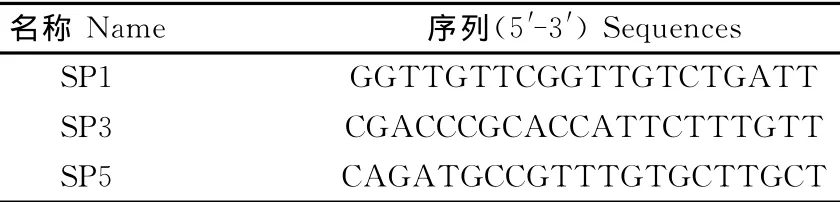
表1 PRRSV TJM 株5′/3′RACE引物Table1 Primers for PRRSV TJM 5′/3′RACE
1.2.2 病毒总RNA提取 按照Invitrogen公司RNA提取试剂Trizol使用说明书操作,最后用20 μL DEPC水溶解RNA,取9μL直接用于下一步试验,其余置-80℃保存。
1.2.3 cDNA的合成 将提取的RNA用作反转录的模板,5′RACE反转录(RT)引物为SP1,3′RACE反转录引物为Oligo(dT)。在RNase-free离心管中加入RNA提取液9μL,RT引物1μL,充分混匀后于70℃水浴10min,之后立即放于冰上5min。再加入dNTP(10nmol/L)2μL,M-MLV1μL,5×buffer 4μL,RNasin 0.5μL,DEPC水2.5μL,总体积20μL,充分混匀,42℃水浴60min,95℃水浴10min,直接用于下一步试验。
1.2.4 cDNA 纯化及加尾 按照 Roche的5′/3′RACE Kit说明书操作,纯化得到cDNA 50μL,其中19μL直接用于加尾,并最终得到25μL加尾cDNA。获得纯化及加尾cDNA于-20℃保存。
1.2.5 RACE
1.2.5.1 5′RACE 以获得的纯化dA 加尾 DNA作为模板,以试剂盒内所带锚定引物和表1中所述的引物SP3分别为上、下游引物进行PCR。
1.2.5.2 3′RACE 以获得的纯化dA 加尾 DNA做模板,以Oligo(dT)和表1中所述的引物SP5分别为上、下游引物进行PCR。
1.2.6 PCR产物的克隆与测序 将扩增的基因产物回收后与载体pEASY-Blunt连接,转化Trans 5α感受态细胞,经Amp+抗性筛选,PCR鉴定,阳性克隆送吉林省库美生物科技有限公司测序。
2 结果
2.1 5′RACE序列克隆和分析
2.1.1 5′RACE序列的扩增 用特异引物Oligo dT-Anchor Primer和SP3进行PCR扩增,得到PRRSV TJM F92代5′末端序列。获得的PCR扩增产物在10g/L的琼脂糖凝胶上进行电泳(图1),片段大小为531bp。
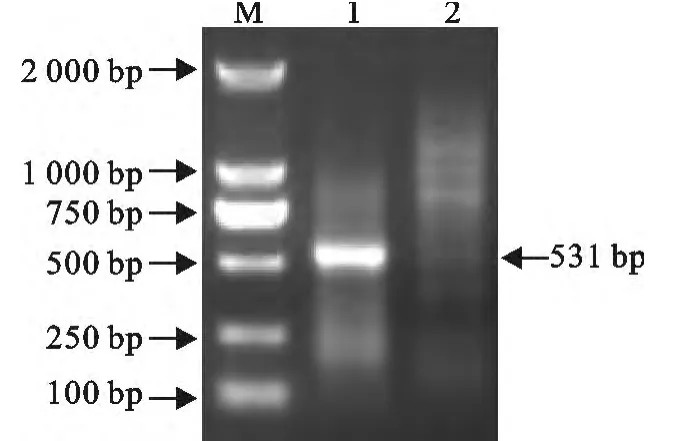
图15 ′RACE琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of 5′RACE of PRRSV TJM
2.1.2 5′RACE PCR 产物的克隆鉴定 5′RACE PCR产物经克隆、转化及PCR鉴定(M13F/R为引物),得到目的片段为631bp,证明获得了PRRSV阳性重组子(图2)。
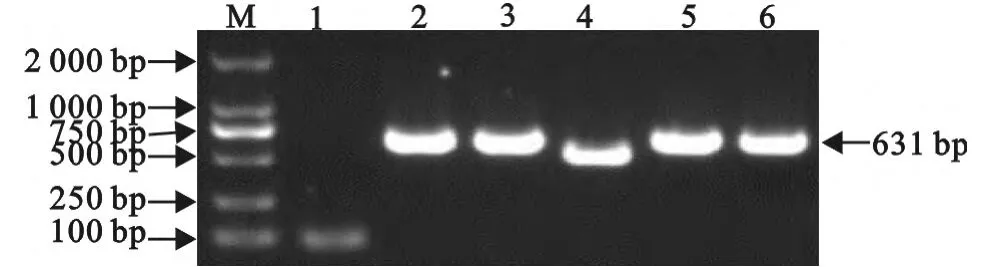
图2 pEASY-Blunt-5′RACE PCR 鉴定Fig.2 Identification of pEASY-Blunt-5′RACE by PCR
2.1.3 5′RACE测序结果分析 选择阳性重组子并克隆测序,TJM 5′UTR 189bp核苷酸序列在DNA Star生物学软件中使用Clustal W和Martinez NW方法与TJ株核苷酸序列进行比对,发现TJM在第29位T→C;33位缺失A;39后插入A;60位T→A(图3)。
将TJ株与TJM株5′UTR核苷酸序列使用RNAstructure进行RNA二级结构预测,选取预测二级结构自由能最小的预测结果,发现2个毒株的RNA二级结构仅在茎环结构(stem-loop)SL1和SL2上存在差异(图4)。

图3 TJ株和TJM株5′UTR序列比较Fig.3 The comparison of 5′untranslated region of sequence between TJM and TJ
通过二级结构的预测可发现,TJM 5′UTR的突变造成二级结构的差别,主要集中在第1个和第2个茎环结构(SL1;SL2)的改变。
将克隆测序的TJM 5′UTR核苷酸序列在NCBI上与其他毒株的5′UTR进行Blast,发现与XJu-1的同源性达到100%,其他许多毒株的同源性也非常高,且与亚洲地区年代越近的毒株同源性越高,仅挑选几个毒株作为代表(图5)。
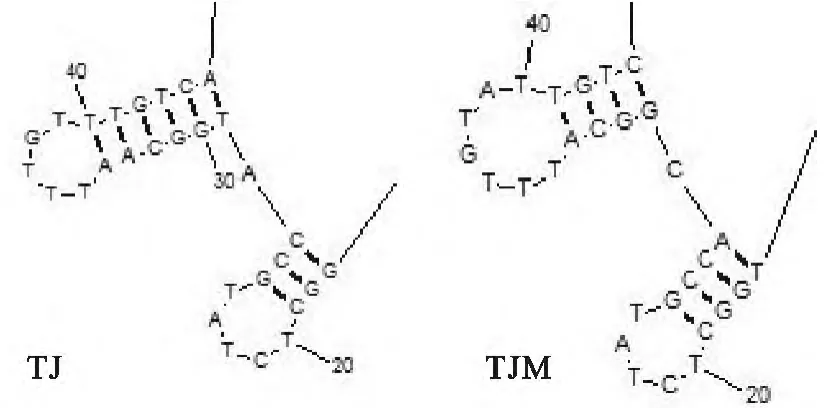
图4 TJ株和TJM株5′UTR RNA二级结构预测差异部分Fig.4 The predicted differences of RNA secondary structure of 5′untranslated region of TJ strain and TJM strain
2.2 3′RACE序列克隆和分析
2.2.1 3′RACE序列的扩增 用特异引物Oligo(dT)和SP5进行PCR扩增,得到PRRSV TJM F92代3′末端序列。获得的PCR扩增产物在10g/L的琼脂糖凝胶上进行电泳(图6),片段大小为799bp。
2.2.2 3′RACE PCR 产物的克隆鉴定 3′RACE PCR产物经克隆、转化及PCR鉴定(M13F/R为引物),得到目的片段为899bp,证明获得了PRRSV阳性重组子(图7)。
2.2.3 3′RACE测序结果分析 选择阳性重组子并克隆测序,TJM 3′RACE 169bp核苷酸序列在DNA Star生物学软件中与TJ株核苷酸序列进行比对,发现3′UTR无突变(图8)。
3 讨论
病毒的5′UTR虽然不编码病毒的结构蛋白或者是其他作用相关蛋白,但是它对病毒来说是必不可少的。在整个RNA病毒的复制过程中,病毒基因组中存在的顺式调控元件(cis-acting elements)发挥了重要的调控作用,这些调控序列多存在于基因组末端的非翻译区(Un-translated Region UTR)[16]。本试验采用RACE方法测定PRRSV TJM株两端序列,从试验结果可以看出,TJM5′UTR的序列有所改变,与TJ株相比,在29位、33位、39-40位及60位发生突变,这些突变可能在TJ株传代成为TJM株弱毒的过程中,发挥某种调控作用。功能方面,单股正链RNA病毒基因组5′UTR主要在以下6个方面起作用,即病毒的感染性,病毒RNA的复制,病毒亚基因组的合成[17-18],翻译起始,毒力因子,基因组RNA的稳定性。本实验室已发现,TJM株较TJ株有更高的复制能力,这可能是由于5′UTR的突变而影响的RNA的复制。高飞[19]的研究表明,病毒5′端前16个碱基的保守性对病毒复制是非必须的,其所形成的SL1对病毒的感染性至关重要。陆嘉琦[16]的研究表明,PRRSV 5′UTR 中的 SL2茎环结构为病毒亚基因组mRNA不连续性转录所必须,该结构发挥作用的关键元件是其茎环结构的完整性,是病毒复制与拯救的关键。
通过预测RNA二级结构,TJM株较TJ株所产生的突变核苷酸正在形成SL1和SL2的范围内,这很有可能影响了RNA的高级结构甚至功能。在与PRRSV其他毒株比对中发现,与来自新疆的XJu-1的5′UTR序列完全一致。在特定的位点发生了相同的突变,可能不是巧合,2个毒株有何共同点还需要进一步研究。TJM株序列改变的前3个突变(第29位T→C;33位缺失A;39后插入A)在其他亚洲病毒上普遍存在(图5)。其中,JXA1系列病毒为细胞传代致弱病毒,与XJu-1一样,它们在结构上的共同性是否与病毒基因组的合成或病毒的感染性有关还 需要进一步研究。TJM株5′UTR和3′UTR准确序列的获得,为全长感染性克隆的构建打好了基础,为比较在不同地区流行的PRRSV之间的差异提供参考。
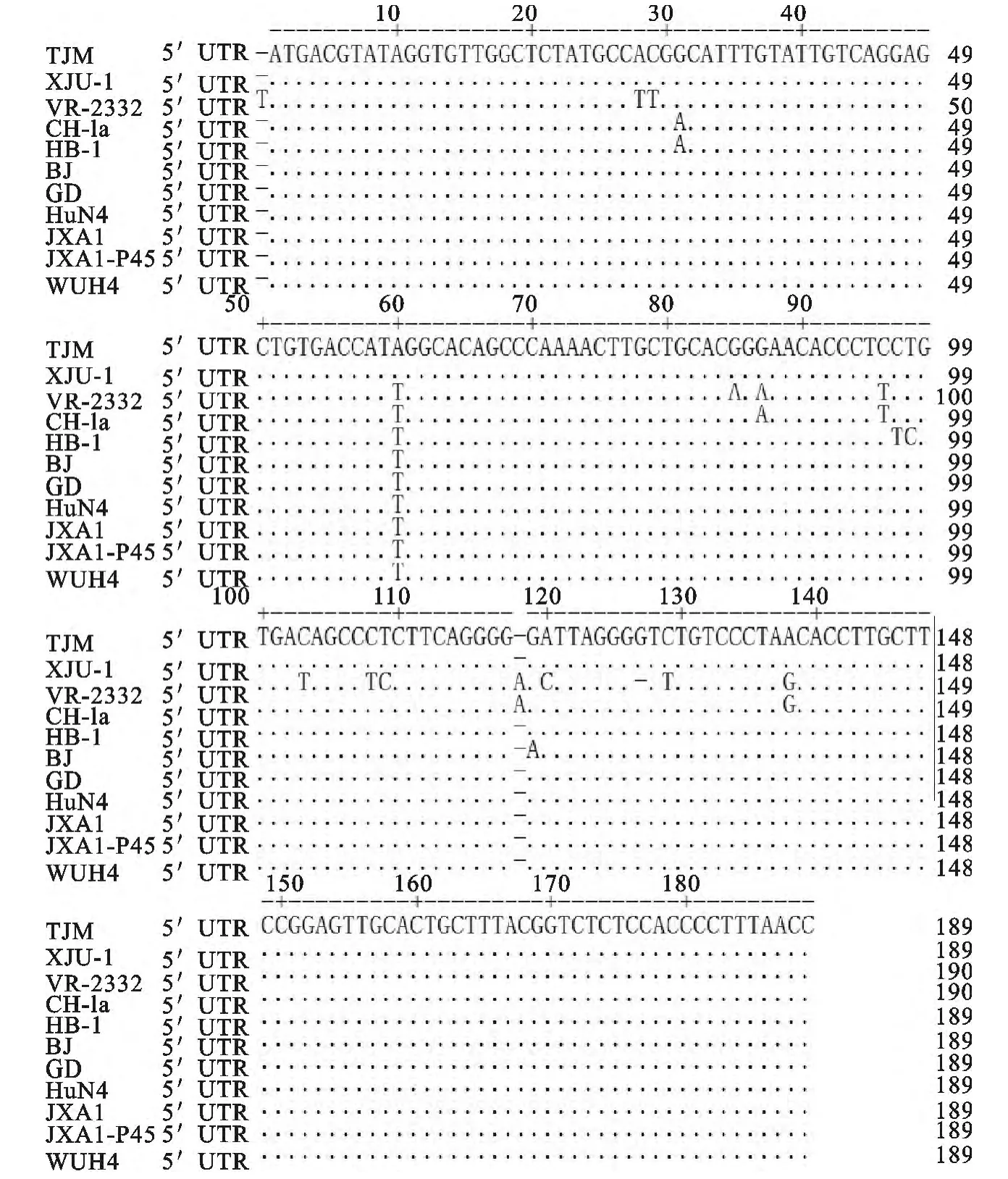
图5 TJM株5′UTR序列Blast结果Fig.5 The Blast result of the 5′untranslated region of TJM
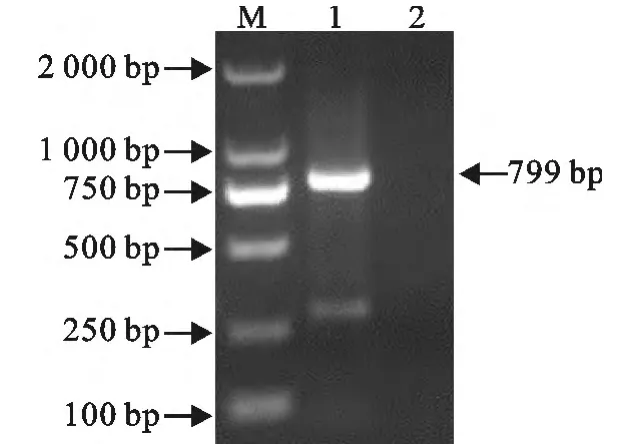
图6 3′RACE琼脂糖凝胶电泳图Fig.6 Agarose gel electrophoresis of 3′RACE of PRRSV TJM
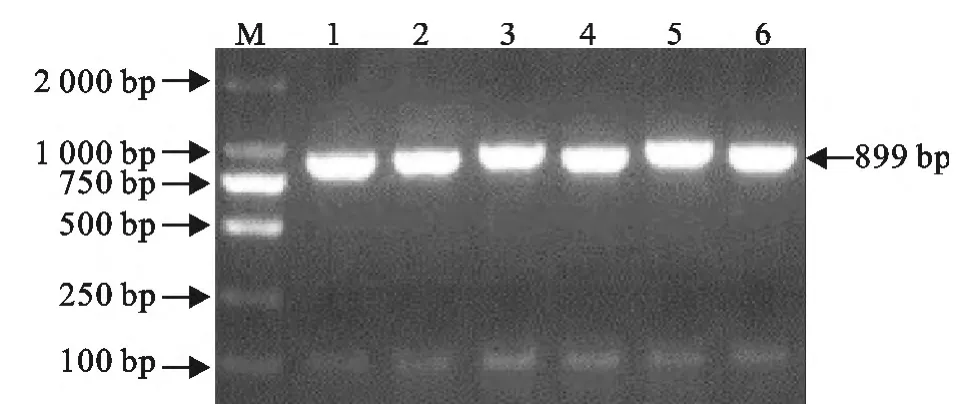
图7 pEASY-Blunt-3′RACE PCR 鉴定Fig.7 Identification of pEASY-Blunt-3′RACE by PCR

图8 TJ株与TJM株3′UTR序列比较Fig.8 The comparison of 3′untranslated region of sequence between TJM and TJ
[1]官家明,施开创,陈汉忠,等.猪繁殖与呼吸综合征病毒检测技术研究进展[J].动物医学进展,2013,34(8):88-92.
[2]Stadejek T,Stankevicius A,Storgaard T,et al.Identification of radically different variants of porcine reproductive and respiratory syndrome virus in Eastern Europe:towards a common ancestor for European and American viruses[J].J Gen Virol,2002,83:1861-1873.
[3]Faaberg K S,Hocker J D,Plagemann P G,et al.Neutralizing antibody responses of pigs infected with natural GPS N-glycan mutants of porcine reproductive and respiratory syndrome virus[J].Viral Immunol,2006,19(2):294-304.
[4]Fang L,Jiang Y,Chen H,et al.Enhanced immunogenicity of the modified GPSof porcine reproductive and respiratory syndrome virus[J].Virus Genes,2006,32(1):5-11.
[5]Snijder E J,Dobbe J C,Spaan W J.Heterodimerization of the two major envelope proteins is essential for arterivirus infectivity[J].J Virol,2003,77(1):97-104.
[6]Sawicki S G,Sawicki D L.Coronaviruses use discontinuous extension for synthesis of subgenome-length negative strands[J].Adv Exp Med Biol,1995,380:499-506.
[7]Pasternak A O,Spaan W J,Snijder E J.Nidovirus transcription:how to make sense[J].J Gen Virol,2006,87(6):1403-1421.
[8]Xue F,Sun Y N,Rao Z H,et al.The crystal structure of porcine reproductive and respiratory syndrome virus nonstructural protein Nsp1beta reveals a novel metal-dependent nuclease[J].J Virol,2010,84(13):6461-6471.
[9]Ziebuhr J,Snijder E J,Gorbalenya A E.Virus-encoded proteinases and proteolytic processing in the Nidovirales[J].J Gen Virol,2009,8l(4):853-879.
[10]Costers S,Lefebvre D J,Nauwynck H J,et al.Porcine reproductive and respiratory syndrome virus modulates apoptosis during replication in alveolar macrophages[J].Arch Virol,2008,153(8):1453-1465.
[11]冷 雪,温永俊,齐巧玲,等.高致病性猪繁殖与呼吸综合征病毒TJ株的分离与鉴定[J].吉林农业大学学报,2008,30(6):862-865.
[12]冷 雪,李真光,夏明崎,等.高致病性猪繁殖与呼吸综合征活疫苗的研制[J].中国兽医科学,2011,41(11):1171-1175.
[13]Frohman M A,Dush M K,Mrtin G R.Rapid production of full length cDNAs from rare transcripts:Amplification using single gene specific oligo nuleotide primer[J].Proc Natl Acad Sci USA,1988,85(23):8998-9002.
[14]陈启龙.RACE技术的研究进展及其应用[J].黄山学院学报,2006,8(3):95-98.
[15]王少丽,盛承发,乔传令.cDNA末端快速扩增技术及其应用[J].遗传,2004,26(3):419-423.
[16]陆嘉琦.猪繁殖与呼吸综合征病毒5′非翻译区的结构与功能解析[D].北京:中国农业科学院,2011.
[17]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[18]Vanden B E,Gultyaev A P,Snijder E J.Secondary structure and function of the 5′-proximalregion of the equine arteritis virus RNA genome[J].RNA,2004,10(3):424-437.
[19]高 飞.猪繁殖与呼吸综合征病毒5′非编码区顺式作用元件的解析[D].江苏南京:南京农业大学,2012.

