Wip1在甲状腺癌细胞中表达的临床及生物学意义
张文军 郑立春 柴连海 张晓明 夏安庆 胡耀杰
Wip1在甲状腺癌细胞中表达的临床及生物学意义
张文军①郑立春①柴连海②张晓明①夏安庆③胡耀杰④
目的:探讨野生型p53诱导的磷酸酶1(wild-type p53-induced phosphatase 1,Wip1)在甲状腺癌中的表达意义及其导入靶向Wip1的siRNA对甲状腺乳头状癌K1细胞的生物学影响。方法:采用免疫组织化学方法、逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)检测73例甲状腺癌组织及距其癌组织边缘5 cm以上的镜下未见浸润的正常组织中蛋白、mRNA的表达情况。通过脂质体介导将Wip1基因siRNA瞬时转染甲状腺乳头状癌K1细胞,采用RT-PCR及Western blot检测转染后K1细胞内Wip1基因的表达水平,MTT比色法及流式细胞术(FCM)观察细胞增殖、凋亡、周期变化情况。结果:Wip1蛋白在甲状腺癌组织及正常甲状腺组织中的表达阳性率分别为80.8%、9.6%,较正常甲状腺组织明显升高(χ2=47.036,P<0.05)。Wip1 mRNA在甲状腺癌组织及正常甲状腺组织中的表达相对量分别为0.665±0.046、0.225±0.039,较正常甲状腺组织明显升高(t=12.637,P<0.05)。Wip1蛋白、mRNA表达与甲状腺癌患者性别、年龄及肿瘤大小无关(P>0.05),而与淋巴结转移、肿瘤临床分期及肿瘤分化有关(P<0.05)。RT-PCR及Western blot证实,siRNA沉默的K1细胞中Wip1 mRNA、蛋白的表达水平较未转染组明显降低(t=17.039,t=14.637,P<0.05)。MTT、细胞凋亡及周期结果表明,siRNA沉默的K1细胞其增殖能力明显减弱、细胞凋亡明显增加,G0+G1期细胞数比例升高,而G2+M期和S期细胞数比例降低(P<0.05)。结论:甲状腺癌组织中Wip1蛋白和mRNA的表达均升高,且与甲状腺癌淋巴结转移、肿瘤临床分期以及肿瘤分化有关,Wip1参与甲状腺癌细胞增殖、凋亡、周期这一生物学过程。
Wip1 甲状腺肿瘤 逆转录聚合酶连反应 Western blot免疫组织化学法
甲状腺癌是女性较常见的头颈部恶性肿瘤之一,目前其主要治疗手段为手术+131I+甲状腺激素替代治疗[1],而生物学治疗手段亟需提高。因此分析甲状腺癌的生物学特性,探索治疗的新途径成为临床关注的问题。近年研究发现野生型p53诱导的磷酸酶1(wild-type p53-induced phosphatase 1,Wip1)基因在某些肿瘤中表现的生物学和遗传学特征具有肿瘤原癌基因的特性,由此推测Wip1在甲状腺癌形成和发展中的作用具有重要意义[2]。本研究采用免疫组织化学方法和逆转录聚合酶链反应(reverse transcription polymerase chine reaction,RT-PCR)研究Wip1在甲状腺癌中的表达情况,并通过改变Wip1表达含量的方法分析其对甲状腺癌细胞生物学行为的影响,以期为今后的临床治疗找到新的基因靶点。
1 材料与方法
1.1 材料
1.1.1 临床资料 前瞻性分析2008年5月至2012年12月期间唐山市工人医院手术切除的73例新鲜甲状腺癌标本(所有入组病例均取得受试者知情同意书,并通过相关伦理委员会批准),分别于肿瘤组织及距肿瘤边缘5 cm以上(镜下未见癌)的正常甲状腺组织处取材。男性18例,女性55例;年龄29~74岁,中位年龄38岁。其中年龄≤40岁54例,>40岁19例;肿瘤直径≤4 cm 27例,>4 cm 46例;高中分化24例,中低分化49例;淋巴结转移:N0 23例,N+50例;临床分期:Ⅰ+Ⅱ期22例,Ⅲ+Ⅳ期51例。全组患者术前均未经放、化疗,标本均为术后立即取材,于液氮中保存。
1.1.2 细胞株及试剂 甲状腺乳头状癌K1细胞株购自欧洲细胞培养中心(CAMR,Salisbury,英国)。Wip1兔抗人单克隆抗体(美国Epitomics公司),GAPDH鼠抗人单克隆抗体免疫组织化学试剂盒(北京中杉金桥生物技术公司),RNATrizol提取试剂盒(中国索莱宝公司),Super ScriptⅡ逆转录试剂盒(美国Invitrogen公司),PCR扩增试剂盒(加拿大Fermentas公司)。
Lipofectimane 2000脂质体转染试剂盒(美国Invitrogen公司),cDNA逆转录试剂盒(美国Invitrogen公司),细胞周期试剂盒、FITC-Annexin V凋亡试剂盒(中国BestBio公司)。
1.2 方法
1.2.1 Wip1 siRNA与细胞培养 根据NCBI数据库中Wip1基因序列和siRNA设计原则,由广州市锐博生物科技公司设计合成Wip1特异性siRNA链,序列为:正义链:5'-CCAAUGAAGAUGAGUUAUAd TdT-3';反义链:3'-dTdTGGUUACUUCUACUCAAUA U-5'。靶序列为CCAATGAAGATGAGTTATA,另外设计并合成与siRNA-Wip1基因组序列无同源性的阴性对照组siRNA-control,体外合成正义链和反义链RNA,并退火形成双链RNA。K1细胞培养基:DMEM∶Ham's F12∶MCDB105(2∶1∶1)+10%胎牛血清,置37℃、5%CO2及95%空气饱和湿度的恒温培养箱中培养。
1.2.2 细胞转染 转染前24 h分别取对数生长期K1细胞以5×104个/孔接种于6孔板,细胞融合度达30%~50%时将siRNA与Lipofectimane 2000脂质体的混合物按浓度100 nmol/L转染,并加入无血清Opti-MEM培养基培养,脂质体组按每孔仅加入含5 μL脂质体的Opti-MEM培养基,6 h后弃去培养基,加入含10%FBS的低糖DMEM培养基继续培养,48 h后,行RT-PCR及Western blot检测干扰效率。
1.2.3 免疫组织化学 将4 μm石蜡切片脱蜡至脱水,3%过氧化氢10 min阻断内源性过氧化物酶,胰酶修复20 min,10%山羊血清室温封闭20 min,滴加Wip1抗体(1∶100),湿盒中4℃冰箱过夜,滴加二抗及三抗,室温湿盒内孵育各20 min,DAB显色,苏木精复染,常规脱水,封片。细胞计数在显微镜(×200)下,每张切片上随机选择5个视野,每个标本计数3张切片。Wip1表达以细胞阳性百分率及细胞染色强度得分之和进行判定。细胞阳性百分率分为4个等级:≤5%计0分,5%~25%计1分,25%~50%计2分,>50%计3分;细胞染色强度分数标准:无染色记0分,弱染色(浅黄色)计1分,中等染色(黄褐色)计2分,强染色(棕黄色)计3分。两项标准相加:0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性(++),5~6分为强阳性(+++)。以PBS替代一抗作为阴性对照。
1.2.4 RT-PCR 总RNA提取:按Trizol试剂说明书要求,提取总RNA。逆转录:取2 μg总RNA,按SuperscriptⅡ逆转录试剂盒说明书要求操作合成cDNA,20 μL反应体系;反应条件为:变性65℃5 min,逆转录50℃50 min。PCR扩增Wip1基因上游引物为5'-GTTCGTAGCAATGCCTTCTCA-3',下游引物为5'-CACTTTCTTGGGCTTTCATTTG-3';GAPDH为内参照,上游引物为5'-CCGACCTGCCCTACGACTA-3',下游引物为5'-CTGGGCTGTAACATCTCCCTT-3'。PCR反应体系50 μL包括:5 μL 10×PCR buffer,1 μL 10 mmoL dNTP,0.5 μL TaqDNA聚合酶,上下游引物各2 μL,1 μL模板cDNA,加ddH2O补足至50 μL。反应条件为:预变性95℃10 min,变性95℃30 s,退火56℃30 s,延伸72℃45 s,40个循环,置于4℃保存。PCR产物的检测及半定量:产物经1.5%琼脂糖凝胶电泳,结果经凝胶成像系统结合Multi Gauge V3.1进行光密度分析。
1.2.5 Western blot 提取肿瘤组织和细胞总蛋白。4℃,12 000 r/min离心20 min,取上清,-20℃备用。BCA蛋白定量试剂盒检测蛋白浓度,按每孔上样量50 μg进行SDS-PAGE电泳,稳压冰浴电转至硝酸纤维素膜上,5%脱脂牛奶封闭2 h,一抗孵育4℃过夜(Wip1 1∶500,GAPHD 1∶500),兔抗人红外荧光标记二抗(1∶20 000),Odyssey双色红外荧光扫描系统进行检测,计算蛋白相对值=蛋白A值/GAPDH A值。
1.2.6 MTT比色法 取处于对数生长期K1细胞,按5 000个/孔细胞,每孔体积200 μL接种于96孔培养板内。分别培养24、48、72、96 h后终止培养。终止培养前4 h,加入5 mg/mL MTT溶液20 μL,继续培养4 h,除去每孔中培养基,加入DMSO 200 μL/孔,振荡至结晶溶解。全自动酶标仪检测各孔吸光度D值,检测波长490 nm,参考波长620 nm。
1.2.7 细胞凋亡及细胞周期 取处于对数生长期K1细胞及转染Wip1 siRNA后K1细胞。细胞凋亡:消化、收集细胞,用4℃预冷的PBS洗细胞2次,以1 mL结合缓冲液重新悬浮细胞,使其浓度为1×106,将100 μL的细胞悬液加入5 mL流式管中,每管加入5 μL Annexin V-FITC和10~120 μg/mL的碘化丙啶,避光均匀15 min,采用流式细胞仪上机检测。细胞周期:消化、收集细胞,70%预冷的乙醇固定细胞,过夜后离心收集细胞,并以1 mL的PBS洗涤细胞,加入100 μg/mL RNase A 37℃孵育30 min,加入500 μL碘化丙啶染色液4℃避光孵育30 min,计数3×104个细胞,按标准程序流式细胞仪检测细胞周期。
1.3 统计学方法
2 结果
2.1 免疫组织化学及RT-PCR
正常甲状腺滤泡上皮细胞中,Wip1免疫组织化学染色阴性或微弱(图1A),甲状腺癌组织Wip1阳性表达主要位于细胞核或细胞质(图1B)。甲状腺癌组织和正常甲状腺组织其阳性表达率分别为80.8%(59/73)及9.6%(7/73),两组间比较差异有统计学意义(χ2=47.036,P<0.05,表1)。Wip1 mRNA在甲状腺癌组织的表达量为0.665±0.046,高于正常甲状腺组织(0.225±0.039),两组间比较差异有统计学意义(t= 12.637,P<0.05,图2)。临床因素分析表明,Wip1蛋白、mRNA表达与甲状腺癌患者性别、年龄、肿瘤大小无关(P>0.05,表2);有无淋巴结转移、肿瘤临床分期以及肿瘤分化中的表达差异有统计学意义(P<0.05,表2)。
2.2 Wip1 siRNA转染后鉴定
转染48 h后观察Wip1 siRNA的转染效率在80%以上。RT-PCR结果表明,siRNA沉默的K1细胞中Wip1 mRNA表达的相对含量为0.313±0.023,而空白转染组K1细胞Wip1 mRNA的相对含量为0.725± 0.035,两组间比较差异有统计学意义(t=17.039,P<0.05,图3A)。Western blot结果表明,siRNA沉默的K1细胞中Wip1蛋白表达的相对含量为(0.376± 0.035),而空白转染组K1细胞Wip1蛋白的相对含量为0.838±0.042,两组间比较差异有统计学意义(t=14.637,P<0.05,图3B)。
2.3 细胞增殖、细胞凋亡及细胞周期
MTT检测结果表明,转染Wip1 siRNA 48 h后,与空白转染组K1细胞的细胞存活率相比,转染Wip1 siRNA K1细胞的存活率下调,两组间比较差异有统计学意义(t=10.014,P<0.05,图4)。细胞凋亡结果表明,转染Wip1 siRNA 48 h后,与空白转染组K1细胞的早期细胞凋亡比率(2.2±0.3)%相比,转染Wip1 siRNA K1细胞早期凋亡比率上调[(9.6±0.7)%],两组间比较差异有统计学意义(t=16.830,P<0.05,图5)。细胞周期结果表明,转染Wip1 siRNA 48 h后,空白转染组K1细胞的G0+G1期细胞数比例为(45.8± 2.5)%,G2+M期为(28.5±1.6)%,S期为(26.5± 1.3)%;而转染Wip1 siRNA K1细胞的G0+G1期细胞数比例为(64.6±3.2)%,G2+M期(17.0±1.1)%,S期为(18.1±0.5)%,两组间相比,差异有统计学意义(t= 7.972、3.079、10.446,P<0.05)。

图1 免疫组织化学方法检测Wip1蛋白在甲状腺癌组织及正常组织中的表达(SP×200)Figure 1 Protein expression of Wip1 in thyroid carcinoma and normal tissue was detected by immunohistochemistry(SP×200)

表1 Wip1蛋白在甲状腺癌组织及正常甲状腺组织中的表达Table 1 Expressions of Wip1 in thyroid carcinoma tissue and normal tissue
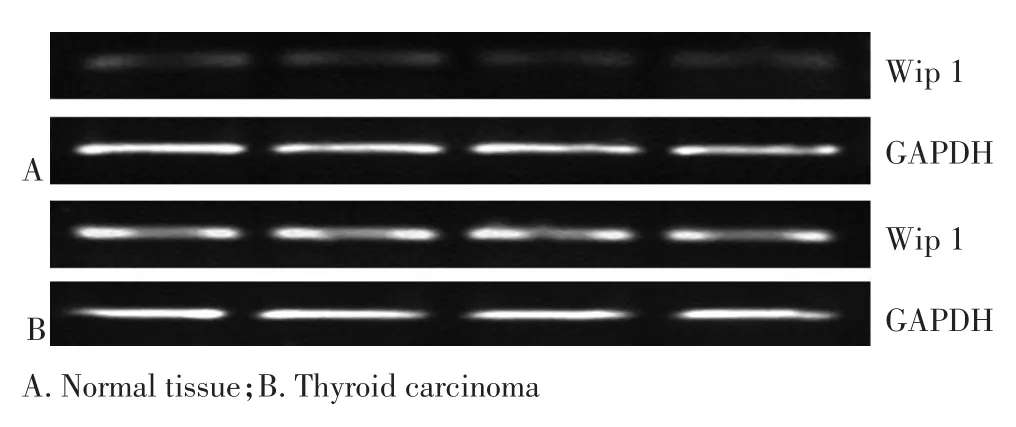
图2 RT-PCR方法检测Wip1 mRNA在甲状腺癌组织及正常组织中的表达Figure 2 mRNA expression of Wip1 in thyroid carcinoma and normal tissue detected by RT-PCR method

表2 Wip1蛋白表达与甲状腺癌临床特征间的关系Table 2 Relation between Wip1 expression and clinical characteristics in thyroid carcinoma
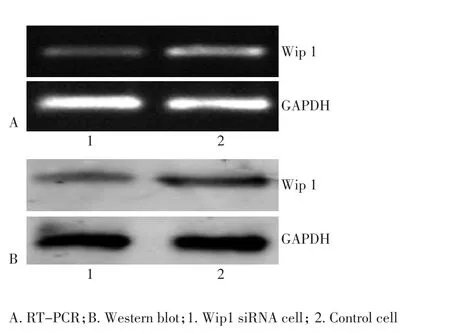
图3 RT-PCR、Western blot鉴定Wip1 mRNA及蛋白的表达Figure 3 Expression and identification of the Wip1 gene by siRNA-targeting Wip1
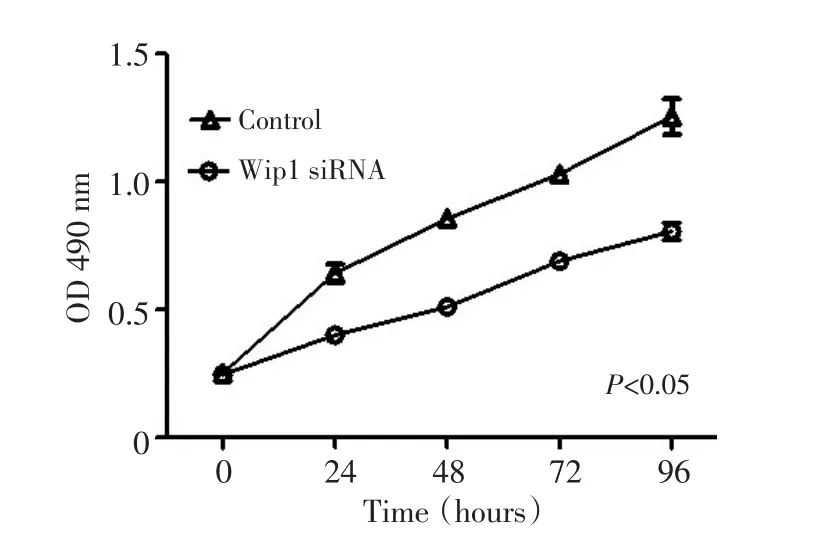
图4 MTT法检测Wip1 siRNA对K1细胞增殖的影响Figure 4 Effect of Wip1 siRNA on cell proliferation

图5 流式细胞术检测Wip1 siRNA对K1细胞凋亡的影响Figure 5 Cell apoptosis was analyzed by flow cytometry using Annexin V-FITC/PI staining
3 讨论
Wip1是一种具有丝/苏氨酸酶活性的蛋白磷酸酶,位于人染色体17q22/q24区域,人Wip1蛋白分子量约61 kD,由605个氨基酸组成。近年来,研究相继发现Wip1在乳腺癌[3]、神经母细胞瘤[4]、髓母细胞瘤[5]等肿瘤中高表达,并能通过p38MAPK/p53信号通路对p53起负反馈调控,导致p53表达下降及诱导p53突变,与患者预后密切相关[6]。
本研究首次用免疫组织化学法和RT-PCR技术对甲状腺癌组织及正常甲状腺组织进行定位及定量检测,结果显示Wip1蛋白、mRNA在甲状腺癌组织中的表达水平均显著高于正常甲状腺组织,取得了一致结果,提示与Wip1在多形性胶质母细胞瘤[7]、室管膜瘤[8]、甲状腺癌乳头状癌[9]、结直肠癌[2]等组织中的表达水平明显高于其正常组织的结果一致。本组结果的单因素分析也显示,Wip1蛋白、mRNA的表达水平与癌组织有无淋巴结转移,临床分期及肿瘤分化有关,但与甲状腺癌患者性别、年龄、肿瘤大小无关。有研究[9]结果提示Wip1蛋白表达水平与甲状腺癌乳头状癌患者的年龄、性别、肿瘤大小无关。DNA损伤时,共济失调-毛细血管扩张突变基因(ataxia-telangiectasia-mutated,ATM)使Chk2磷酸化,阻止肿瘤的发生。而Wip1与Chk2结合使其去磷酸化失活,导致肿瘤的发生。体内、外实验证实Wip1也可以抑制Chk1去磷酸化失活导致肿瘤的发生[10]。进一步研究证实Wip1高表达打破了以p38 MAPK-p53-Wip1途径维持的内环境稳态,通过p38 MAPK蛋白去磷酸化作用导致下游Wnt-p53蛋白失活,以及降低p16蛋白水平促进人乳腺细胞的恶性发生[9]。本研究进一步体外实验首次发现:siRNA沉默的甲状腺癌K1细胞其增殖能力明显减弱、细胞凋亡明显升高,G0+G1期细胞数比例增加,而G2+M期和S期减少。有研究通过siRNA技术沉默胶母细胞瘤细胞株U251中高表达Wip1达到抑制肿瘤细胞增殖的目的[11]。有研究发现,通过RNAi技术沉默髓母细胞瘤D283细胞高表达的Wip1,使P53表达增高,能够诱导肿瘤细胞凋亡增加[8]。另有研究发现,通过脂质体介导将Wip1 siRNA瞬时转染肺腺癌A549细胞,其G1期细胞比例增加,S期细胞比例降低[12],并分析这可能与Wip1在NF-κB、Notch、Wnt的信号通路中发挥广泛作用有关,这些通路在细胞增殖、细胞凋亡、周期转换、血管生成以及上皮细胞间质化中起了重要的作用[13-15]。
综上所述,本研究结果提示,甲状腺癌组织中Wip1蛋白和mRNA的表达均升高,且与甲状腺癌淋巴结转移以及肿瘤临床分期有关。Wip1参与甲状腺癌细胞增殖、凋亡、周期这一生物学过程。
1 Ya MH.Interpretation of the management guidelines for patients with thyroid nodules and differentiated thyroid cancer(2012 Chinese edition)[J].J Clin Otorhinolaryngol Head Neck Surg,2013,27 (16):917-920.[亚明宏.2012年中国版《甲状腺结节和分化型甲状腺癌诊治指南》解读[J].临床耳鼻咽喉头颈外科杂志,2013,27(16):917-920.]
2 Li ZT,Zhang L,Gao XZ,et al.Expression and Significance of the Wip1 Proto-oncogene in Colorectal Cancer[J].Asian Pac J Cancer Prev,2013,14(3):1975-1979.
3 Li J,Yang Y,Peng Y,et al.Oncogenic properties of PPM1D located within a breast cancer amplification epicenter at 17q23[J].Nat Genet, 2002,31(2):133-134.
4 Saito-Ohara F,Imoto I,Inoue J,et al.PPM1D is a potential target for 17q gain in neuroblastoma[J].Cancer Res,2003,63(8):1876-1883.
5 Mendrzyk F,Radlwimmer B,Joos S,et al.Genomic and protein expression profiling identifies CDK6 as novel independent prognostic marker in medulloblastoma[J].J Clin Oncol,2005,23(34):8853-8862.
6 Yang DH,He JA,Li J,et al.Expression of proto-oncogene Wipl in breast cancer and its clinical significance[J].Natl Med J Chin,2010, 90(8):519-522.[杨德华,何家安,李 剑,等.原癌基因Wip1在乳腺癌中的表达及其临床意义[J].中华医学杂志,2010,90(8):519-522.]
7 Liang CH,Jiao BH,Lu SK,et al.The Expression of proto-oncogene wip1 in human glioblastoma multiforme and cell lines[J].Chin J Neuro-oncol,2011,9(1):1-6.[梁朝辉,焦保华,卢圣奎,等.原癌基因Wip1在多形性胶质母细胞瘤及其细胞株中的表达及意义[J].中国神经肿瘤杂志,2011,9(1):1-6.]
8 Liang CH,Jiao BH,Guo EK,et al.Over-expression of proto-oncogene Wip1 in intracranial ependymomas association with P53[J]. Basic&Clinical Med,2011,31(4):430-434.[梁朝辉,焦保华,郭二坤,等.原癌基因Wip1在室管膜瘤中表达增加并与P53相关[J].基础医学与临床,2011,31(4):430-434.]
9 Yang DH,Zhang J,Hu XH,et al.Abnormality of p16/p38MAPK/ p53/Wip1 pathway in papillary thyroid cancer and its significance [J].Chin J General Surgery,2011,20(11):1199-1202.[杨德华,张浩,胡新华,等.甲状腺乳头状癌中p16/p53/p38MAPK/Wip1通路的改变及意义[J].中国普通外科杂志,2011,20(11):1199-1202.]
10 Oliva TM,B erthonaud V,Cheva lier A,et al.The Wip1 phosphatase(PPM1D)antagonizes activation of the Chk2 tumour suppressor kinase[J].Oncogene,2007,26(10):1449-1458.
11 Wang P,Rao J,Zhao HY,et al.Inhibitory effects of lentivirus meniated RNA interference targeting human Wip1 gene on the proliferation human U251 cells[J].Chin J Exp Surg,2010,27(4):76-79.[王 鹏,饶 竟,赵洪洋,等.慢病毒介导的RNA干扰沉默Wipl基因对人脑胶质母细胞瘤细胞生长的影响[J].中华实验外科杂志, 2010,27(4):76-79.]
12 Wang DX,Sun L,Lu JJ,et al.Effects of RNA interference targeting human Wip1 gene on the human lung adinocarcinoma cells[J]. Guangdong Med J,2012,33(21):3212-3214.[汪旭东,孙 磊,鲁建军,等.siRNA沉默Wip1基因对人肺腺癌细胞的影响[J].广东医学, 2012,33(21):3212-3214.]
13 Lowe JM,Cha H,Yang Q,et al.Nuclear factor-kappaB(NF-kappaB)is a novel positive transcriptional regulator of the oncogenic Wip1 phosphatase[J].J Biol Chem,2010,285(8):5249-5257.
14 Armstrong NJ,Fagotto F,Pthmann C,et al.Maternal Wnt/ β-catenin signaling coactivates transcription through NF-κB binding sites during Xenopus axis ormation[J].PLoS One,2012,7(5):e36136.
15 Pan H,Zhou W,He W,et al.Genistein inhibits MDA-MB-231 triple-negative breast cancer cell growth by inhibiting NF-kappaB activity via the Notch-1 pathway[J].Int J Mol Med,2012,30(2):337-343.
(2014-03-05收稿)
(2014-04-21修回)
(本文编辑:邢颖)
Expression and clinical significance of Wip1 in thyroid carcinoma and biological effect of siRNAtargeting Wip1 on its cell line
Wenjun ZHANG1,Lichun ZHENG1,Xiaoming ZHANG1,Anqing XIA2,Yaojie HU3,Lianhai CHAI4
Wenjun ZHANG;E-mail:wenjun_zhang2014@163.com
1Department of Nuclear Medicine,2Pathology Division,3Department of Head and Ncek Surgery,4Experimental Center,Tangshan Worker's Hospital,Tangshan 063000,China.
Objective:To investigate the expression and clinical significance of wild-type p53-induced phosphatase 1(Wip1)in thyroid carcinoma and biological effect of siRNA-targeting Wip1 on the thyroid carcinoma cell line.Methods:Immunohistochemistry and reverse transcription polymerase chain reaction(RT-PCR)were performed to detect the expression of Wip1 in 73 specimens of thyroid carcinoma tissues and normal thyroid tissues(5 cm away from the margin of thyroid carcinoma),respectively.Wip1 siRNA was transiently transfected into the papillary thyroid carcinoma cell by using a liposome-mediated method and then detected by RT-PCR and Western blot.Methyl thiazolyl tetrazolium(MTT)assay and flow cytometry(FCM)were also conducted to observe cell proliferation, cell apoptosis,and cell cycle.Results:The positive rates of Wip1 protein were 80.8%in thyroid carcinoma tissues and 9.6%in the normal tissues(χ2=47.036,P<0.05).The relative mRNA contents of Wip1 were 0.665±0.046 and 0.225±0.039 in carcinoma and normal tissues,respectively;these results significantly differed between the two types(t=12.637,P<0.05).Significant correlation was not observed between Wip1 expression and other factors,such as patient's gender,age,and tumor size(P>0.05).However,significant correlations among Wip1 expression,lymph node metastasis,clinical stages and tumor differentiation(P<0.05)were observed.RT-PCR and Western blot results showed that K1 cell-transfected Wip1 siRNA exhibited a relatively lower expression than normal cells(t=17.039,t= 14.637,P<0.05).MTT assay results showed that the K1 cells transfected with Wip1 siRNA showed a lower survival fraction,higher cell apoptosis,higher percentage of G0/G1phases,and lower cell concentration in G2/M and S phases(P<0.05).Conclusion:Wip1 protein and mRNA were increased in thyroid carcinoma and are correlated with lymph node metastasis,clinical stages and tumor differentiation.Wip1 may be involved in proliferation,apoptosis,and cycle of thyroid cancer cells.
Wip1,thyroid carcinoma,RT-PCR,Western blot,immunohistochemistry

10.3969/j.issn.1000-8179.20140291
①唐山市工人医院同位素科(河北省唐山市063000);②实验中心;③病理科;④头颈外科
张文军 wenjun_zhang2014@163.com
张文军 专业方向为甲状腺癌同位素治疗。
E-mail:wenjun_zhang2014@163.com

