谷胱甘肽转移酶P1基因多态性与儿童ALL HD-MTX不良反应的关系*
任艳飞 袁秀丽 岳丽杰 邹泽巧 谢 偲 丁 慧 宋 萍刘 畅
谷胱甘肽转移酶P1基因多态性与儿童ALL HD-MTX不良反应的关系*
任艳飞①袁秀丽②岳丽杰①邹泽巧①谢 偲①丁 慧①宋 萍③刘 畅①
目的:研究谷胱甘肽转移酶P1(glutathione S-transferase pi,GSTP1)基因多态性与儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)使用大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)化疗后不良反应的关系。方法:应用巢式PCR(Nest PCR)、变性梯度凝胶电泳(denaturing gel gradient electrophoresis,DGGE)和DNA直接测序技术检测51例儿童ALL GSTP1基因型和等位基因分布频率,按美国国立癌症研究所的常规毒性判定标准(NCICTCAE)对HD-MTX不良反应进行统计分析。结果:筛查出3个GSTP1 SNPs位点即rs1695(A313G)、rs1138272(G439T)和rs4891(T555C)。rs1695/rs4891多态性位点包括32例(62.7%)野生型、16例(31.4%)杂合型和3例(5.9%)纯合型,rs1138272多态性位点仅包括1例(2.0%)杂合型和1例(2.0%)纯合型。3个SNPs位点等位基因频率分别为21.6%、2.9%和21.6%。GSTP1 rs1695/rs4891多态性位点中AG+GG/TC+CC基因型与外周血血红蛋白减少有关(OR=0.25,95%CI=0.06~1.00,P=0.049),GSTP1 rs1695/rs4891多态性位点中AG+GG/TC+CC基因型与高危组患儿胃肠毒性发生有关(OR=0.125,95%CI=0.02~0.78,P=0.026)。结论:GSTP1 rs1695/rs4891多态性与ALL儿童HD-MTX化疗后外周血血红蛋白降低以及中高危组ALL儿童发生胃肠毒性有关。
谷胱甘肽转移酶 基因多态性 急性淋巴细胞白血病 甲氨蝶呤 不良反应
大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)在儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)治疗和长期生存中发挥重要作用,尤其是在常规预防髓外白血病中,已成为儿童ALL治疗成功的关键。与此同时,ALL儿童应用HD-MTX后出现的各种不良反应仍是导致化疗中断最常见的原因之一,有证据表明甲氨蝶呤(methotrexate,MTX)相关不良反应的发生受多种药物代谢酶基因多态性的影响[1],本课题组已对丝氨酸羟甲基转移酶(serine hydroxymethyltransferase 1,SHMT1)[2]、胸苷酸合成酶(thymidylate synthase,TS)[3]、亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)[4]等药物代谢酶基因多态性进行详细探讨。本研究针对51例ALL儿童的谷胱甘肽转移酶P1(glutathione S-transferase pi,GSTP1)基因型和等位基因分布频率进行检测,并分析GSTP1多态性与ALL儿童HD-MTX不良反应之间的关系。
1 材料与方法
1.1 研究对象
2007年1月至2013年12月在深圳市儿童医院血液科确诊的急性淋巴细胞白血病儿童51例;其中男33例,女18例,初诊年龄为1~13岁,中位年龄为4.5岁。包括B-ALL儿童47例,T-ALL儿童4例。临床危险度分型包括标危ALL23例,中危ALL18例,高危ALL10例。诊断及分型参照国内儿童ALL诊断标准[5]。51例ALL患儿中有43例接受GZ-2002-ALL化疗方案,8例接受GD-2008-ALL化疗方案,且均完成了髓外白血病的预防性化疗方案。标危和中危患儿(除T-ALL患儿)接受4轮HD-MTX(2~3 g/m2)治疗,高危患儿(包括T-ALL患儿)接受2轮HD-MTX(5 g/m2)治疗。在接受HD-MTX治疗前检查患儿一般情况有无严重感染;血常规、肝肾功能、心电图、心肌酶是否正常,均符合标准后方能进行化疗。在接受HD-MTX化疗同时,每晚口服6-巯基嘌呤(6-MP)25~50 mg/m2预防呕吐;用药结束后36h行甲酰四氢叶酸钙解救(15 mg/m2),每6h静脉注射一次,共6~8次,用以降低MTX毒副作用。患儿化疗期间每日行0.1%洗必泰溶液漱口、0.05%利凡诺坐浴,用于预防口腔黏膜及肛周感染;每日思密达含漱后口服用于保护消化道黏膜。
1.2 标本采集
经深圳市儿童医院医学伦理委员会审核通过及患儿监护人同意并签字后,于ALL儿童化疗及输血前抽取1~1.5 mL骨髓液。用QIAamp mRNA Blood-Mini Kit(QIAGEN公司,德国)抽提总RNA后,Reverse Transcriptase XL试剂盒(大连宝生物公司)逆转录获得cDNA,-20℃分装保存。
1.3 方法
1.3.1 ALL儿童GSTP1多态性筛查 1)巢式PCR扩增:利用Primer 5.0软件自行设计引物[包括扩增GSTP1(基因库登录号:NM_000852)全编码区的引物和巢式PCR引物],并在T professional Std Gradient 96扩增仪(Biometra公司,德国)上进行PCR扩增;PCR扩增体系和条件见文献[6]。2)琼脂糖凝胶电泳:将各扩增产物与6×上样缓冲液(TaKaRa公司)混合后进行琼脂糖凝胶电泳,并在GDS800凝胶成像分析系统(UVP公司,美国)中拍照;3)变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)筛查及DNA测序:将上述出现清晰目的条带的样本进行DGGE筛查,具体实验步骤见文献[6],发现异常条带的样本送上海英潍捷基公司进行测序。利用Chromas软件分析测序结果。
1.3.2 MTX不良反应统计指标 本研究HD-MTX不良反应观察时期为每轮HD-MTX化疗期间或化疗后14天内进行评估,HD-MTX不良反应分级标准参照美国国立癌症研究所的第3版常规毒性判定标准(NCICTCAE,version 3.0)。删除HD-MTX不良反应包括骨髓抑制(外周血中性粒细胞、血红蛋白、血小板等减少)、肝肾毒性(血清ALT、AST、肌酐、尿素氮等升高)、消化道毒性(恶心、呕吐、腹痛、腹泻等)、神经毒性(情绪障碍、头痛、失眠、惊厥等)、心脏毒性(心率、心律、心功能、心肌酶升高等)和口腔黏膜损伤情况。
1.4 统计学分析
用SPSS 13.0软件进行数据统计分析。用基因计数法统计ALL儿童GSTP1多态性位点的基因型和等位基因分布频率;用χ2检验(Chi-square Test)判定该多态性基因型和等位基因频率是否符合Hardy-Weinberg遗传平衡;用Logistic回归分析儿童ALL GSTP1多态性与HD-MTX不良反应间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 HD-MTX相关不良反应及分级
参照NCICTCAE,version 3.0,本研究中51例ALL儿童接受HD-MTX化疗后出现的主要不良反应及分级情况见表1。治疗期间ALL儿童均未出现死亡病例。
2.2 ALL儿童GSTP1多态性筛查结果
经巢式PCR扩增、DGGE筛查和DNA测序对51例ALL儿童GSTP1全编码区多态性进行筛查,共发现3个SNPs位点即rs1695(A313G)、rs1138272(G439T)和rs4891(T555C)。3个多态性位点的基因型和等位基因分布频率均符合Hardy-Weinberg遗传平衡(P>0.05)。rs1695和rs4891两个多态性位点的基因型及等位基因分布频率相同,包括野生型32例(62.7%)、杂合型16例(31.4%)和纯合型3例(5.9%),G/C等位基因频率为21.6%。rs1138272(G439T)位点仅筛查出1例GT杂合型(2.0%)和1例TT纯合型(2.0%),其余均为GG野生型,其T等位基因频率为2.9%。由于rs1138272多态性位点突变例数较少(仅2例),故不对该位点多态性进行不良反应分析。3个SNPs位点DGGE图和DNA测序结果见图1和图2。

表1 51例ALL患儿HD-MTX治疗后的不良反应 例(%)Table 1 Toxicities in 51 ALL children treated with HD-MTX n%

图1 GSTP1 rs1695、rs4986949、rs4891多态性DGGE图Figure 1 DGGE diagram of rs1695,rs4986949,and rs4891 polymorphisms of GSTP1
2.3 GSTP1多态性与HD-MTX不良反应的关系
本研究将出现HD-MTX相关不良反应包括骨髓抑制(外周血中性粒细胞、血红蛋白和血小板减少)(≥2级[7])、消化道毒性(≥2级[7])、口腔黏膜损伤(≥2级[7])和肝脏毒性(≥1级[3])与GSTP1 rs1695/rs4891多态性比较分析,发现GSTP1 rs1695/rs4891多态性位点中AG+GG/TC+CC基因型与外周血血红蛋白减少有关(OR=0.25,95%CI=0.06~1.00,P=0.049),结果见表2;除此之外,rs1695/rs4891各基因型与ALL儿童HD-MTX其他不良反应(包括外周血中性粒细胞减少、血小板减少、肝脏毒性、胃肠毒性和口腔黏膜损伤,此处不良反应指除血红蛋白减少以外的不良反应)间不存在相关性(P>0.05)。
中高危患儿GSTP1 rs1695/rs4891多态性位点中AG+GG/TC+CC基因型和野生型发生胃肠毒性的频率分别为20.0%和66.7%,两者间差异性具有统计学意义(P=0.018)。并且,携带rs1695/rs4891多态性位点中AG/TC基因型和AG+GG/TC+CC基因型的ALL儿童发生胃肠毒性的可能性是野生型的0.143倍(OR=0.143,95%CI=0.02~0.91,P=0.039)和0.125倍(OR=0.125,95%CI=0.02~0.78,P=0.026)。而标危组和中高危组的其他不良反应与GSTP1 rs1695/rs4891各基因型无相关性(表3,4)。

图2 GSTP1 rs1695、rs4986949、rs4891多态性DNA测序图Figure 2 DNA sequencing diagram of rs1695,rs4986949,and rs4891 polymorphisms of GSTP1
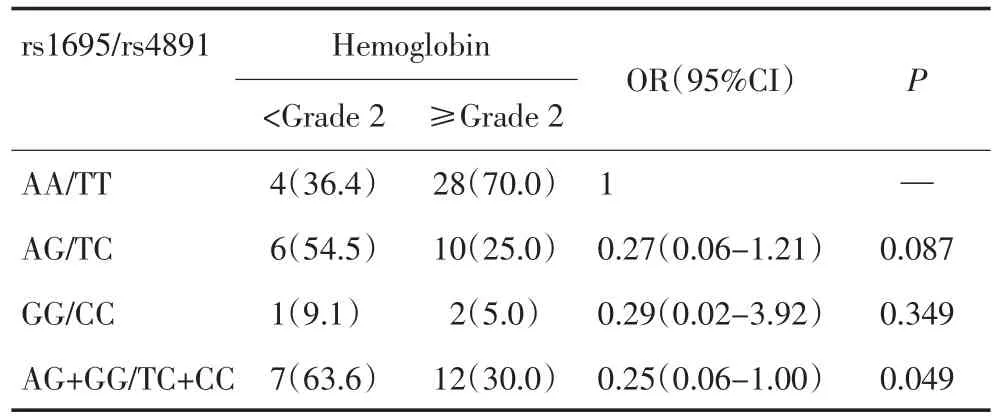
表2 51例ALL患儿GSTP1 rs1695/rs4891与HD-MTX引起的血红蛋白减少的关系 例(%)Table 2 Association between GSTP1 rs1695/rs4891 genotype and HD-MTX-related hemoglobin in 51 children with ALL n%
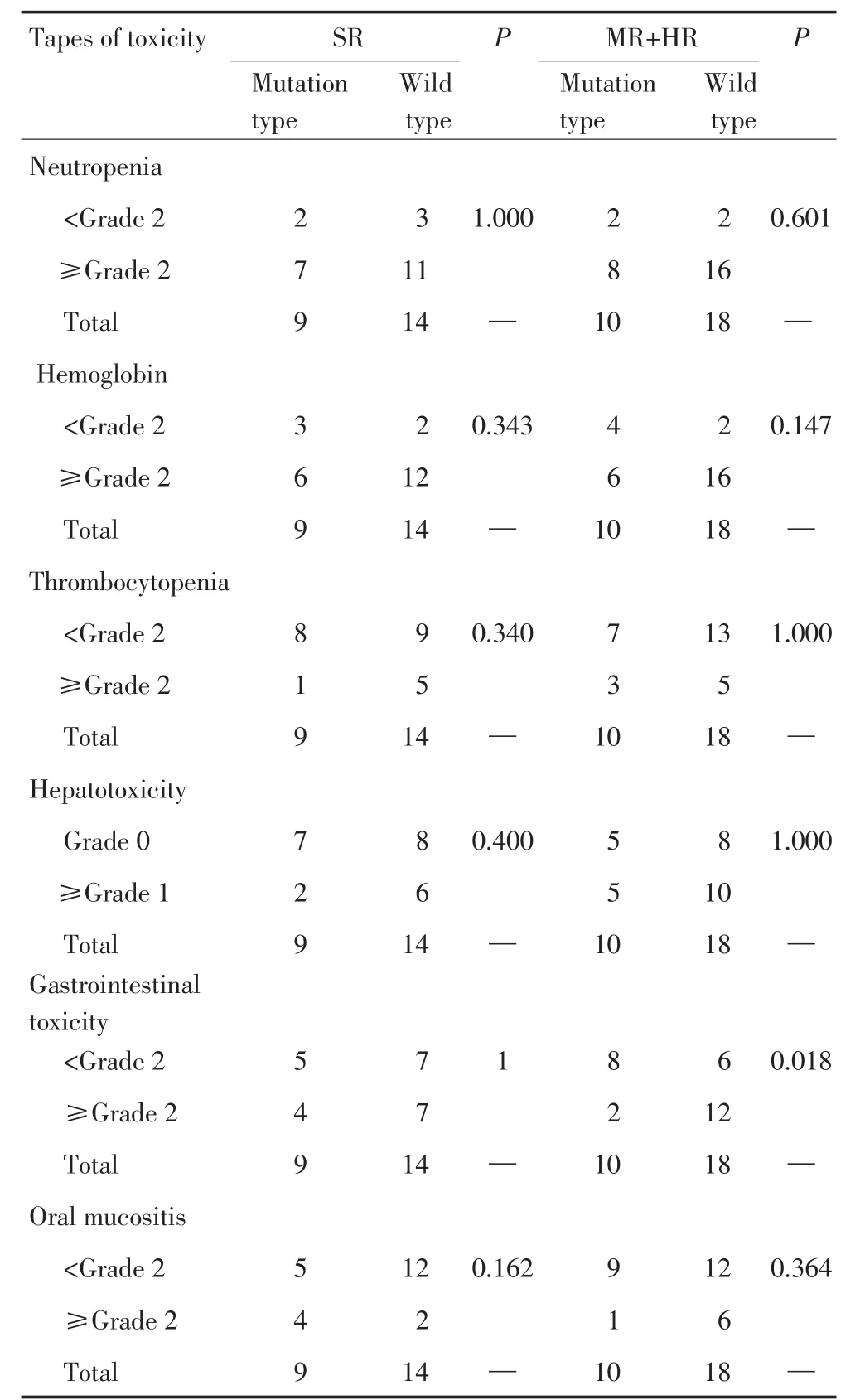
表3 GSTP1 rs1695/rs4891突变基因型与HD-MTX不良反应的关系Table 3 Association between GSTP1 rs1695/rs4891 mutation genotype and HD-MTX-related toxicity
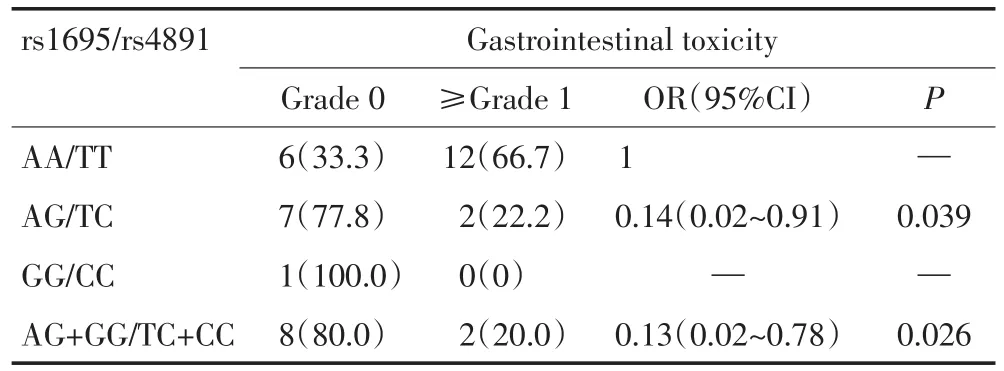
表4 中高危ALL患儿GSTP1 rs1695/rs4891与HD-MTX引起的胃肠毒性关系 例(%)Table 4 Association between GSTP1 rs1695/rs4891 genotype and HD-MTX-related gastrointestinal toxicity in intermediate-risk and high-risk children with ALL n%
3 讨论
谷胱甘肽转移酶P1(glutathione s-transferases pi,GSTP1)在多种肿瘤细胞表面高表达,是参与儿童ALL化疗药物MTX代谢的一类重要的Ⅱ相解毒代谢酶。通过催化亲电子性药物(如MTX)与谷胱甘肽(GSH)等亲水性底物结合,降低GSH复合物毒性而发挥解毒作用。HD-MTX对处于对数增殖期的细胞具有较强抑制作用,由于其作用无靶向性,对除肿瘤外的其他增殖期细胞同样具有杀伤作用,故在临床上表现为一系列不良反应,包括骨髓抑制、肝、肾及胃肠毒性、口腔黏膜损伤和短暂或持续性神经毒性[8]。
本研究经DGGE和DNA直接测序方法共发现2个非同义突变rs1695(A313G)、rs1138272(G439T)和1个同义突变rs4891(T555C),目前国内尚未见到有关rs1138272和rs4891多态性位点的报道。这3个SNPs位点rs1695、rs1138272和rs4891等位基因在儿童ALL中的分布频率分别为21.6%、2.9%和21.6%。Huang等[9]对GSTP1多态性在儿童ALL中的分布进行Meta分析,发现rs1695等位基因突变频率在亚洲患儿中为23.8%,在白种患儿中为27.8%,与本研究结果相近,说明GSTP1 rs1695等位基因型分布无明显种族差异性(P>0.05)。另外,本研究结果显示rs1695与rs4891的基因型及等位基因频率均相同,参考Timofeeva等[10]对非同义突变rs1695和同义突变rs4891多态性的研究结论,推测rs4891和rs1695可能为高度连锁不平衡,故应扩大样本量和样本范围并做进一步讨论。
目前国内外有大量针对GSTP1多态性与儿童白血病发病、化疗敏感性关系的研究[9,11-13],但有关GSTP1多态性与儿童ALL化疗不良反应相关性的报道则较为少见,其中GSTP1多态性与儿童ALL化疗后出现骨髓抑制关系的研究尚未见有关报道。故本研究主要针对GSTP1 3个基因多态性rs1695、rs1138272和rs4891与ALL儿童HD-MTX化疗不良反应间相关性进行研究分析。
临床上骨髓抑制是HD-MTX化疗后不良反应中较为严重的一种,主要表现为中性粒细胞、血红蛋白和血小板的减少。本研究发现GSTP1 rs1695/rs4891多态性位点中AG+GG/TC+CC基因型对外周血血红蛋白起保护作用,有降低ALL儿童发生贫血不良反应的可能性(OR=0.25,95%CI=0.06~1.00,P=0.049);而HD-MTX其他相关不良反应与GSTP1各基因型则不具有相关性(P>0.05)。另外,本研究中高危组患儿携带GSTP1 rs1695/rs4891 AG+GG/TC+CC基因型者发生胃肠毒性的概率是野生型GSTP1的0.125倍(OR=0.125,95%CI=0.02~0.78,P=0.026)。对于中高危患儿而言,GSTP1 rs1695/rs4891 G/C基因可作为一项预防胃肠毒性发生的保护性因素。除此之外,其他ALL危险分组中的化疗不良反应和ALL儿童的其他HD-MTX不良反应如肝、胃肠毒性和口腔黏膜损伤均与GSTP1基因多态性无关(P>0.05)。目前Horinouchi等[14]日本学者针对24名ALL或淋巴母细胞瘤(lymphoblastic lymphoma,LBL)儿童 GSTP1 rs1695多态性与化疗肝毒性关系进行研究,发现在肝毒性组和无肝毒性组间无显著性差异,与本研究结果相似。
综上所述,GSTP1 rs1695/rs4891多态性与ALL儿童HD-MTX化疗后外周血血红蛋白降低以及中高危组ALL儿童发生胃肠毒性有关。但是,考虑到HD-MTX不良反应可能受多种药物代谢酶的共同影响及儿童ALL纳入样本量相对较少等多方面因素影响,本研究中GSTP1单核苷酸多态性与ALL儿童HD-MTX化疗后不良反应的发生及预后的关系仍需进一步深入调查研究。
1 Ongaro A,De Mattei M,Della Porta MG,et al.Gene polymorphisms in folate metabolizing enzymes in adult acute lymphoblastic leukemia:effects on methotrexate-related toxicity and survival[J]. Haematologica,2009,94(10):1391-1398.
2 Ding H,Yue LJ,Yu J,et al.Correlations between the polymorphisms of serine hydroxymethyl-transferase 1 gene and the adverse reactions of high-dose methotrexate in children with acute lymphoblastic leukemia[J].Chin J Clin Oncol,2014(3):162-165.[丁 慧,岳丽杰,于 洁,等.SHMT1多态性与ALL儿童HD-MTX不良反应的关系[J].中国肿瘤临床,2014(3):162-165.]
3 Yang CL,Yue LJ,Yu J,et al.Correlation between the polymorphism of thymidylate synthase gene and the toxicity of high dose MTX in childhood acute lymphoblastic leukemia[J].Chin J Clin Oncol,2013(7):384-388.[杨春兰,岳丽杰,于 洁,等.胸苷酸合成酶基因多态性与ALL儿童HD-MTX毒副作用的相关性[J].中国肿瘤临床,2013(7):384-388.]
4 Zheng MM,Yue LJ,Chen XW,et al.Relationship between the methylenetetrahydrofolate reductase gene polymorphism and adverse reactions of high-dose methotrexate in children with acute lymphocytic leukemia[J].Chinese Journal of Contemporary Pediatrics,2013(3):201-206.[郑苗苗,岳丽杰,陈小文,等.急性淋巴细胞白血病患儿MTHFR基因多态性与大剂量甲氨蝶呤毒副反应的关系[J].中国当代儿科杂志,2013(3):201-206.]
5 Yang TY,Zhang ZN,Shen T.Standard of the blood disease diagnosis and therapeutical effect[M].2nd Ed,Beijing:Sciences Press, 1998:168-214.[杨天楹,张之南,沈 悌.主编.血液病诊断及疗效标准[M].第2版,北京:科学出版社,1998:168-214.]
6 Zheng MM,Yue LJ,Zhang HH,et al.Association of single nucleotide polymorphism of methylenetetrahydrofolate reductase gene with susceptibility to acute leukemia[J].Chinese Journal of Medical Genetics,2013,30(4):451-455.[郑苗苗,岳丽杰,张洪洪,等.MTHFR基因多态性与急性白血病易感性的研究[J].中华医学遗传学杂志, 2013,30(4):451-455.]
7 Chen X,Wen F,Yue L,et al.Genetic polymorphism of gamma-glutamyl hydrolase in Chinese acute leukemia children and identification of a novel double nonsynonymous mutation[J].Pediatric Hematol Oncol,2012,29(4):303-312.
8 Liu SG,Li ZG,Cui L,et al.Effects of methylenetetrahydrofolate reductase gene polymorphisms on toxicities during consolidation therapy in pediatric acute lymphoblastic leukemia in a Chinese population[J].Leuk Lymphoma,2011,52(6):1030-1040.
9 Huang GZ,Shan W,Zeng L,et al.The GSTP1 A1578G polymorphism and the risk of childhood acute lymphoblastic leukemia:results from an updated meta-analysis[J].Genet Mol Res,2013,12 (3):2481-2491.
10 Timofeeva M,Kropp S,Sauter W,et al.Genetic polymorphisms of MPO,GSTT1,GSTM1,GSTP1,EPHX1 and NQO1 as risk factors of early-onset lung cancer[J].Int J Cancer,2010,127(7):1547-1561.
11 Borst L,Buchard A,Rosthoj S,et al.Gene dose effects of GSTM1, GSTT1 and GSTP1 polymorphisms on outcome in childhood acute lymphoblastic leukemia[J].J Pediat Hematol Oncol,2012,34 (1):38-42.
12 Sailaja K,Surekha D,Rao DN,et al.Association of the GSTP1 gene(Ile105Val)polymorphism with chronic myeloid leukemia[J]. Asian Pac J Cancer Prev,2010,11(2):461-464.
13 Dunna NR,Vuree S,Kagita S,et al.Association of GSTP1 gene (I105V)polymorphism with acute leukaemia[J].J Genet,2012,91 (1):e60-e63.
14 Horinouchi M,Yagi M,Imanishi H,et al.Association of genetic polymorphisms with hepatotoxicity in patients with childhood acute lymphoblastic leukemia or lymphoma[J].Pediatr Hematol Oncol,2010,27(5):344-354.
(2014-06-25收稿)
(2014-09-19修回)
(本文编辑:郑莉)
Association between glutathione S-transferase pi gene polymorphism and adverse reaction of high-dose methotrexate in children with acute lymphoblastic leukemia
Yanfei REN1,Xiuli YUAN2,Lijie YUE1,Zeqiao ZOU1,Cai XIE1,Hui DING1,Ping SONG3,Chang Liu1
Lijie YUE;E-mail:2376028869@qq.com
1Laboratory of Molecular Hematology,Shenzhen Institute of Pediatrics,Shenzhen Children's Hospital Affiliated to Zunyi Medical College,Shenzhen 518026;2Department of Hematology,3Department of Emergency,Shenzhen Children's Hospital,Shenzhen 518026,China.
This work was supported by the National Natural Science Foundation of China(No.30471830)and the Shenzhen Municipal Science and Technology Project(No.201101011).
Objective:To investigate the association between glutathione S-transferase pi(GSTP1)gene polymorphism and toxicities related to high-dose methotrexate(HD-MTX)in children with acute lymphoblastic leukemia(ALL).Methods:GSTP1 genotypes and allelic frequencies in 51 children with ALL were determined by Nest PCR,denaturing gel gradient electrophoresis(DGGE),and DNA sequencing.HD-MTX adverse reactions were analyzed using the National Cancer Institute Common Toxicity Criteria(NCICTC).Results:We identified three SNPs of GSTP1,including rs1695(A313G),rs1138272(G439T),and rs4891(T555C).The wild types,heterozygous types,and homozygous types of GSTP1 rs1695/rs4891 polymorphisms were detected in 32 cases(62.7%),16 cases(31.4%), and 3 cases(5.9%),respectively.GSTP1 rs1695/rs4891 polymorphisms included only one heterozygous type and one homozygous type. The allele frequencies of the three SNPs were 21.6%,2.9%,and 21.6%.The AG+GG/TC+CC genotype of GSTP1 rs1695/rs4891 was associated with decrease in the odds of peripheral hemoglobin(OR=0.25,95%CI=0.06-1.00,P=0.049).The AG+GG/TC+CC genotype of GSTP1 rs1695/rs4891 in standard and intermediate-risk ALL children was significantly correlated with higher odds of gastrointestinal toxicity(OR=0.125,95%CI=0.02-0.78,P=0.026).Conclusion:GSTP1 rs1695(A313G)/rs4891(T555C)gene polymorphism is associated with the reduction of peripheral hemoglobin inALL children and with the odds of gastrointestinal toxicity in standard and intermediate-riskALL children who receive high-dose methotrexate.
glutathione S-transferase pi,gene polymorphism,acute lymphoblastic leukemia,methotrexate,toxicity

10.3969/j.issn.1000-8179.20141070
①遵义医学院附属深圳市儿童医院儿科研究所(广东省深圳市518026);②血液科;③急诊科
*本文课题受国家自然科学基金项目(编号:30471830)和深圳市科技计划项目(编号:201101011)资助
岳丽杰 2376028869@qq.com
任艳飞 专业方向为儿童白血病化疗药物代谢酶的基因多态性研究。
E-mail:snyf.fei@163.com

