D-阿拉伯糖醇高产酵母菌株的快速筛选方法
钱卫东, 宁肖肖, 王 兰, 蔡长龙, 毛培宏, 李梦媛
(1.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 2.西安工业大学 光电工程学院, 陕西 西安 710021; 3.新疆大学 物理科学与技术学院, 新疆 乌鲁木齐 830046 )
0 引言
D-阿拉伯糖醇是一种五碳糖醇,分子式为C5H12O5,分子量为152.12,是木糖醇和核糖醇的同分异构体.糖醇是经糖还原的一类多元醇,具有低热值、抗龋齿、不影响胰岛素水平[1]等优点,在医药、食品、化工等领域具有重要的应用价值.
目前,常规生产D-阿拉伯糖醇的方法主要是化学法合成[2].但是该方法反应过程复杂、设备要求高、环境污染严重.针对化学合成法的缺点,人们将目光集中于通过生物转化法生产D-阿拉伯糖醇,因其反应条件温和、生产工艺简单而备受关注.
Spencer等[3]研究发现耐高渗酵母在高渗条件下可产生多元醇,代谢葡萄糖产生的多元醇主要有甘油、D-阿拉伯糖醇、赤醉糖醇等,其中五碳多元醇以D-阿拉伯糖醇为主[4].但是大部分产D-阿拉伯糖醇的酵母菌株对底物葡萄糖的转化率较低,并且普遍存在甘油及其它多元醇副产物.
乳酸克鲁维酵母具有营养要求极其简单、生物量大、生长温度适应范围广、分泌蛋白能力强、不产生内毒素[5,6]、生长旺盛等优点.因此,长期以来一直被用于发酵工业.
低能离子N+注入技术作为一种新的诱变源,目前在国内微生物育种方面已取得显著成效[7,8].低能离子注入生物体时,同时存在能量交换、能量沉积、质量沉积及电荷交换等四大效应.注入离子的电荷数、质量数、能量和剂量的组合不同,可以提供较多的诱变条件,使离子注入诱变具有突变谱宽、突变率高等特点,从而可以筛选到符合生产要求、提高产量的突变体[9-11].然而,低能N+离子注入技术转化的随机性较大,因此建立一种高通量的快速高通量筛选方法尤为重要.
1 材料与方法
1.1 菌株和培养基
1.1.1 菌株
乳酸克鲁维酵母(KluyveromyceslactisATCC12426),购自中国工业微生物菌种保藏管理中心.
1.1.2 培养基
(1)斜面培养基(g/L): 葡萄糖20,酵母膏10,蛋白胨20,琼脂20,121 ℃灭菌 20 min.
(2)种子培养基(g/L): 葡萄糖20, 酵母膏 10,蛋白胨 20,121 ℃灭菌 20 min.
(3)发酵培养基(g/L): 葡萄糖200,酵母膏10,蛋白胨20,硫酸铵3,七水硫酸镁0.2,121 ℃灭菌20 min.
1.2 低能N+离子注入
1.2.1 菌悬液的制备
将本实验室保藏的出发菌株(KluyveromyceslactisATCC12426)于斜面培养基上划线,置于37 ℃恒温培养24 h后,挑取单菌落接种到YPD液体培养基中,于37 ℃、160 r/min振荡培养18 h得到菌液.
1.2.2 菌膜制备
用无菌水将菌液稀释至1.0×107CFU/mL,取100μL菌体稀释液均匀涂布于无菌平皿中央,用无菌风吹干制成菌膜.
1.2.3 离子注入
将菌膜置于离子注入机的无菌靶台上,用能量为25 keV,不同剂量的离子束在10-3Pa真空状态下以10 s脉冲方式,进行离子注入.
1.2.4 重组菌株的预培养
经过步骤1.2.3后,用2 mL YPD液体培养基浸泡菌膜,37 ℃温育2 h,用无菌玻璃刮铲洗脱平皿上的菌膜,获得洗脱液;未注入的对照菌膜也作同样处理.用移液枪将洗脱液转移至装有5 mL液体培养基的试管中,于37 ℃、160 r/min振荡培养24 h.
1.3 高产菌株的初筛
D-阿拉伯糖醇高产菌株有耐高渗的特性,因此可以用高糖培养基进行初筛.
1.3.1 高糖培养基组分的确定
按照1.2.1制备出发菌株的菌悬液,吸取100μL菌悬液均匀涂布于葡萄糖浓度分别为30%、40%、50%、60%的固体培养基上.将培养基置于37 ℃恒温培养48 h,观察菌体的生长情况.
1.3.2 高糖培养基初筛
将1.2.4所得重组菌株的菌液涂布于高糖固体培养基上,于37 ℃恒温培养48 h,观察菌体生长情况.
1.4 高产菌株的复筛
D-阿拉伯糖醇产生菌株的复筛,采用纸色谱和高效液相色谱连用的方法.纸色谱具有设备简单、操作方便、所需样品少且灵敏度较高等优点,其对于大量菌体的筛选实验非常适合[12].
高效液相色谱[13]具有较高的准确性、速度快、分辨率高、灵敏度高等优点,适合对纸色谱法筛选结果进行验证实验.高效液相色谱的色谱条件为色谱柱:SH1011;流动相:0.01 mol/LH2SO4;流速:0.8 mL/min;进样量:5μL;柱温:50 ℃;检测器:示差检测器(RID).
1.4.1 标准溶液的配制
精密称取D-阿拉伯糖醇、甘油、葡萄糖等各0.100 0 g,分别装于10 mL容量瓶中,用蒸馏水定容至刻度,配成单组分质量浓度为1%的标准溶液.取2 mL的四种溶液混合均匀,即成混合标样.
1.4.2 样品的处理
从高糖筛选培养基上挑取生长情况较好的单菌落接入种子培养基中,37 ℃、160 r/min振荡培养24 h得种子液.将种子液按5%的接种量接种至发酵培养基中,置于37 ℃,160 r/min 连续发酵培养120 h得发酵液.取80 mL发酵液于100 mL离心管中,12 000 r/ min离心5 min,将上清液80 ℃浓缩至10 mL得到样品.
1.5 重组菌株的遗传稳定性试验
将1.4筛选出来的高产菌株以2%的接种量接入液体培养基中,于37 ℃、160 r/min传代培养8代,测定每代菌株发酵液中D-阿拉伯糖醇的产量.若每代菌株发酵液中D-阿拉伯糖醇的产量变化不大,则说明该菌株遗传稳定性高.
2 结果与讨论
2.1 离子注入剂量的选择
不同微生物细胞对诱变剂的敏感程度不同,只有在合适的剂量下才能获得理想的诱变效果.本研究首先考察了不同注入剂量对乳酸克鲁维酵母的影响.做出“马鞍型”曲线,如图1所示,存活率呈先下降再上升后下降的趋势.
研究表明,当以能量为25 keV、剂量低于2.0×1015ion/cm2离子注入Kluyveromyceslactis时,注入N+只对细胞表面造成损伤和刻蚀,存活率下降;随着注入剂量的增加,细胞表面刻蚀严重,存活率急剧下降;当注入剂量达到4.0×1015ion/cm2时,存活率下降到19%;随着注入剂量继续增加,可以激活细胞自身某种修复机制,存活率出现微幅回升;当剂量继续上升超过6.0×1015ion/cm2时,对细胞的破坏已经严重超出了细胞本身的修复能力,细胞死亡,存活率急剧下降.所以,离子注入的最佳能量为25keV,剂量为6.0×1015ion/cm2.

图1 氮离子注入乳酸克鲁维酵母 的存活率曲线
2.2 高产菌株的初筛
2.2.1 高糖培养基组分的确定
观察原始出发菌株在葡萄糖浓度分别为30%、40%、50%、60%的固体培养基上的生长情况如图2所示.由图2可知,随着葡萄糖浓度的增加,原始出发菌株的生长情况变弱.当葡萄糖浓度为50%时,原始出发菌株已经不能正常生长.因此,确定高糖筛选培养基葡萄糖浓度为50%.
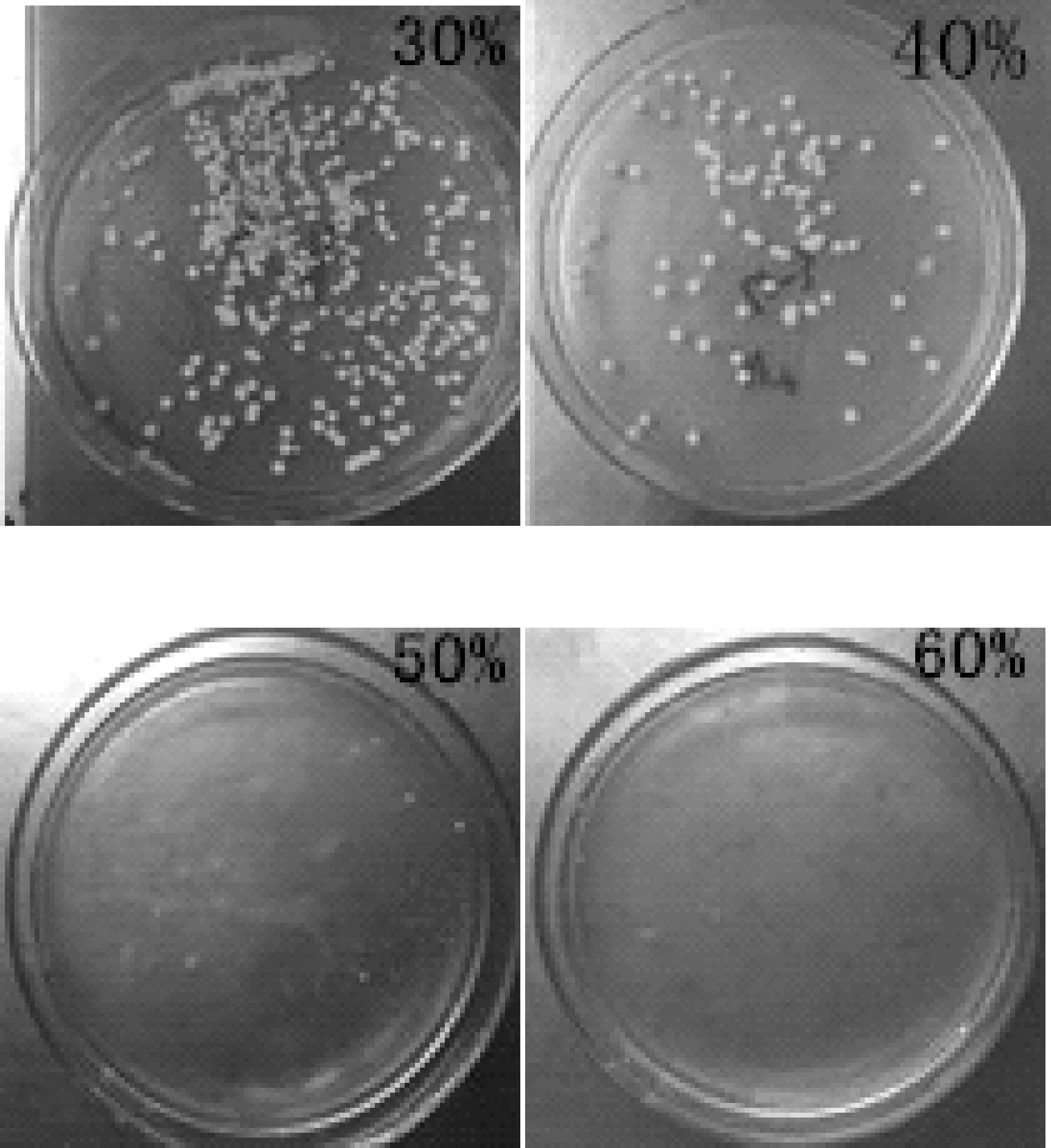
图2 高糖培养基菌体生长情况
2.2.2 高糖培养基初筛结果
将1.2.4所得重组菌株的菌液涂布于葡萄糖浓度为50%的高糖固体培养基上,于37 ℃恒温培养48 h后,挑取生长情况较好的菌落,用高糖培养基保藏菌种,以备复筛.
2.3 高产菌株复筛结果分析
2.3.1 纸色谱法展开体系的优化
(1)展开剂的优化
根据底物与产物均为羟基类物质及物质的相似相容性,对展开剂正丁醇:吡啶:水进行不同配比组合的优化,对混合标品进行层析,结果见表 1所示.
由表1中结果可知,随着分子量的增大,迁移率逐渐减小,D-阿拉伯糖醇的迁移率较大,葡萄糖的迁移率较小.根据 Rf值和分离度,选用了11号层析剂,即,正丁醇∶吡啶∶水=14∶3∶3.

表1 混合层析的Rf值
(2)点样量的优化
本研究对点样量进行考察,通过比较点样量为0.5μL,1.0μL,1.5μL,2.0μL的情况,发现点样量为1.5μL时分离效果较好;当点样量为2.0μL时,拖尾严重,很难将葡萄糖和D-阿拉伯糖醇分开;当点样量为0.5μL和1.0μL时,显色斑点不清晰.
(3)显色剂的优化
常用的糖醇显色剂主要是饱和硝酸银丙酮溶液(A)-氢氧化钠酒精溶液(B).显色原理[14]是羟基与硝酸银的硝酸根离子发生螯合作用将硝酸银固定,喷上氢氧化钠后,硝酸银与氢氧化钠会立即形成棕黑色的氧化银,还原糖和糖醇在室温下就能形成黑色显色点.当还原结束时,将滤纸浸泡在氨水中,溶解过量的氧化银,然后用自来水冲洗,干燥后就能得到棕黑色的斑点.
本研究对A中的硝酸银和B中的氢氧化钠浓度进行了优化.发现将饱和硝酸银和饱和氢氧化钠优化成50%时,显色结果比没有优化前更加明显,不需要用氨水退色也可以显示出清晰的斑点,优化结果见图3所示.分析其原因,主要考虑两点:其一,硝酸银浓度应该与目标产物浓度相当;其二,硝酸银浓度过大时,会使滤纸整体显色太深,需要用氨水溶解多余的硝酸银.

1:D-阿拉伯糖醇;2:D-阿拉伯糖醇和葡萄糖两者的混合;3:葡萄糖图3 展开体系优化前后标品的纸层析图
2.3.2 纸色谱法复筛结果
将1.4得到的标品和样品按照2.3.1优化后的展开体系进行纸色谱分析,得到5株显色斑点较大的菌株.
2.4 高效液相法复筛
将2.3.2得到的显色斑点较大的5株菌株的发酵液浓缩后,用微孔滤膜过滤,采用高效液相色谱法对其进行验证.试验结果表明,显色较大的斑点所对应的发酵液中D-阿拉伯糖醇含量较高,最高可达88.23 g/L.
2.5 重组菌株的遗传稳定性试验结果分析
将2.4筛选得到的高产菌株传代培养8代,测定每代发酵液中D-阿拉伯糖醇的产量,其结果见图4所示.D-阿拉伯糖醇的产量略有波动,但变化不显著,说明该菌株遗传稳定性高.

图4 高产菌株的传代稳定性试验
3 结论
本研究利用低能N+离子注入技术对乳酸克鲁维酵母进行诱变,构建了D-阿拉伯糖醇高产工程菌,通过做出马鞍形曲线确定了离子注入的最佳剂量和能量组合.根据高产菌株具有耐高渗的性质,建立了用高糖培养基进行初筛的方法,再将纸色谱法与高效液相色谱法联合使用进行复筛.根据纸层析显色斑点的大小筛选得到了较高产菌株,用高效液相色谱法对纸色谱法的筛选结果进行了验证.
试验结果表明,本研究建立的高糖培养基初筛,以及纸色谱法与高效液相色谱法连用复筛的筛选方法专属性强,操作方便,可以快速地从大批量诱变菌株中筛选出高产菌株.
[1] 金树人,李 瑛,夏桂珍,等.糖醇生产技术与应用[M].北京:中国轻工业出版社,2008.
[2] Javier Escalante,Gloria Caminal,Marta Figueredo,et al.Production of arabitol from glucose by hansenula polymorpha[J].Journal of Fermentation and Bioengineering,1990,70(4):228-231.
[3] Spencer J F T,Sallans H R.Production of polyhydric alcohols by osmophilic yeasts[J].Can J Microbiol,1956,2(2):72-79.
[4] 贺 娟,卢大军,江 宁,等.细菌血红蛋白基因在产D-阿拉伯糖醇酵母菌种的克隆与表达[J].微生物学报,2001,41(3):315-319.
[5] Bonekamp F J,Swinkels B W,Ooyen A J.The yeast kluyveromyces lactis as an efficient hosts for heterologous geneexpression[J].Antonie Van Leeuwenhoek,1994,64(2):187-201.
[6] 马春丽.乳糖酶及其在乳品工业中的应用[J].食品研究与开发,2003,24(5):62-65.
[7] 张一青,陆兆新,邹晓葵.N+离子注入对A spergi llus sp.产原果胶酶的诱变效应[J].辐射研究与辐射工艺学报,2005,23(3):140-144.
[8] 惠友权,孔锁贤.离子注人选育a-乙酰乳酸脱氢酶菌株[J].西北大学学报(自然科学版),2001,31(3):251-254.
[9] 虞 龙,周 剑,余增亮.低能离子注入L-乳酸生产菌种选育与发酵条件初步优化[J].激光生物学报,2005,14(3):184-188.
[10] 吴 健,苏明杰,戴桂馥,等.低能N+离子、紫外线和60Co-γ射线对绛红小单胞菌产庆大霉素的诱变效应初步研究[J].辐射研究与辐射工艺学报,2003,21(2):120- 124.
[11] 吕树娟,王 军,姚建铭,等.离子注入氧化葡萄糖酸杆菌的诱变效应[J].激光生物学报,2003,12(5):382- 385.
[12] 袁 野,王正祥,诸葛健.产多元醇酵母的耐高渗生长特征[J].无锡轻工大学学报,1999,18(3):42-46.
[13] Trevel Yan W E,Procter D P.Detection of sugars on paper chromatograms[J].Nature,1950,166(4 219):444-445.
[14] Badal Caminal,Saha Yoshikiyo,Sakakibara Michael.Production of D-arabitol by a newly isolated zygosaccharomyces rouxii[J].Society for Industrial Microbiology,2007,34(7):519-523.

