冠突散囊菌液体发酵产降脂类物质的初步研究
吕嘉枥, 郑欣欣, 马亚宁
(1.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 2.商丘出入境检验检疫局, 河南 商丘 476100)
0 引言
冠突散囊菌(Eurotiumcristutum)是茯砖茶“发花”过程中的优势菌[1-3],冠突散囊菌闭囊壳呈金黄色,俗称“金花”菌.杨抚林[4]对冠突散囊菌黑茶发酵液进行了酶学研究,表明冠突散囊菌黑茶发酵液对α-淀粉酶、胃蛋白酶和胰蛋白酶的活力都有很好的促进作用,对脂肪酶有较强的抑制.傅冬和等[5]对茯砖茶的不同萃取物对消化酶活性的影响作了研究,表明不同萃取物对α-淀粉酶均有促进作用.傅冬和等[6-8]运用高通量筛选技术对茯砖茶不同萃取部分和茯砖茶中几种单体成分的降脂减肥等活性进行了研究,证明茯砖茶有多条降脂途径且降脂减肥能力较强.袁勇[9]采用现代分析技术对茯茶中“金花”菌进行了提取分离,表明提取物具有降脂效果,谢春生[10,11]研究了云南普洱茶中有效降血脂成分,表明洛伐他汀是普洱熟茶中特有的降血脂成分.
邓放明[12]用液体发酵技术培养冠突散囊菌,对其有关生化成分的动态变化进行了研究,龚淑俐等[13]从茯砖茶中分离纯化出冠突散囊菌并进行液体深层发酵.目前对金花菌的代谢物质研究主要集中在多糖、茶多酚等,而对金花菌产生的降脂类物质处于初步研究.
本文通过对金花菌进行液体发酵培养,用乙酸乙酯辅助超声波提取发酵物中的降脂类物质,通过薄层色谱法、高效液相色谱法对发酵物中是否存在降脂类物质进行验证.
1 材料与方法
1.1 菌种
冠突散囊菌(Eurotiumcristatum):由陕西科技大学生命科学与工程学院微生物教研室提供.
1.2 材料
1.2.1 主要设备与试剂
(1)设备:HZQ-F160恒温振荡培养箱(哈尔滨市东联电子有限公司),KH-100B型超声波清洗器(昆山禾创超声仪器有限公司),旋转蒸发器RE-2000B(上海亚荣生化仪器厂),HC-高速冷冻离心机(3018R安微中科中佳科学仪器有限公司),10×5 cm硅胶薄层板(上海鑫楚实业),干燥器(山东天力干燥股份有限公司),HPLC高效液相色谱仪(美国安捷伦科技有限公司).
(2)试剂:乙酸乙酯、甲醇、氯仿、氨水、等,均为分析纯;甲醇(色谱纯).
1.2.2 培养基
(1)CZG(5%NaCl)培养基:蔗糖4.0 g、K2HPO40.1 g、NH4NO30.3 g、MgSO4·7H2O 0.05 g、琼脂2.0 g、水100 mL,121 ℃灭菌20 min.
(2)液体培养基:蔗糖6%、大豆粉2.5%、K2HPO40.2%、121 ℃灭菌20 min.
1.3 方法
1.3.1 金花菌的活化培养
将保藏于冰箱中的金花菌菌种于28 ℃、CZG平板培养基上活化5 d,挑选颜色黄亮并且无杂菌污染的平板,以备液体培养的菌悬液用.
1.3.2 金花菌的液体培养
将活化后的金花菌用无菌水制备成孢子菌悬液,孢子数在106~107个/mL,按照10%接种量向液体培养基中接种,在培养温度为28 ℃,摇床转速为150 rad/min的振荡培养箱中培养5 d,每隔24 h观察金花菌生长情况,并进行提取分离测定.
1.3.3 洛伐他汀对照品溶液的制备
洛伐他汀对照品溶液的制备[14]:精密称取2 mg的洛伐他汀,定容于10 mL的甲醇溶液中,配制成0.2 mg/mL的标准溶液.
1.3.4 样品溶液的制备
取一定体积培养完全的金花菌液体发酵物,按照1∶4的体积比加入乙酸乙酯,辅助超声波处理2 h进行提取,再用分液漏斗去除混合液中的水相,将有机相用旋转蒸发仪进行浓缩后用5 mL甲醇溶解浓缩物,再用0.45μL的有机滤膜过滤后制成待检样品.
1.3.5 洛伐他汀的TLC分析
称取GF254硅胶适量于研钵中,按1∶3加入0.5%的CMC-Na溶液,去除表面气泡,制成薄层板,于105 ℃活化1 h,置于干燥器中备用.
用毛细管分别对样品和对照品在层析板上点样,展开剂为(氯仿∶甲醇∶氨水=25∶3∶1),展开后放入含有适量碘晶体的显色缸中,显色后测量各条带的Rf值.
1.3.6 洛伐他汀的检测
HPLC检测条件[15]为:柱型:C18柱;流动相:甲醇∶水=80∶20;检测波长:238 nm;流速:1.0 mL/min;柱温:室温;进样量:20μL.
2 结果与讨论
2.1 洛伐他汀的TLC分析结果
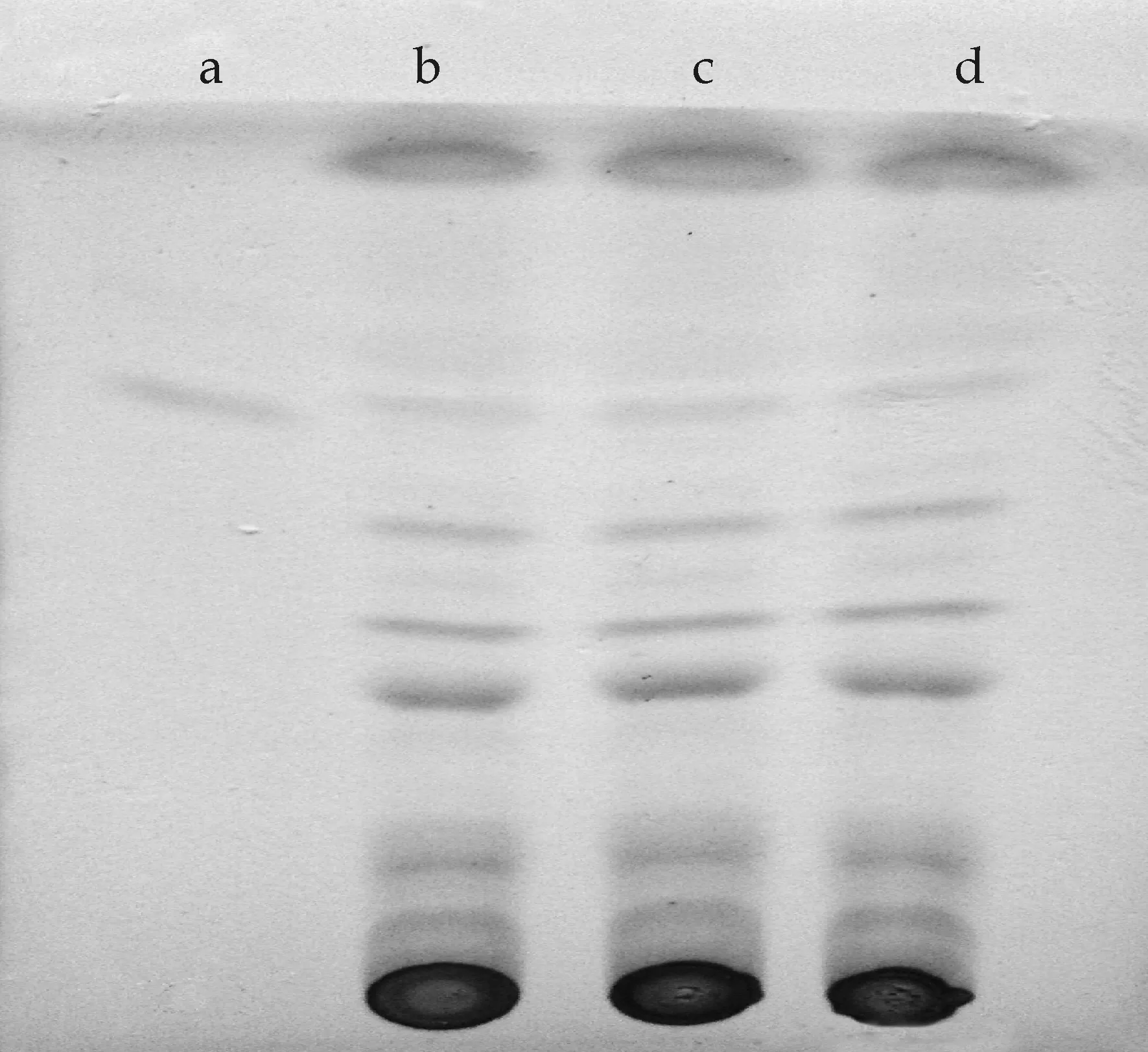
(由左至右依次为:a为洛伐他汀对照品溶液,b、c、d为金花菌液体培养提取液)图1 金花菌液体培养提取液薄层图
由图1可知:在展开剂为(氯仿∶甲醇∶氨水=25∶3∶1)条件下薄层板经碘蒸气显色后,洛伐他汀对照品在距起始点5.1 cm处有明显的黄色斑点出现,金花菌的液体培养提取液的三个条带经显色后出现多个分离完全的斑点,并且在与洛伐他汀对照品对应的5.1 cm处也有相同的黄色斑点.对薄层斑点测量后洛伐他汀对照品的比移值Rf为0.544,金花菌液体培养提取液的三个斑点的Rf分别为:0.554、0.554、0.565,斑点Rf值在0.2~0.8范围内,展开效果优良.因此,通过薄层层析结果可以初步确定金花菌液体发酵提取液中含有降脂类物质——洛伐他汀.
2.2 洛伐他汀HPLC检测结果
2.2.1 TLC分离样品检测
在上述色谱条件下,收集薄层结果中与对照品同一位置处的黄色斑点样品,再用甲醇溶解10 min后离心,收集上清液后再用0.45μL的有机滤膜过滤后进行HPLC.结果如图2、图3所示.
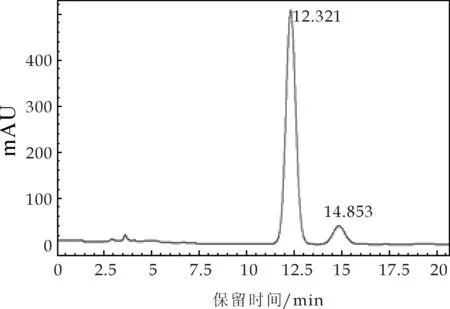
图2 洛伐他汀对照品高效液相色谱图
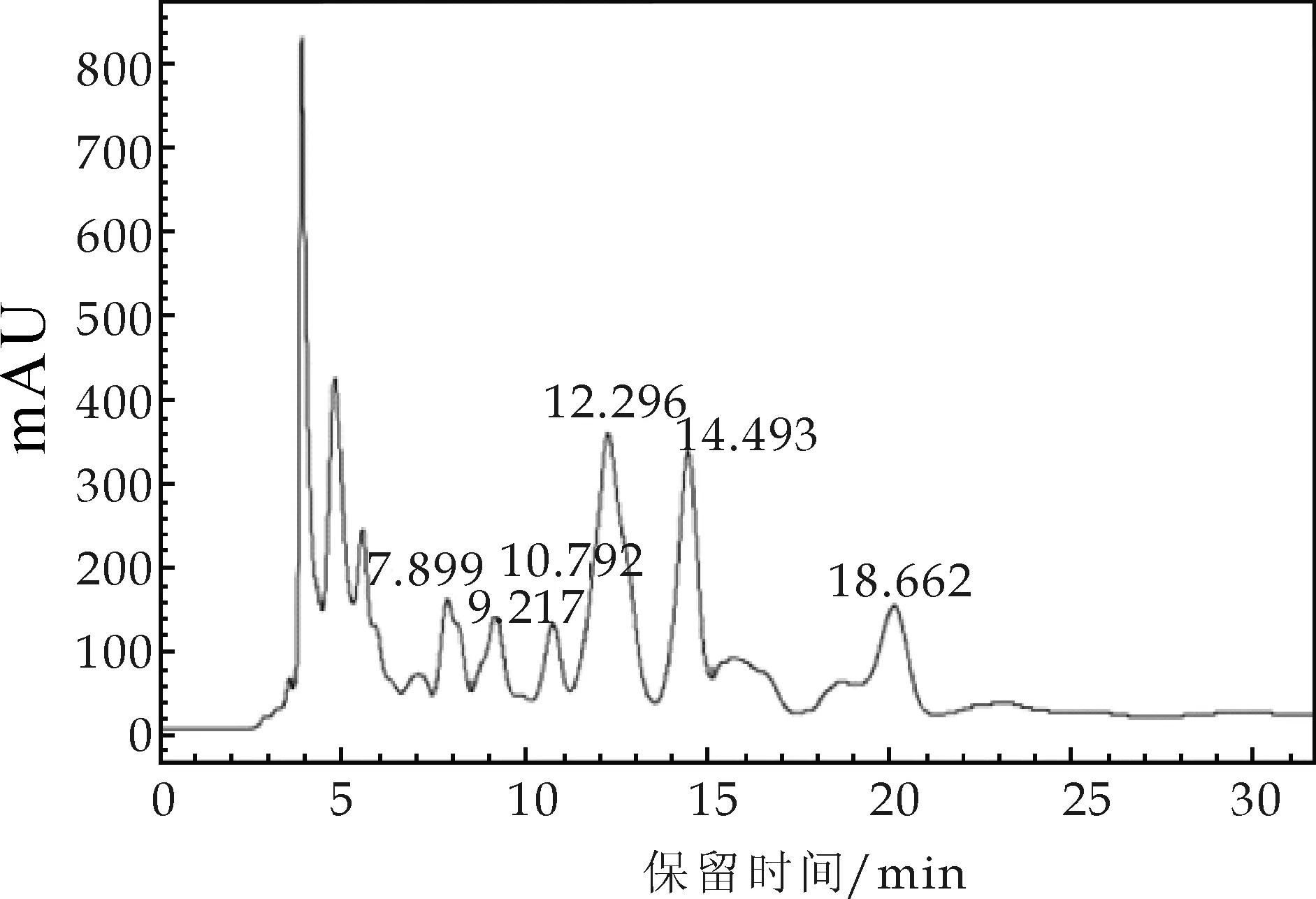
图3 金花菌液体发酵提取液高效液相色谱图
图2为洛伐他汀对照品色谱图,其出现两个显著的色谱峰,保留时间分别为12.321 min和14.853 min,保留时间在12.321 min为检测峰,图3为TLC结果中与洛伐他汀对应斑点色谱图,其色谱图在12.296 min和14.493 min处出现明显的色谱峰.通过对比图2与图3的保留时间,发现样品与对照品的两个相对应的色谱峰的保留时间差为0.025和0.360,且第一组色谱峰对应关系极其显著.因此,通过HPLC图谱和TLC结果相结合可以确定金花菌液体发酵提取液中含有降脂类物质——洛伐他汀.
2.2.2 不同发酵时间样品检测
在色谱条件下,对不同发酵时间的金花菌液体发酵物提取后进行分析,结果如图4~图9所示.
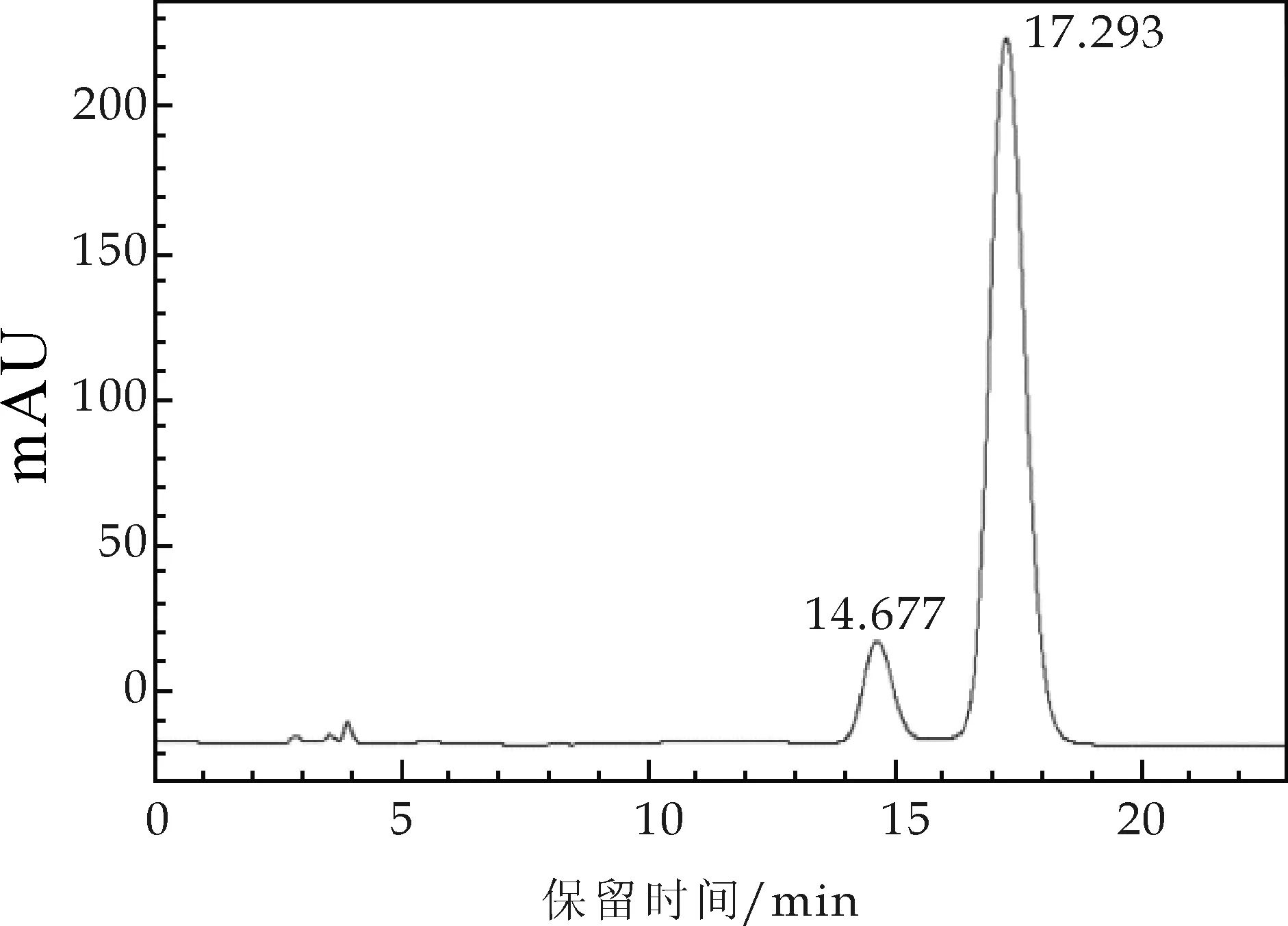
图4 洛伐他汀对照品高效液相色谱图

图5 金花菌液体发酵2 d高效液相色谱图

图6 金花菌液体发酵3 d高效液相色谱图

图7 金花菌液体发酵4 d高效液相色谱图
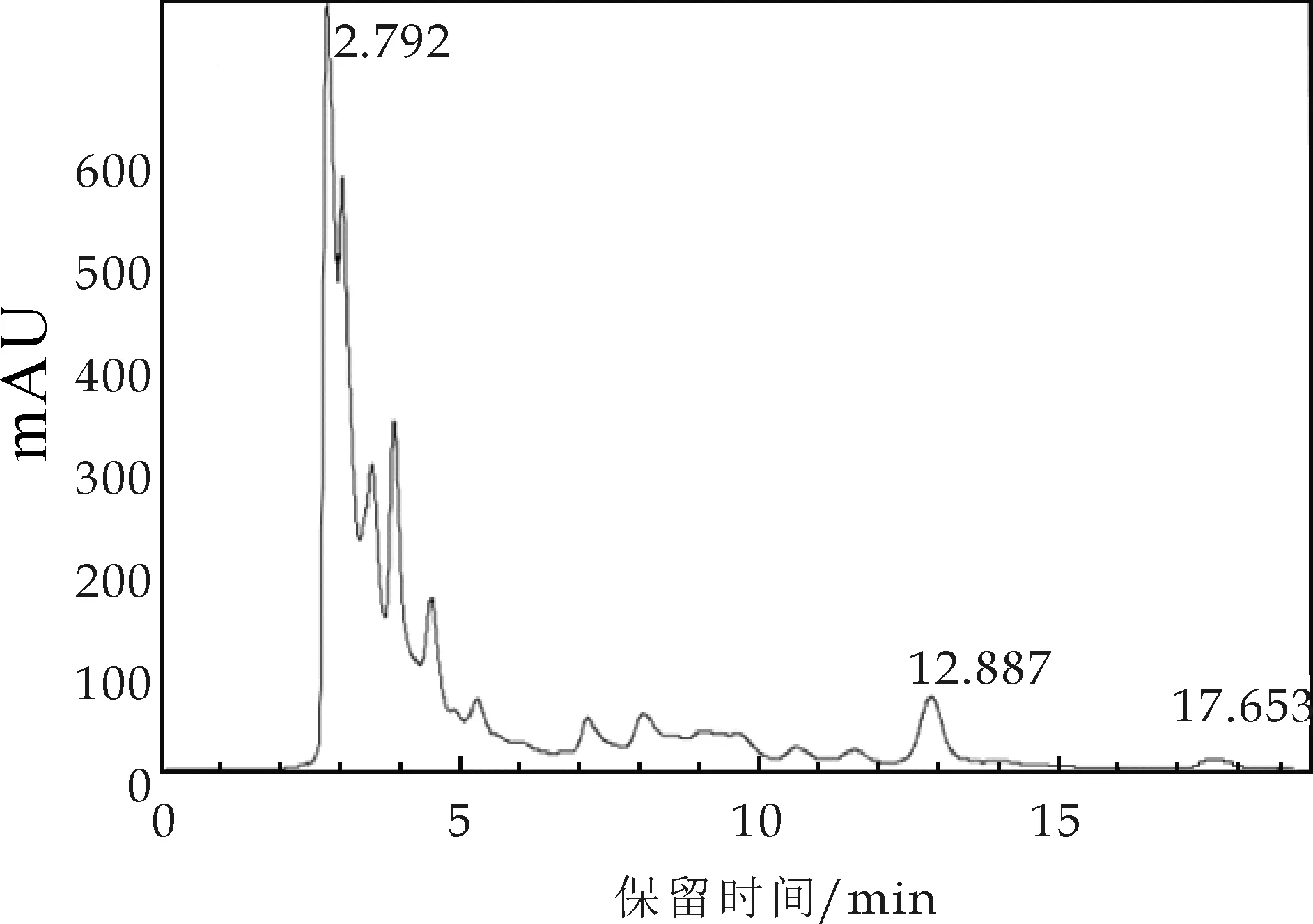
图8 金花菌液体发酵5 d高效液相色谱图

图9 金花菌液体发酵提取液加洛伐他汀 对照品高效液相色谱图
图4为洛伐他汀对照品的色谱图,其保留时间为17.293 min,图5~图8分别为金花菌液体发酵不同时间提取液色谱图,色谱图表明在发酵2 d时没有出现与对照品对应的色谱峰,第3 d、4 d、5 d出现与对照品对应的色谱峰.并且第4 d的色谱峰最为理想.图7为发酵4 d时样品在17.523处出现与对照品对应的色谱峰,两者的保留时间差为0.230 min,可以推断样品中含有洛伐他汀.为了再次确定样品与对照品的色谱峰为同一物质的色谱峰,将少量的对照品溶液加入样品溶液中混匀后再次进行色谱分析.图9为发酵4 d样品加入对照品后色谱图,其保留时间为17.461 min,与对照品和第4 d样品相对应的色谱峰保留时间差为0.062 min和0.178 min,因此可以确定对照品、样品和样品加对照品的三个峰为同一物质的色谱峰,表明样品中含有洛伐他汀.
3 结论
通过对冠突散囊菌液体发酵产降脂类物质的研究,根据薄层色谱法和高效液相色谱法分析结果,证明冠突散囊菌液体发酵提取液中含有降脂成分洛伐他汀,并且在HPLC色谱图中对照品和样品都出现两个对应的色谱峰,说明对照品和样品中都存在酸式洛伐他汀和酯式洛伐他汀.
[1] 仓道平,温琼英.茯砖茶发酵中优势菌与有害菌类的分离鉴定[J].茶叶通讯,1981(2):12-14.
[2] 温琼英.茯砖茶中优势菌的种名鉴定[J].中国茶叶,1990(6):2-3.
[3] 齐祖同,孙曾美.茯砖茶中优势菌群的鉴定[J]. 真菌学报,1990,9(3):176-179.
[4] 杨抚林.冠突散囊菌液体发酵工艺及其发酵液对消化酶活性影响的研究[D].长沙:湖南农业大学,2005.
[5] 傅冬和,刘仲华,黄建安,等.茯砖茶不同萃取物对消化酶活性的影响[J].茶叶科学,2008,28(1):62-66.
[6] 傅冬和,刘仲华,黄建安,等.高通量筛选研究茯砖茶降脂功效[J].茶叶科学,2006,26(3):209-214.
[7] 傅冬和,刘仲华,黄建安,等.茯砖茶中几种单体成分功效的高通量筛选研究[J].茶叶科学,2008,28(1):39-42.
[8] Kumar N S,Rajapaksha M.Separation of catechin constituents from five tea cultivars using high-speed counter-current chromatography[J].Journal of Chromatography A,2005,1083:223-228.
[9] 袁 勇,黄建安,徐小江,等.茯茶中“金花”孢子粉提取物对体外诱导的非酒精性脂肪肝细胞内甘油三酯代谢的影响[J].茶叶科学,2011,31(2):129-135.
[10] 谢春生,谢知音.普洱茶中降血脂的有效成分他汀类化合物的新发现[J].河北医学,2006,12(12):1 326-1 327.
[11] Chand P,Gopal R.Nutritional and medicinal improvement of black tea by yeast fermentation[J].Food Chemistry,2005,89:449-453.
[12] 邓放明.茯砖茶中冠突散囊菌分离培养及发酵液胞外多糖与应用酶学研究[D].长沙:湖南农业大学,2007.
[13] 龚淑俐,邓放明,周向荣.冠突散囊菌胞外多糖含量测定及提取工艺研究[J].食品研究与开发,2007,28(4):140-144.
[14] 吕嘉枥,王 珊,王 柳.高效液相色谱法检测金花菌固态发酵中他汀类物质[J].陕西科技大学学报(自然科学版),2014,32(1):114-118.
[15] 文 镜,刘 迪.洛伐他汀检测方法研究进展[J].北京联合大学学报(自然科学版),2003,17(3):70-74.

