阿维菌素-β-环糊精包合物制备及工艺优化
李运涛, 郭 宁, 沈 文
(1.陕西科技大学 化学与化工学院, 陕西 西安 710021; 2.陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
阿维菌素是一种微生物源农药,是广谱的杀虫、杀螨、杀线虫剂.在农业、渔业、畜牧业领域均有应用,被称为“三位一体”的药物[1].对环境无污染,在生物体内无积累作用[2].天然阿维菌素由链霉菌中的灰色链霉菌发酵产生,含有8个结构类似的成分,其中主要的杀虫成分为B1a和B1b,是一种十六元大环内脂双糖类化合物[3].
阿维菌素见光易分解[4]、水溶性差[5],这导致了阿维菌素施药量增大、药效降低,限制了其作为农药制剂的实际应用.因此,在阿维菌素剂型加工中,应考虑添加防紫外线剂和增溶剂.目前已有许多阿维菌素微胶囊制备的研究[6-8],但其制备过程需用到大量有毒的有机溶剂,且成本高昂.因为β-环糊精可包合客体分子,而外侧具有亲水性羟基的β-环糊精,有提高客体分子水溶性的作用;另外,客体分子进入β-环糊精空腔,就像进入一个保护腔,客体分子必会受到保护[9,10].所以,本文尝试用β-环糊精包合阿维菌素,制备阿维菌素-β-环糊精包合物,得到新型阿维菌素药剂中间体,为探索阿维菌素新剂型提供途径,亦会为现有阿维菌素农药剂型的改造和新剂型的开发提供实验依据.
1 实验部分
1.1 实验试剂和仪器
阿维菌素标准品,上海市农药研究所;阿维菌素原药,江苏丰源生物工程有限公司;β-环糊精,咸阳西秦生物科技有限公司;其它试剂均为市售.
高效液相色谱仪,1525-2487型,美国Waters公司;差示扫描量热仪,DSC-Q2000型,美国TA公司.
1.2 检测包合率的方法[11,12]
色谱条件:Diamonsil®C185μm 250×4.6 mm色谱柱,流动相体积流量配比为甲醇∶水=90∶10,检测波长设定245 nm.
配制浓度为0~400μg·mL-1的阿维菌素-甲醇溶液,然后依次进样并记录峰面积.以峰面积响应值y(mV·s-1)为纵坐标,以阿维菌素浓度x(μg·mL-1)为横坐标.其回归方程:y=0.051 0x-0.036 5,r=0.999 8.
准确称取成品的千分之一,在10 mL棕色容量瓶中用甲醇定容,即得待测液.进样并记录峰面积.把峰面积带入回归方程,即得待测液中游离阿维菌素的浓度C (μg·mL-1).
(1)
其中m(g)为阿维菌素投料量.

(2)
1.3 包合方法[13]
阿维菌素的精制:称取9.6 g阿维菌素,加入80 mL乙醇,加热沸腾后立即抽滤.4 ℃下冷藏滤液,析出并干燥晶体,产率78.4%.
分别称取10 gβ-环糊精、0.5 g阿维菌素各3份,用水搅拌法、超声法和研磨法制备包合物,测定其包合率.
荔枝 性温、味甘、酸,具有补脾益肝、生津止渴、解毒止泻等功效。荔枝可改善人的肝肾功能,加速人体内毒素的排出,有促进人体细胞的生成以及保持皮肤细嫩等作用。
1.3.1 水搅拌法
量取25 mL蒸馏水溶解β-环糊精;把阿维菌素用少量丙酮溶解.二者在50 ℃下进行避光包合.倒出反应液,用10.0 mL蒸馏水分两次洗涤反应釜,合并洗液入反应液.塑封反应液,4 ℃下冷藏.抽滤并真空干燥滤饼,即得产品.
1.3.2 超声法
量取25 mL蒸馏水溶解β-环糊精,制得β-环糊精水溶液;超声的同时逐滴缓慢滴加阿维菌素的丙酮溶液.室温下超声1 h.塑封反应液,4 ℃下冷藏.抽滤反应液,40 ℃下真空干燥滤饼,即得产品.
1.3.3 研磨法
向β-环糊精中加入2~5倍质量的蒸馏水,再加入阿维菌素,充分研磨1 h.40 ℃下真空干燥反应物,即得产品.
1.4 包合物的制备及工艺优化
根据资料[14,15],包合温度、包合时间对包合效果的影响明显,因此选择这两个因素,用水搅拌法进行工艺筛选试验,探究其对包合效果的影响.
1.4.2 正交试验
用水搅拌法制备阿维菌素-β-环糊精包合物,经过工艺筛选试验,选择因素水平.用L9(33)正交表设计正交试验,优化工艺条件.
1.5 包合物的表征
采用差示扫描量热仪对阿维菌素、β-环糊精物理混合物和阿维菌素-β-环糊精包合物进行分析,测试条件为:水冷,氮气保护,温度范围20 ℃~275 ℃.
2 结果与讨论
2.1 包合方法的确定
由表1可知,水搅拌法的包合率最高.所以该研究用水搅拌法进行.

表1 各包合方法下的包合率
2.2 包合物的制备及工艺优化
2.2.1 工艺筛选试验结果分析
(1)包合温度的影响.包合温度为30 ℃~80 ℃,在包合时间9 h、投料质量比10∶0.5的条件下进行包合.由图1可知,当温度过低时,反应物分子的能量低,不利于包合过程的发生;由于主客体分子间主要由范德华力、疏水力、库仑力、氢键等分子间力结合,温度过高会使分子运动加快,从而降低包合物的稳定性.实验证明,35 ℃~45 ℃之间包合率较高.
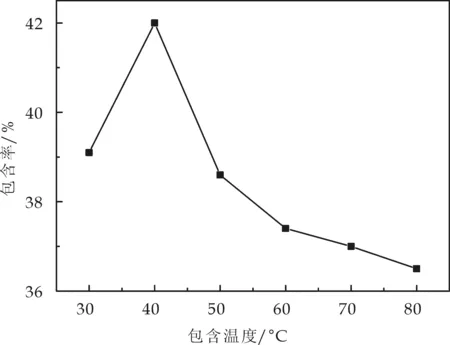
图1 包合温度对包合率的影响
(2)包合时间的影响.包合时间为3~11 h,在包合温度50 ℃、投料质量比10∶0.5的条件下进行包合.β-环糊精与客体分子在水溶液中的包合是一个平衡过程,包合反应有一个最大限度.由图2可知, 6~10 h包合反应已达最大限度.
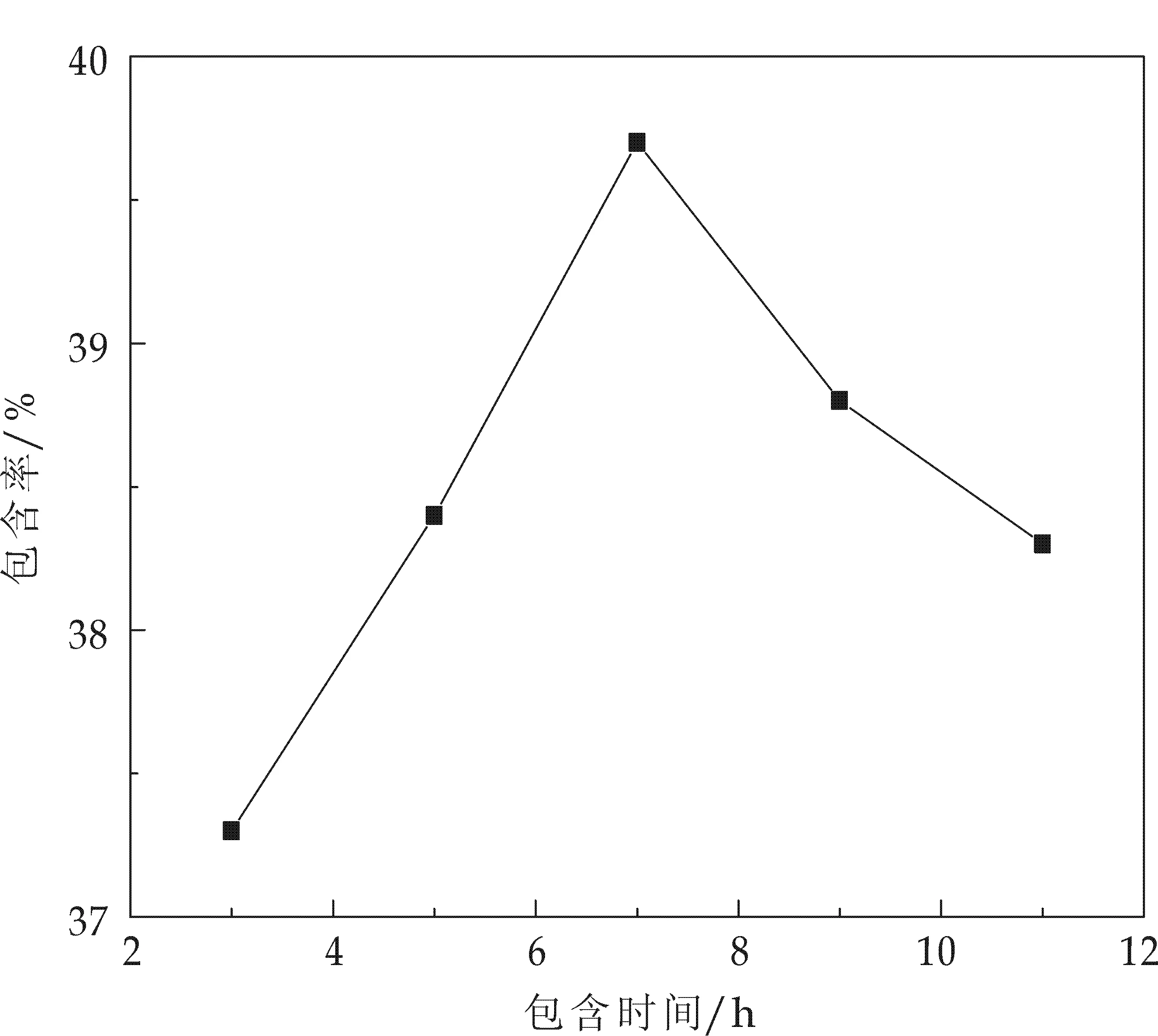
图2 包合时间对包合效果的影响
2.2.2 正交试验结果分析
经过工艺筛选实验,确定正交试验因素(包合温度、包合时间和主客分子投料质量比)的水平(如表2所示):

表2 因素水平
按正交试验方案进行实验,并用高效液相色谱法测定包合率.结果如表3所示.
正交试验结果显示:各因素影响包合率的主次顺序是A>B>C,最佳组合因素是A1B2C2;因此最佳包合工艺为A1B2C2,即包合温度为35 ℃,包合时间为8 h,主客分子投料质量比为10∶1.0.
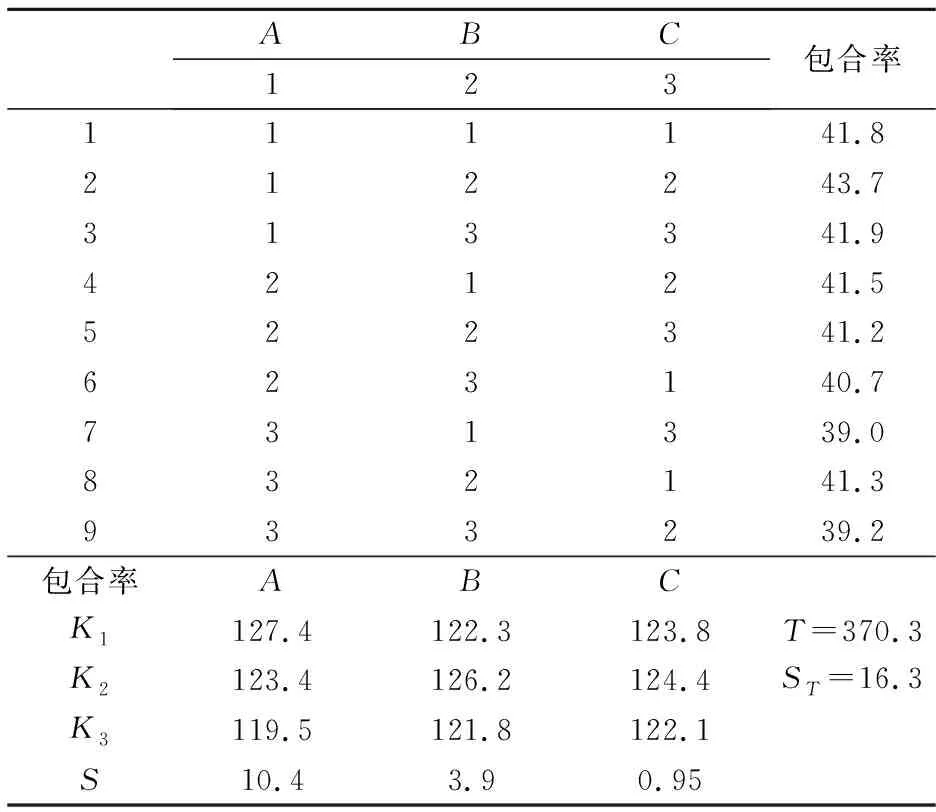
表3 正交试验结果
在最佳条件下,按1.3.1的方法制备阿维菌素-β-环糊精包合物,按1.2的方法检测包合率为43.8%,收率为80.4%.
2.3 包合物的表征
由图3可知,阿维菌素、β-环糊精物理混合物(混合质量比为10∶0.5)的吸热峰出现温度为109 ℃,阿维菌素-β-环糊精包合物的吸热峰出现温度为133 ℃.对比两者,说明包合物不是单纯的物理共混,可能有新物相生成.
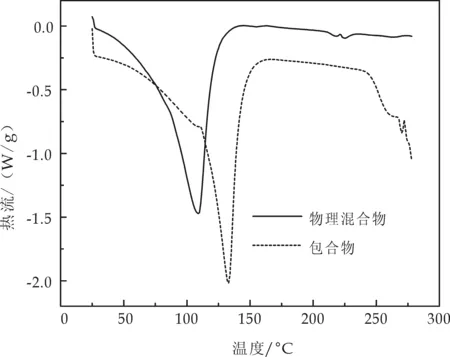
图3 物理混合物和包合物的DSC曲线
3 结束语
本研究用DSC验证了包合物的生成.用高效液相色谱法检测了包合率.实验发现,β-环糊精在水中包合阿维菌素,包合温度过高、包合时间太长反而使包合率下降.通过正交试验优化工艺,确定最佳工艺条件为:包合温度35 ℃、包合时间8 h、主客分子投料质量比10∶1.0.在此工艺条件下,包合率和收率分别为43.8%和80.4%.
[1] Macconnell J M,Demchak R J,Preiser F A,et al.Relative stability,toxicity,and penetrability of abamectin and its 8,9-oxide[J].J A gric Food Chemical,1989,37(6):1 498-1 501.
[2] 郝勇斐,汪 明,潘保良.阿维菌素类药环境毒理学研究进展[J].中国兽医杂志,2008,44(11):56-58.
[3] 王 兰,冯宏祖.阿维菌素类杀虫剂的研究及应用前景[J].中国植保导刊,2008,28(4):13-15.
[4] 刘卫国,朱欣妍,尹明明,等.阿维菌素3种剂型的光解研究[J].农业环境科学学报,2012,31(10):1 906-1 912.
[5] 孙 鹏,刘俊果,杨玉淮,等.阿维菌素在不同醇-水溶剂体系中溶解度的测定与关联[J].高校化学工程学报,2010,24(5):735-738.
[6] 易金娥,孙志良,刘进辉,等.阿维菌素微囊的制备及体外释药药的研究[J].湖南农业大学学报(自然科学版),2006,56(1):67-69.
[7] 樊玉松,康占海,赤国彤.阿维菌素微胶囊剂的制备[J].河北农业大学学报,2009,32(2):97-101.
[8] 周小敏,于秋生,陈正行.复合凝聚法制备阿维菌素微胶囊[J].江苏农业科学,2013,41(6):104-107.
[9] Marques Helena Ma Cabral.A review on cyclodextrin encapsulation of essential oils and volatiles[J].Flavour and Fragrance Journal,2010,25(5):313-326.
[10] 童继军.环糊精及其衍生物的药学研究进展[J].医药导报,2011,30(8):1 062-1 065.
[11] 潘 媛,牛 华,马雪涛,等.阿维菌素类农残检测方法的优化[J].食品与机械,2012,28(3):90-92, 95.
[12] 胡全保,丁培芳,韦元杰.阿维菌素检测条件的探索[J].广东化工,2012,39(2):195-197.
[13] 徐亚维,董长颖,麻馨月,等.羟丙基-β-环糊精包合原花青素的研究[J].湖北农业科学,2011,50(22):4 701-4 704.
[14] 郭艳云,蔡 莹,曹国轩,等.梅片树叶挥发油/β-环糊精包合物的制备研究[J].现代食品科技,2013,29(1):138-140,161.
[15] 单洪武,赵国虎.饱和水溶液法制备松节油β-环糊精包合物的工艺研究[J].甘肃农业大学学报,2012,47(3):155-160.

