2012年上海地区副溶血性弧菌血清分型和毒力基因携带状况研究
陈洪友,盛跃颖,屠丽红,宋元君,张曦,陈敏
1. 上海市疾病预防控制中心,上海 200336; 2. 上海医药高等专科学校,上海 201318
副溶血性弧菌(Vibrioparahaemolyticus,Vp)广泛分布于近海水体和海产品中,不仅对水产动物具有致病性,还能引起人类腹泻,在沿海地区常引起食物中毒[1]。监测数据显示,细菌性腹泻中35.20%由副溶血性弧菌引起[2]。全国突发公共卫生事件网络报告显示,总食物中毒原因构成中副溶血性弧菌居第2位[3]。
副溶血性弧菌的血清型常用O∶K组合表示,目前有13个O抗原群和79个K抗原型。20世纪80年代研究显示,仅浙江、上海两地可分型的O∶K组合达154种[4],仍不断有新的血清型出现,包括不同于既往报道的O∶K组合,及O和(或)K不可分型(untypeable,UT)者。
耐热直接溶血素(thermostable direct hemolysin,TDH)和耐热直接溶血素相关溶血素(TDH-related hemolysin,TRH)被认为是该菌毒力的主要致病因子[5],通常携带tdh和(或)trh的菌株被称为产毒株(virulent strain)。研究表明,特定的血清型如O3∶K6、O4∶K68、O1∶KUT、O4∶K12等的致病性强于其他血清型[6]。
上海市腹泻病监测数据显示,副溶血性弧菌感染为细菌性腹泻的首要病因[7],其导致的食源性疾病发病率为76.5人次/10万[8]。本研究主要从血清型和毒力基因携带方面探讨目前上海地区副溶血性弧菌腹泻及食品监测的主要状况。
1 材料与方法
1.1 材料
副溶血性弧菌分离株共854株,其中739株来自散发腹泻患者,49株为食品监测分离株,66株为食物中毒事件中的分离株。散发腹泻患者株来自2012年1~12月上海市15个区(县)监测点的肠道门诊患者;食品监测分离株主要来自同期的鱼类(21株)、贝类(21株)、虾及蟹类(7株);食物中毒事件中的分离株来自2012年5~11月发生的11起食物中毒事件,包括食物中毒患者株59株、食物中毒环节样品株1株、食物中毒可疑食品株6株。对照菌株为上海市疾病预防控制中心(Centers for Disease Control and Prevention,CDC)保存的副溶血性弧菌WP-1(RIMD 2210086,O4∶K12,tdh+,trh-)和AQ4037(RIMD 2210531,O3∶K6,tdh-,trh+)。菌株以3% NaCl营养琼脂复苏,于37 ℃培养18 h,培养物用于血清分型和DNA提取。
1.2 方法
1.2.1菌株的分离及鉴定对散发腹泻患者及食物中毒患者,采集肛拭子进行检测,检测方法参照《感染性腹泻诊断标准》(WS 271-2007)附录B3:副溶血性弧菌检验。食品监测样品、食物中毒可疑食品和环节样品的检测按照《食品卫生微生物学检验副溶血性弧菌检验》(GB/T 4789.7-2008)进行。最终送检菌株均经用API 20E(生物梅里埃,法国)生化鉴定确认。
1.2.2菌株血清分型血清分型使用副溶血性弧菌11种O分群血清(O1~O11)及65 种K分型血清(K1,K3~K13,K15,K17~K26,K28~K34,K36~K61,K63~K71)(Denka Seiken,日本)。K抗原分型:直接取新鲜的3% NaCl营养琼脂培养物进行玻片凝集。O抗原分群:以0.85%生理盐水悬浮培养物制成约7个麦氏单位的均匀悬液,121 ℃高压1 h后取裂解液进行玻片凝集。
1.2.3菌株DNA提取取新鲜的3% NaCl营养琼脂培养物,以500 μl TE缓冲液﹝10 mmol/L Tris∶1 mmol/L乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),pH 8.0﹞制成约1个麦氏单位的均匀菌悬液,100 ℃加热10 min,12 000g离心15 min,取上清液,以TE缓冲液进行10倍稀释后作为DNA扩增模板。
1.2.4tdh和trh基因检测聚合酶链反应(polymerase chain reaction,PCR)引物由生工生物工程(上海)股份有限公司合成,序列参考文献[9]。tdh_F:5′-GTAAAGGTCTCTGACTTTTGGAC-3′;tdh_R:5′-TGGAATAGAACCTTCATCTTCA- CC-3′,预期产物270 bp。trh_F:5′-TTGGCTTC- GATATTTTCAGTATCT-3′;trh_R:5′-CATAA- CAAACATATGCCCATTTCC-3′,预期产物486 bp。双重PCR反应体系为:Premix TaqTM(宝生物,TaKaRa Code: RR901A)12.5 μl,tdh上、下游引物终浓度200 nmol/L,trh上、下游引物终浓度400 nmol/L,DNA模板1.5 μl,以蒸馏水补足至25 μl。PCR热循环条件:94 ℃ 3 min;94 ℃ 60 s,52 ℃ 60 s,72 ℃ 90 s,25个循环;72 ℃ 10 min。产物于1%琼脂糖凝胶中电泳30 min。
2 结果
2.1 人源株的月份分布
从时间分布看,2012年来自散发腹泻患者的分离株主要集中在5~10月,占96.5%(713/739);来自食物中毒患者的分离株主要集中在5~8月(图1)。血清型构成中前7位的散发腹泻患者分离株的时间分布不完全相同,O3∶K6、O1∶K25、O4∶K68、O3∶K29、O4∶K8菌株的分布呈现一定的集中趋势,高峰出现在7~8月。O4∶K9、O1∶K36菌株的时间分布集中趋势不明显, 5~11月数量上变化不大(图2)。
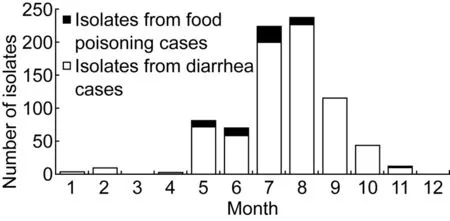
图1 2012年副溶血性弧菌人源株的月份分布Fig.1 Distribution of V. parahaemolyticus isolates from diarrhea cases and food poisoning cases in 2012 (by month)
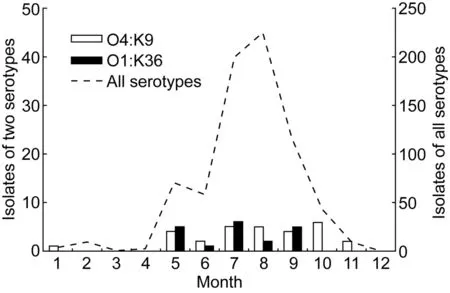
图2 散发患者株O4∶K9和O1∶K36血清型菌的月份分布Fig.2 Distribution of O4∶K9 and O1∶K36 serotype isolates from sporadic cases by month
2.2 血清分型
854株副溶血性弧菌中,血清可分型菌株占88.1%(752/854),共35种血清型,其中O3∶K6最多,达54.8%(412/752)。不可分型的菌株中,1株为O抗原不可分群(OUT∶K19),101株为K抗原不可分型(表1、2)。人源株(散发腹泻患者株和食物中毒患者株)可分型率为91.5%(731/799),高于食源株(食品监测分离株和食物中毒可疑食品分离株)的38.2%(21/55)(χ2=139.0,P<0.01)。
7种血清型(O3∶K6、O4∶K8、O1∶K25、O4∶K68、O4∶K9、O1∶K36和O3∶K29)占可分型人源株的93.8%(686/731),是上海地区腹泻患者副溶血性弧菌优势血清型,其中约2/3为O3∶K6。可分型食源株在血清型上未观察到明显集中趋势,仅5株为人源株优势血清型(χ2=8.7,P<0.01),其中O3∶K6仅1株,有42.9%(9/21)的菌株血清型未在人源株中出现。
2.3 tdh和trh基因携带率
全部854株副溶血性弧菌中,产毒株占89.8%(767/854),其中85.7%(732/854)仅检测到tdh基因,0.6%(5/854)仅检测到trh基因,3.5%(30/854)同时检测到tdh和trh基因。食源株中未检测到trh基因。
人源株的毒力基因携带率为95.6%(764/799),高于食源株的5.5%(3/55)(χ2=457.22,P<0.01)。血清可分型人源株的毒力基因携带率为98.1%(717/731),高于不可分型人源株的69.1%(47/68)(χ2=124.6,P<0.01)。人源株中优势血清型菌株的毒力基因携带率为99.9%(685/686),高于非优势血清型的71.1%(32/45),精确χ2检验显示P<0.01。
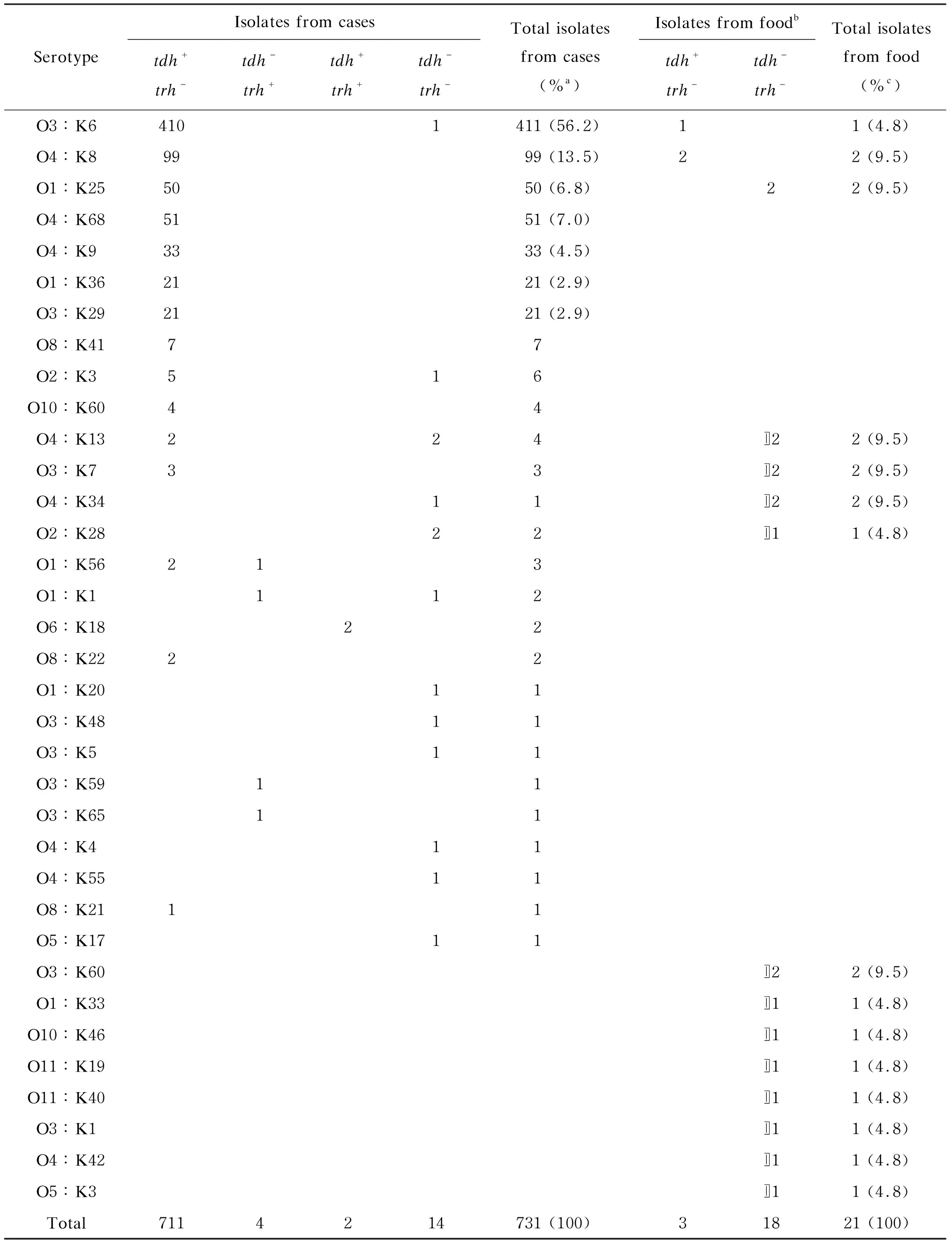
表1 人源株与食源株血清可分型菌株血清型与tdh、trh基因携带状况Tab.1 Serotypes, tdh and trh gene distribution of serotypeable isolates from diarrhea cases and food
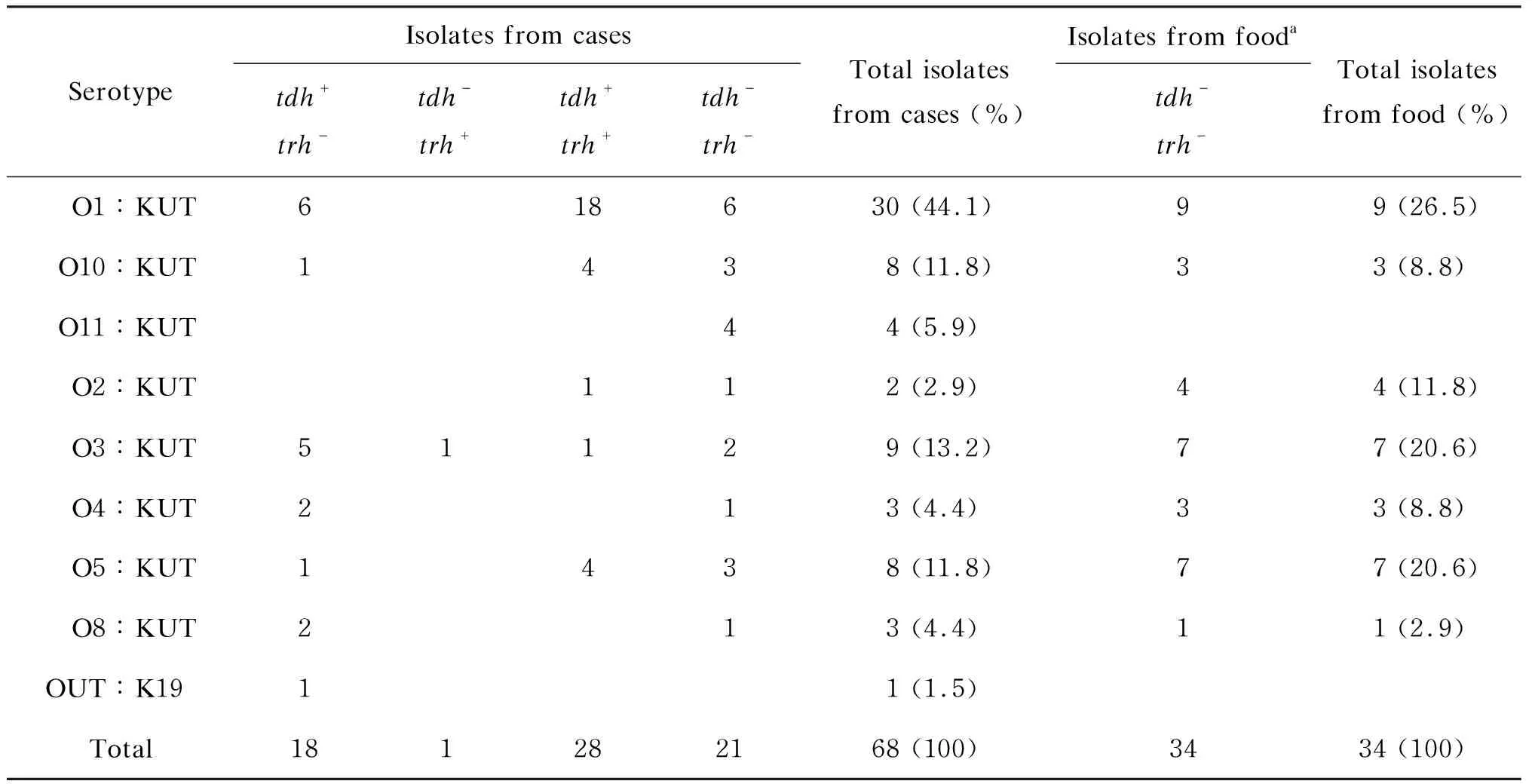
表2 人源株与食源株中血清不可分型菌株tdh、trh基因携带状况Tab.2 Serotypes, tdh and trh gene distribution of unserotypeable isolates from diarrhea cases and food
血清可分型人源株的tdh携带率为97.5%(713/731),高于不可分型人源株的67.6%(46/68)(χ2=116.9,P<0.01)。血清可分型人源株的trh携带率为0.8%(6/731),低于不可分型人源株的42.6%(29/68)(χ2=259.8,P<0.01)。
考虑到大流行菌株O3∶K6在构成上远超过其他血清型,去除该血清型后上述差异仍存在。
K抗原不可分型人源株中,O1群tdh和trh均阳性的比例(18/30)高于其他O群别的平均比例(10/38)(χ2=7.86,P=0.005)。
3 讨论
3.1 人源株血清型分布较历史数据变化较大
血清型构成变化反映种群的变迁,进而反映传染源的可能变化。据王茵茵等[10]报道,1983~1990年上海地区腹泻病例分离株中前7位血清型依次为O2∶K3(12.7%)、O1∶K56(6.9%)、O4∶K8(4.0%)、O5∶K68(2.7%)、O8∶K22(2.5%)、O11∶K19(2.3%)和O1∶K25(1.7%)。此次调查显示,除O4∶K8与O1∶K25所占比例有所上升外,其他血清型已较少见,O3∶K6的构成则超过既往任何一种血清型,与其他研究一致[11]。但1990~2000年我国对副溶血性弧菌血清型构成的系统研究较少,因此无法判断血清型构成发生转变的具体时间。
从5~10月的菌株分布来看,不同血清型的菌株仍存在时间分布上的差异。副溶血性弧菌血清型构成的时间变化是否与相关食品的消费时间变化相一致,尚值得进一步研究。
因此,目前应以控制O3∶K6为主的7种优势血清型作为控制副溶血性弧菌的重点。在进行食品监测时,应充分考虑到此7种优势血清型的重要意义,而不应仅局限于副溶血性弧菌的检出。
3.2 血清型与毒力基因携带率之间有一定关联
与其他血清型,尤其是食源株的各血清型比较,人源株优势血清型菌株的毒力基因携带率更高。在食源株中,仅在O3∶K6、O4∶K8和O1∶K25中检出tdh基因,这可能也是特定血清型毒力强于其他血清型[6]的原因之一。trh基因在优势血清型中未检出。检出的trh菌株在血清型上亦无明显聚集趋势。
3.3 人源株与食源株在血清型和毒力基因携带率上具有分离现象
国内外观点普遍认为,副溶血性弧菌是食源性致病菌,其主要传染源为贝类等软体动物[12]。但从本研究结果来看,人源株血清型相对集中,毒力基因携带率高;而食源株血清型相对分散,毒力基因携带率低。
尽管本研究中食源株的数量有限,但这种分离现象也被其他研究者提及[13]。本研究认为,副溶血性弧菌的目前检测方式可能是导致此种分离现象的原因之一。目前副溶血性弧菌的检测及鉴定以生化试验为主,报告以定性检出和半定量法(MPN法)为主(WS 271-2007、GB/T 4789.7-2003、GB/T 26426-2010、SN/T 0173-2010、SN/T 2142-2008、SN/T 2424-2010、SN/T 2754.5-2011)。结合血清与分子生物学方法的相关研究显示,同一标本中可检测出2~5种菌型[14]。食品中各类菌型的构成取决于其在环境中的分布。副溶血性弧菌是自然栖生菌,其非致病菌型的构成高于致病菌型。现有检测手段无论是增菌还是选择性分离对不同菌型的选择性相似,且不同菌型的生化结果也相似。因此,在食品检验中如不考虑血清分型和毒力因子检测,筛检到能引起人类明显症状的菌型概率远低于腹泻标本。
综上所述,副溶血性弧菌监测需建立在对主要菌型掌握的基础上,对其监测应包括血清型和基因型的分析。食品监测和检验时需考虑到人源株的主要构成,并据此有重点地对食品进行检测。由于经济、技术水平的限制,血清分型和毒力因子检测目前在大部分标准中仍是可选项目,而不是必需项目,但相对于已废止的检测标准(GB/T 4789-1994、GB/T 4789-2003、SN 0173-1992),大部分检测标准已明显考虑到血清分型和毒力因子在副溶血性弧菌监测和检测中的重要性。
[1] Parveen S, Hettiarachchi KA, Bowers JC, Jones JL, Tamplin ML, McKay R, Beatty W, Brohawn K, Dasilva LV, Depaola A. Seasonal distribution of total and pathogenic Vibrio parahaemolyticus in Chesapeake Bay oysters and waters [J]. Int J Food Microbiol, 2008, 128(2): 354-361.
[2] 周浩, 张静. 2010年全国其他感染性腹泻监测现状分析 [J]. 疾病监测, 2012, 27(3): 184-187.
[3] 褚发军, 冉陆, 马莉, 林羡华. 2008—2010年全国突发公共卫生事件网络报告食物中毒流行病学分析 [J]. 中国食品卫生杂志, 2012, 24(4): 387-390.
[4] 陆广珍, 李湘弟, 王茵茵, 王刚毅, 王月琴, 尤锡根. 副溶血性弧菌的菌型分布调查及K组合血清的简易分型研究 [J]. 上海医学, 1986, 9(7): 410-413.
[5] Shimohata T, Takahashi A. Diarrhea induced by infection of Vibrio parahaemolyticus [J]. J Med Invest, 2010, 57(3-4): 179-182.
[6] Broberg CA, Calder TJ, Orth K. Vibrio parahaemolyticus cell biology and pathogenicity determinants [J]. Microbes Infect, 2011, 13(12-13): 992-1001.
[7] 顾宝柯, 金汇明, 李生, 林亚萍, 周廷魁. 上海市腹泻病流行病学监测报告 [J]. 上海预防医学杂志, 2000, 12(9): 414-415,419.
[8] 刘弘, 陆屹, 高围溦, 陆冬磊, 段胜钢, 吴春峰, 邢之慧, 袁微嘉, 秦璐昕. 2008年上海市食源性疾病监测 [J]. 中国食品卫生杂志, 2011, 23(2): 126-131.
[9] Bej AK, Patterson DP, Brasher CW, Vickery MC, Jones DD, Kaysner CA. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl, tdh and trh [J]. J Microbiol Methods, 1999, 36(3): 215-225.
[10] 王茵茵, 黄晓哲, 王月琴, 席曼芳. 上海地区副溶血弧菌血清分型状况研究 [J]. 中国公共卫生, 1992, 8(7): 289-290.
[11] 张红芝, 顾其芳, 刘诚, 刘玥, 於颖. 2009—2012年上海市副溶血性弧菌血清分型研究 [J]. 中国食品卫生杂志, 2013, 25(4): 363-366.
[12] Iwamoto M, Ayers T, Mahon BE, Swerdlow DL. Epidemiology of seafood-associated infections in the United States [J]. Clin Microbiol Rev, 2010, 23(2): 399-411.
[13] Vuddhakul V, Soboon S, Sunghiran W, Kaewpiboon S, Chowdhury A, Ishibashi M, Nakaguchi Y, Nishibuchi M. Distribution of virulent and pandemic strains of Vibrio parahaemolyticus in three molluscan shellfish species (Meretrix meretrix, Perna viridis, and Anadara granosa) and their association with foodborne disease in southern Thailand [J]. J Food Prot, 2006, 69 (11): 2615-2620.
[14] Bhoopong P, Palittapongarnpim P, Pomwised R, Kiatkittipong A, Kamruzzaman M, Nakaguchi Y, Nishibuchi M, Ishibashi M, Vuddhakul V. Variability of properties of Vibrio parahaemolyticus strains isolated from individual patients [J]. J Clin Microbiol, 2007, 45(5): 1544-1550.

