结核分枝杆菌GroEL1蛋白过表达的生理效应分析
郝珂威,张鹭,何磊,刘丹,秦正松,王洪海
1. 复旦大学生命科学学院遗传学研究所遗传工程国家重点实验室,上海 200433; 2. 复旦大学附属华山医院感染科,上海 200040; 3. 上海中医药大学病原生物学教研室,上海 201203
GroEL蛋白是热休克蛋白60(heat shock protein 60,HSP60)的类似物,在生物体内帮助折叠10%~15%的细胞内蛋白[1,2],尤其是在新生蛋白质的正确折叠和组装及变性蛋白质的恢复过程中起重要作用。
结核分枝杆菌(Mycobacteriumtuberculosis)基因组携带2组groEL基因,即groEL1和groEL2,分别编码GroEL1(HSP60)和 GroEL2(HSP65)蛋白。两者虽然有61%的序列同源性[3],但GroEL1蛋白非细胞生存所必需。在分枝杆菌中,GroEL1表达受具有强启动子的GroEL1操纵子控制,巨噬细胞感染时可迅速上调,还可通过调节表达应对热激、氧压等环境压力[4]。有研究显示,GroEL1有呈递肿瘤免疫显性抗原至细胞表面的作用[5]。同时,GroEL1具有比GroEL2更强的细胞因子诱导能力[6]。无论是在小鼠还是豚鼠中,GroEL1突变体都不能产生肉芽肿炎症,这与GroEL1突变引起细胞因子减少表达一致[7,8]。因此,GroEL1可能是结核分枝杆菌感染中控制细胞因子依赖性肉芽肿产生的关键因子[9]。虽然无法确定免疫调节功能是否代表GroEL1在分枝杆菌中的基本作用,但GroEL1因具有分子伴侣和免疫优势抗原的双重功能而越来越受到广泛关注[10]。
不同物种来源的GroEL1蛋白生物功能差别较大,蛋白序列或结构的微小变化都会对其活性产生巨大影响。如在条件致病性物种,即携带重组pMV261∷Rv3417c质粒的耻垢分枝杆菌(MSG)中,GroEL1启动子更活跃,编码蛋白具有在生物膜形成过程中调控分枝菌酸(分枝杆菌细胞壁的长链脂肪酸成分)合成的功能[11]。在结核分枝杆菌中,虽然人们对GroEL1的抗原性、DNA分子伴侣功能、分子结构有了深入了解[12,13],但GroEL1表达水平变化对细菌生理状态的影响鲜少受到关注。据此,本文构建了过表达结核分枝杆菌GroEL1的MSG,通过细菌形态、生长能力、药物耐受、小鼠胞内生长能力等指标,分析过表达GroEL1的生理效应,为探讨结核分枝杆菌GroEL1蛋白的生物功能提供实验支持。
1 材料与方法
1.1 实验材料
1.1.1实验菌株和质粒结核分枝杆菌实验室标准株H37Rv由上海市肺科医院提供并培养。耻垢分枝杆菌MC2155、大肠埃希菌DH5a,以及pET28a质粒和pMV261分枝杆菌穿梭转化质粒均为本实验室保存。
1.1.2试剂和试剂盒EcoRⅠ、BamHⅠ内切酶与T4 DNA连接酶购自NEB公司,Fast Pfu DNA聚合酶购自TransGene公司。细菌基因组小量抽提试剂盒、质粒抽提试剂盒、凝胶纯化试剂盒和聚合酶链反应(polymerase chain reaction,PCR)产物纯化试剂盒购自Axygen公司。分枝杆菌培养用Middlebrook 7H9、Middlebrook 7H10培养基,Middlebrook ADC增菌液为BD-BBL BD Difco产品。
1.2 方法
1.2.1Rv3417c穿梭质粒的构建采用大肠埃希菌和结核分枝杆菌穿梭质粒pMV261构建pMV261∷Rv3417c重组子。上游引物为5′-TT- GAATTCATGAGCAAGCTGATCGAATACGAC- G-3′,下游引物为5′-TAGGATCCGCGTGCCCG- TGGTGATGG- 3′,下划线部分分别为上游和下游酶切位点(EcoRⅠ和BamHⅠ)。扩增的Rv3417c基因及pMV261空质粒经双酶切、连接、转化入大肠埃希菌DH5a 菌株。提取重组穿梭质粒pMV261∷Rv3417c,经双酶切鉴定及基因测序验证。
1.2.2MSG菌株的构建取生长至对数期的耻垢分枝杆菌,放置冰上1.5 h,4 ℃ 5 000g离心20 min,收集菌体,10%无菌甘油洗5次。制备好的感受态细胞于10%无菌甘油中保存备用。电转化构建MSG按文献[8]方法进行。室温下215 kV、25 μF、1 000 Ω进行电转化,冰浴后在Middlebrook 7H9-OADC 培养基中37 ℃复苏培养4 h,在含50 mg/L卡那霉素的Middlebrook 7H10-OADC平板上涂布筛选阳性克隆,菌落进行PCR鉴定。
1.2.3MSG扫描电子显微镜样品的制备分别收集1 ml对数期和稳定期的重组细菌,滴加固定液,轻摇混匀。8 000g离心10 min,彻底弃上清液,缓慢加入1 ml固定液,尽量不要让菌块散开,4 ℃保存。用2.5%戊二醛1 ml重悬细胞,逐渐增加每次所用乙醇的浓度(20%、40%、60%、70%、80%、90%、100%)进行脱水。用1 ml醋酸异戊酯洗细胞,重悬于1 ml醋酸异戊酯中,4 ℃静置过夜以置换乙醇。然后将细胞均匀涂布于盖玻片上,待醋酸异戊酯挥发后,用二氧化碳临界点干燥置换细胞内的醋酸异戊酯,喷金,用JSM 6360型扫描电子显微镜在28 kV下进行观察。以携带pMV261空质粒的耻垢分枝杆菌(MSP)作为对照组。
1.2.4MSG生长曲线的测定将MSP和MSG在含卡那霉素和0.05%吐温80的液体Middlebrook 7H9培养基中37 ℃培养2~3 d,反复活化3~4代。调整菌液浓度,按2%接种量接种至50 ml液体培养基中,37 ℃振荡培养。每隔4~8 h测定细菌在600 nm处的吸光度(optical density,OD),绘制细菌生长曲线。
1.2.5MSG的药敏试验取培养至对数期的菌液4 ml,加入1 ml直径为2~3 mm的无菌玻璃砂,振荡20~30 s,静置沉淀10 min。吸取菌悬液上清液,用液体培养基调整比浊至1个麦氏单位(相当于107CFU/ml)备用。 每种药物用液体培养基稀释至所需实验浓度(2×终浓度)。受试药物均设置6个终浓度:0.031 25、0.062 5、0.125、0.25、0.5、1 g/ml。检测时,各取上述药物溶液100 μl,加至96孔板中,再加入104CFU/ml 的菌液100 μl,37 ℃孵育。空白对照组不加任何药物。同一药物稀释度设2组平行对照。观察各药物对菌株的最低抑菌浓度(minimum inhibitory concentration,MIC)。
1.2.6MSG的毒力检测雌性BALB/c小鼠〔(20±2) g〕共130只,分为无注射对照组、磷酸盐缓冲液(phosphate buffered saline,PBS)对照组、MSP组和MSG组。无注射对照组4只,其余每组42只。每组动物分别于感染第1、3、6、9、12、15、20天取6只小鼠,进行检测。每组动物尾静脉注射5×106个细菌/只。感染用细菌同时进行CFU计数,以确定准确的感染剂量。对照组给予等量PBS注射,无注射对照组不给予注射。各组感染小鼠在不同时间点脱颈处死,肺、脾和肾组织一半用于CFU计数,另一半固定,并取第6、12和20天的各种组织标本进行切片和苏木精-伊红(hematoxylin-eosin, HE)染色。每个时间点取3只。对照组取3只。
2 结果
2.1 pMV261∷Rv3417c重组质粒的构建
用1%琼脂糖凝胶电泳,割胶回收Rv3417c的PCR目的片段,与pMV261一起分别用EcoRⅠ和BamHⅠ限制性内切酶37 ℃酶切4 h,16 ℃过夜连接后转化DH5α感受态细胞,挑取单菌落转接于含抗生素的液体LB培养基中进行培养。提取质粒,酶切鉴定重组质粒,获得阳性克隆。如图1显示,经过双酶切处理后,重组的pMV261∷Rv3417c质粒均有1 600 bp的条带。阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
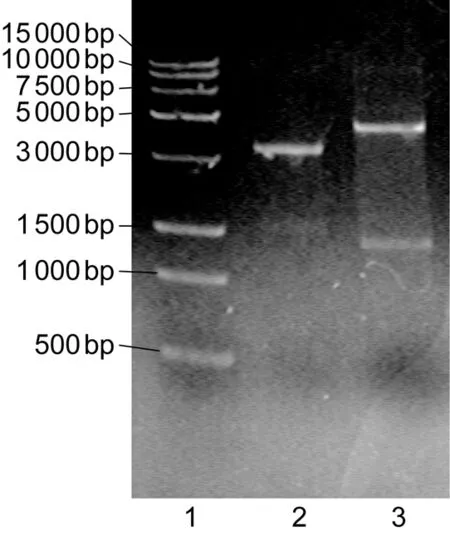
The gene products from recombinant pMV261∷Rv3417c plasmid were analyzed after being cut with the restriction enzyme EcoRⅠ and BamHⅠ. 1, Trans15K DNA marker; 2, recombinant pMV261∷Rv3417c plasmid; 3, recombinant pMV261∷Rv3417c plasmid digested with EcoRⅠ and BamHⅠ.
2.2 MSG菌株的构建
用DNAStar软件比对后,将基因序列正确的重组质粒转入耻垢分枝杆菌感受态细胞。平板涂布培养,选择阳性克隆,转入含卡那霉素的液体Middlebrook 7H9培养基,裂解细菌转化到DH5α感受态细胞中,接种培养细菌并提取质粒。以质粒为模板,用Rv3417c基因PCR引物扩增片段。如图2所示,MSP中无特异条带;而重组有穿梭质粒pMV261∷Rv3417c的MSG则能扩增出1 600 bp的特异条带。
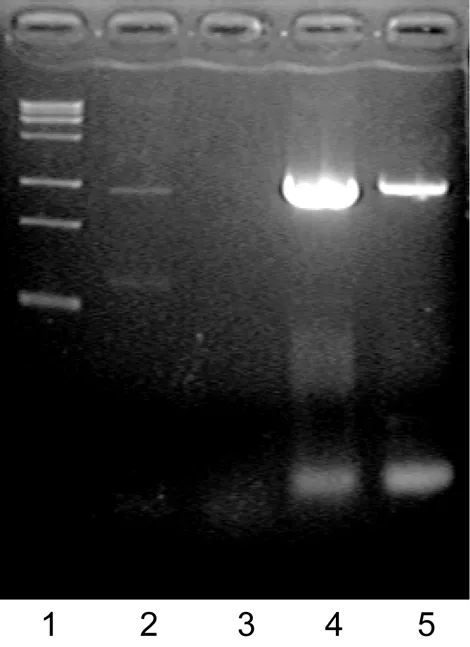
The amplified gene products from recombinant pMV261∷Rv3417c plasmid were analyzed by PCR after being transfered into M. smegmatis. 1, Trans15K DNA marker; 2, MSG1; 3, MSP; 4, MSG2; 5, MSG3.
2.3 MSG细胞形态的电子显微镜观察
如图3所示,MSG的细胞外观形态没有明显变化,均为长杆状,边缘清晰,细胞壁厚度、细胞膜、核区和片层体在不同菌株中没有明显差异。但比较细菌的胞内成分发现,在稳定期,过表达GroEL1蛋白的MSG胞内一些内源性颗粒状贮藏物及核糖体含量增加,而MSP胞内核糖体数目明显减少,且脂肪滴类贮藏物增多。

The bacterial morphology in different phases under transmission electron microscope. A: MSG in log phase. B: MSP in log phase. C: MSG in stationary phase. D: MSP in stationary phase.
图3MSG的电子显微镜观察
Fig.3Bacterialmorphologyundertransmissionelectronmicroscope
2.4 MSG的培养特征
MSG在37 ℃震荡培养条件下,每隔4~8 h检测细菌培养液的OD600,据此绘制耻垢分枝杆菌的生长曲线。以MSP为对照。
由图4可见,在震荡培养条件下,过表达Rv3417c的MSG生长能力明显强于MSP。虽然两者在迟滞期和对数中期没有明显生长差异,但过表达Rv3417c的MSG对环境的适应能力和生长能力均明显增高。
2.5 MSG的MIC
Rv3417c基因通过穿梭质粒pMV261转入利福平(rifampicin,RIF)敏感的耻垢分枝杆菌后,菌株对利福平、异烟肼(isoniazid,INH)、乙胺丁醇(ethambutol,EMB)的MIC值见表1。结果显示,与MSP相比,MSG的MIC值几乎没有变化,提示Rv3417c在耻垢分枝杆菌中的表达并不能增加体外培养细菌对RIF、INH、EMB等一线和二线抗结核药物的抗性。
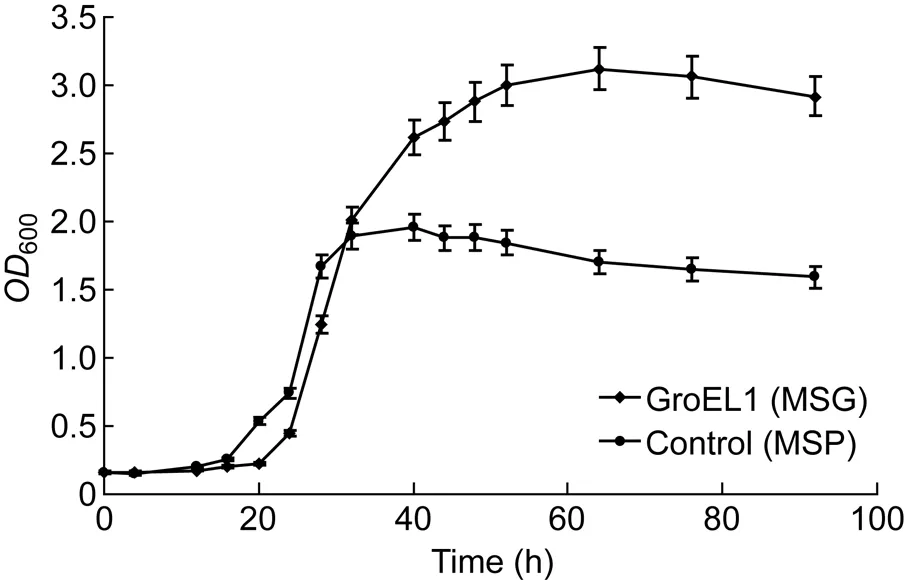
图4 MSG的生长曲线Fig.4 Growth curve of recombinant Mycobacterium smegmatis
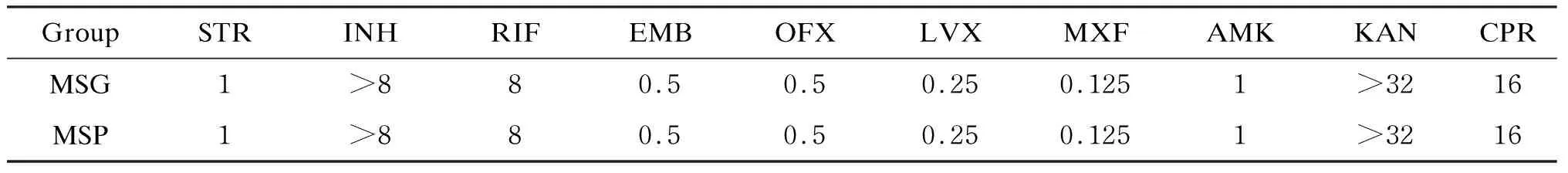
表1 MSG的MIC(μg/ml)Tab.1 MIC (μg/ml) of recombinant Mycobacterium smegmatis
2.6 MSG感染BALB/c小鼠的结果分析
比较MSP与MSG在BALB/c小鼠肺、脾、肾内的生存力差异(组织内生存时间和组织内荷菌数)及致病力差异(病理改变)。结果如图5、6所示,随着时间延长,小鼠肺、脾内荷菌数逐渐下降,但长时间感染(15 d)后,2种脏器中MSG的CFU计数均高于MSP。肾中MSP与 MSG的活菌数无显著差异。

图5 MSG感染小鼠后脾脏活菌计数Fig.5 Viable count in spleen of mice infected with MSG
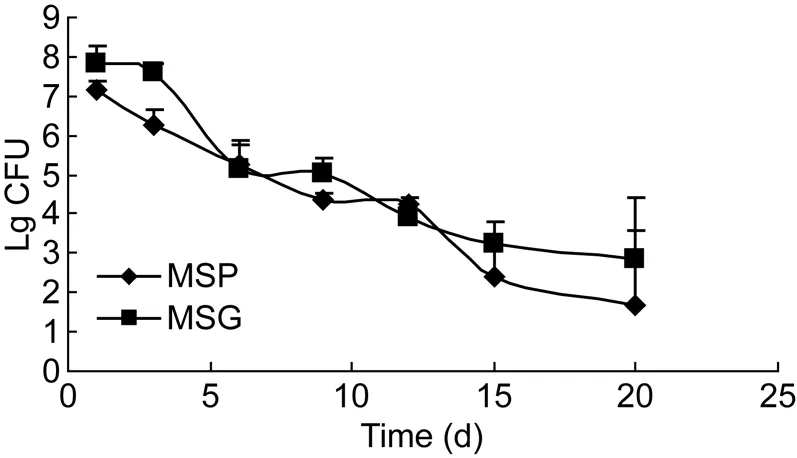
图6 MSG感染小鼠后肺部活菌计数Fig.6 Viable count in lung of mice infected with MSG
比较感染后期小鼠脏器对MSP和MSG的清除效果,2组有显著性差异。MSG攻击小鼠20 d后, 肺和脾内检测到活菌的小鼠分别有5只和6只。相应MSP攻击20 d后,肺和脾内检测到活菌的小鼠各只有3只(图7)。
20 d后,MSP攻击的小鼠肺部无典型特异性改变。镜下显著改变为肺泡壁部分毛细血管扩张、充血,部分上皮细胞坏死及脱落,伴有单核-巨噬细胞浸润,少量间质增生 (图8A、B)。MSG攻击的小鼠肺部出现炎性细胞浸润,肺泡结构被炎性浸出物渗透,肺泡壁充血、增厚,有较明显的肉芽肿形成(图8C)。
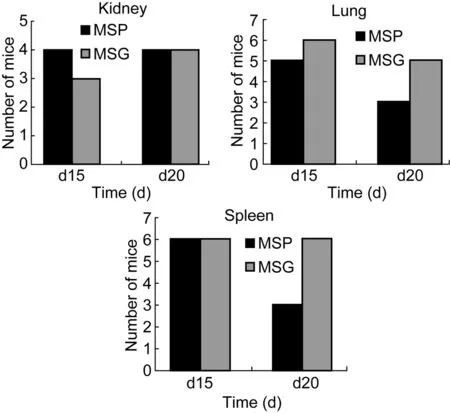
图7 长时间培养后不同脏器内检测到活菌的小鼠数量(只)Fig.7 Number of mice in which alive bacteria can be detected in different organs
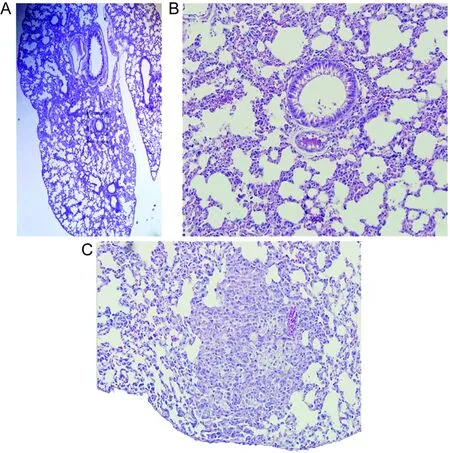
A and B: Lung of mice infected with MSP. C: Lung of mice infected with MSG.
3 讨论
GroEL是一族伴侣分子,具有促进蛋白质折叠、阻止蛋白在胞质沉积的作用[14],还具有免疫调节和免疫呈递功能。但免疫调节功能是否代表着GroEL1在分枝杆菌中的基本作用仍未知。尽管序列保守,但不同物种来源的GroEL1蛋白具有不同的生物活性,蛋白序列或结构的微小变化都会对其功能产生很大影响。这种功能变化是否会影响细菌形态、生长能力、药物耐受及在小鼠体内生存能力,从而产生一系列适应性生理效应,迄今未见系统的研究报道。
本研究构建了过表达结核分枝杆菌GroEL1蛋白的MSG。好氧状态下的生长曲线显示,GroEL1蛋白过表达并未增强细菌对新环境的适应能力,但明显增强菌株的生长、分裂能力,细菌得以充分利用环境最大容纳量扩大种群规模,稳定期时种群大小能达到对照菌种群的1.5倍。电子显微镜下,过表达GroEL1蛋白的细菌核糖体数目增加,在稳定期这一现象尤为明显。这不仅从形态学角度解释了过表达GroEL1蛋白后菌株的独特生长曲线,还提示GroEL1蛋白过表达可能导致细菌体内蛋白质合成能力提高,从而促进细菌活跃分裂,以对变化的环境条件作出应答。
本实验选用的是近交系BALB/c小鼠,它们具有相同的等位基因,遗传性状完全相同,同时统一培养在无菌环境内,降低了组内的个体差异及组间差异。国外多选用每组5~8只小鼠,而本研究室前期预实验中每组4只BALB/c小鼠用野生型耻垢分枝杆菌感染,培养30 d小鼠生长正常,无死亡。脏器活菌计数和病理改变结果显示,这种急性毒性实验模型建立是成功的。在此基础上,考虑到GroEL1蛋白过表达有可能增加细菌毒力,所以每组每个时间点动物数确定为6只。在小鼠机体清除攻毒细菌的过程中,本实验设计了20 d的时间跨度,每隔5 d检测体内活菌数,能较好体现小鼠对不同细菌的清除结果,避免因时间过短导致的差异现象不明显。图7显示的是长时间培养后不同脏器内检测到活菌的小鼠数量。每组被细菌成功感染的实验动物都是6只,感染20 d后,6只全部解剖后检测到肺脏还有活菌的动物数MSG组有5只,MSP组有3只,其余小鼠该脏器中未检测到活菌。该结果仅佐证了小鼠对MSG的清理效果比MSP较差,即MSG在小鼠体内存活力更强。
GroEL蛋白过表达并不能增加体外培养的细菌对RIF、INH、EMB等一线和二线抗结核药物的抗性,但这一结果仅限于体外营养充分条件下的分批培养状态。作为一种胞内寄生菌,细胞内贫营养、低pH值、低氧等限制性条件会改变细菌的生长状态,包括对药物的耐受程度。因此,下一步实验拟进行胞内细菌的耐药实验。
面对体内贫营养环境,分枝杆菌更多利用脂类作为碳源,维持其持续感染状态。体外培养时,GroEL1蛋白过表达破坏了这种赖以维持体内长期感染状态的营养基础,但细菌体内核糖体数量增加,有助于细菌快速增殖。GroEL1是否以类似机制提高分枝杆菌在小鼠内的生存能力,从而提高细菌毒力和致病性,解决这个问题将是充分解析GroEL1生理功能的重要环节。
选择小鼠的主要免疫器官脾、肺和肾作为研究对象,发现随着培养时间延长,各脏器内的活菌数量呈普遍下调趋势,但GroEL1过表达细菌在肺、脾内长期存活能力提高,在感染末期肺、脾内还能检测到活菌的动物数量也高于对照组。该结果提示,GroEL1过表达有助于细菌在动物体内长期存活。有研究指出,GroEL1是控制细胞因子依赖性肉芽肿反应的关键因子,其突变体无法在小鼠或豚鼠体内形成肉芽肿性炎症。本研究发现,GroEL1过表达会造成小鼠肺部出现明显的肉芽肿性病变,提示GroEL过表达可能会增加细菌毒力。
耻垢分枝杆菌生长快速,对人体无害。其作为研究结核分枝杆菌的模式菌株,已为大多数结核病研究者采用,用以研究病原菌的遗传特性、毒力因子、潜伏特性和抗结核药物筛选等[15-17]。对此,也有研究者提出异议[18]。争议主要集中在2个方面:一是耻垢分枝杆菌是非致病菌,在巨噬细胞中生存力很弱[19,20];二是作为模式菌研究侵染小鼠的毒力作用时,可见的毒力表现效果差强人意[21,22]。但本研究发现,过表达GroEL1的耻垢分枝杆菌可提高工程菌株在肺、脾内的长期存活能力,也会造成小鼠肺部出现明显的肉芽肿性病变。这些提示GroEL过表达可能与细菌毒力、体内生存能力增加相关。接下来拟构建GroEL1蛋白基因敲低和基因敲除的MSG,以确证GroEL的生理功能。在此基础上,采用结核分枝杆菌H37Ra株或H37Rv株进一步证实。
细菌生理变化是细菌生长、代谢、毒力等的综合体现。对分枝杆菌这类致病微生物而言,研究GroEL1蛋白对细菌生理的影响,有助于综合评价其基因的生物功能,为分枝杆菌生长调控、致病机制的研究提供重要线索。
[1] Ewalt KL, Hendrick JP, Houry WA, Hartl FU. In vivo observation of polypeptide flux through the bacterial chaperonin system [J]. Cell, 1997, 90(3): 491-500.
[2] Houry WA, Frishman D, Eckerskorn C, Lottspeich F, Hartl FU. Identification of in vivo substrates of the chaperonin GroEL [J]. Nature, 1999, 402 (6758): 147-154.
[3] Goyal K, Qamra R, Mande SC. Multiple gene duplication and rapid evolution in the groEL gene: functional implications [J]. J Mol Evol, 2006, 63(6): 781-787.
[4] Aravindhan V, Christy AJ, Roy S, Ajitkumar P, Narayanan PR, Narayanan S. Mycobacterium tuberculosis groE promoter controls the expression of the bicistronic groESL1 operon and shows differential regulation under stress conditions [J]. FEMS Microbiol Lett, 2009, 292(1): 42-49.
[5] Kaufmann SH, Väth U, Thole JE, Van Embden JD, Emmrich F. Enumeration of T cells reactive with Mycobacterium tuberculosis organisms and specific for the recombinant mycobacterial 64-kDa protein[J]. Eur J Immunol, 1987, 17 (3) : 351-357.
[6] Lewthwaite JC, Coates AR, Tormay P, Singh M, Mascagni P, Poole S, Roberts M, Sharp L, Henderson B. Mycobacterium tuberculosis chaperonin 60.1 is a more potent cytokine stimulator than chaperonin 60.2(Hsp 65) and contains a CD14-binding domain [J]. Infect Immun, 2001, 69(12): 7349-7355.
[7] Lamb JR, Bal V, Mendez-Samperio P, Mehlert A, So A, Rothbard J, Jindal S, Young RA, Young DB. Stress proteins may provide a link between the immune response to infection and autoimmunity [J]. Int Immunol, 1989, 1(2):191-196.
[8] Canova MJ, Kremer L, Molle V. The Mycobacterium tuberculosis GroEL1 chaperone is a substrate of Ser/Thr protein kinases [J]. J Bacteriol, 2009, 191(8): 2876-2883.
[9] Bhatt A, Molle V, Besra GS, Jacobs WR Jr, Kremer L. The Mycobacterium tuberculosis FAS-II condensing enzymes: their role in mycolic acid biosynthesis, acid-fastness, pathogenesis and in future drug development [J]. Mol Microbiol, 2007, 64(6):1442-1454.
[10] 何磊, 张鹭, 彭超, 王洪海. 结核分枝杆菌热休克蛋白GroEL1的研究进展[J].微生物与感染, 2010, 5(3): 186-191.
[11] Ojha A, Anand M, Bhatt A, Kremer L, Jacobs WR Jr, Hatfull GF. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria [J]. Cell, 2005, 123(5):861-873.
[12] Basu D, Khare G, Singh S, Tyagi A, Khosla S, Mande SC. A novel nucleoid-associated protein of Mycobacterium tuberculosis is a sequence homolog of GroEL [J]. Nucleic Acids Res, 2009, 37(15): 4944-4954.
[13] Das Gupta T, Bandyopadhyay B, Das Gupta SK. Modulation of DNA-binding activity of Mycobacterium tuberculosis HspR by chaperones [J]. Microbiology, 2008, 154 (Pt 2):484-490.
[14] Gething MJ, Sambrook J. Protein folding in the cell [J]. Nature, 1992, 355(6355): 33-45.
[15] Guo XQ, Wei YM, Yu B. Recombinant Mycobacterium smegmatis expressing Hsp65-hIL-2 fusion protein and its influence on lymphocyte function in mice [J]. Asian Pac J Trop Med, 2012, 5(5): 347-351.
[16] Shiloh MU, DiGiuseppe Champion PA. To catch a killer. What can mycobacterial models teach us about Mycobacterium tuberculosis pathogenesis [J]? Curr Opin Microbiol, 2010, 13(1): 86-92.
[17] Altaf M, Miller CH, Bellows DS, O′Toole R. Evaluation of the Mycobacterium smegmatis and BCG models for the discovery of Mycobacterium tuberculosis inhibitors [J]. Tuberculosis (Edinb), 2010, 90(6): 333-337.
[18] Reyrat JM, Kahn D. Mycobacterium smegmatis: an absurd model for tuberculosis [J]? Trends Microbiol, 2001, 9 (10):472-474.
[19] Tyagi JS, Sharma D. Mycobacterium smegmatis and tuberculosis [J]. Trends Microbiol, 2002, 10(2): 68-69.
[20] Jordao L, Bleck CK, Mayorga L, Griffiths G, Anes E. On the killing of mycobacteria by macrophages [J]. Cell Microbiol, 2008, 10(2): 529-548.
[21] Anes E, Peyron P, Staali L, Jordao L, Gutierrez MG, Kress H, Hagedorn M, Maridonneau-Parini I, Skinner MA, Wildeman AG, Kalamidas SA, Kuehnel M, Griffiths G. Dynamic life and death interactions between Mycobacterium smegmatis and J774 macrophages [J]. Cell Microbiol, 2006, 8(6): 939-960.
[22] Bange FC, Collins FM, Jacobs WR Jr. Survival of mice infected with Mycobacterium smegmatis containing large DNA fragments from Mycobacterium tuberculosis [J]. Tuber Lung Dis, 1999, 79(3): 171-180.

