布鲁菌omp19原核表达和间接酶联免疫吸附试验检测布鲁菌方法的建立
王娜,呼和巴特尔,崔步云
1. 内蒙古农业大学,呼和浩特 010018; 2. 传染病预防控制国家重点实验室,感染性疾病诊治协同创新中心,中国疾病预防控制中心传染病预防控制所,北京 102206
布鲁菌病是由布鲁菌引起的一种人畜共患传染病,近年来在全世界范围内呈明显流行趋势,严重威胁人类健康和公共卫生[1-3]。该菌是一种胞内寄生革兰阴性菌,细胞壁结构复杂,由至少75种蛋白组成[4,5]。目前许多研究者都将研究重点放在bp26、Omp31、L7/12等蛋白上,对Omp19研究较少。有报道称,Omp19的重组蛋白口服疫苗既能引起细胞免疫也能引起体液免疫,具有抗不同型布鲁菌的保护作用[6],也可作为布鲁菌血清学诊断的候选抗原之一[7]。另有研究报道,马耳他型布鲁菌自然感染的羊血清大部分能与Omp19发生抗原抗体特异性反应,而在流产布鲁菌自然感染的牛血清中几乎不发生血清学反应[8,9]。为此,本研究选用布鲁菌omp19基因,克隆表达此重组蛋白,并将其作为包被抗原,建立间接酶联免疫吸附试验(indirect enzyme-linked immunosorbent assay,iELISA)[10,11],对临床血清样本进行检测。
1 材料与方法
1.1 材料
1.1.1质粒与菌株大肠埃希菌DH5a和BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司,pET-30a(+)质粒、牛种布鲁菌1型标准菌株544A、布鲁菌病血清凝集抗原、阳性血清等均由中国疾病预防控制中心传染病预防控制所布鲁菌病室制备和保存。90份羊血清于2013年4月采自山西省晋中市一养殖场,采用GB/T 18645-2002《动物布鲁氏菌病诊断技术》中标准血清凝集试验(standard serum agglutination test,SAT)方法来检测并确定阴性和阳性血清标本。
1.1.2主要试剂细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司,限制性内切酶EcoRⅠ、XhoⅠ、T4 DNA连接酶、诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)购自TaKaRa公司,辣根过氧化物酶免疫球蛋白G(horseradish peroxidase immunoglobulin G,IgG-HRP)购自Sigma公司,蛋白分子量标准、BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司,His标签蛋白纯化柱购自北京博泰斯生物技术有限公司。其他试剂均为分析纯。
1.2 方法
1.2.1引物设计与合成根据GenBank中的牛种omp19基因序列(登录号: L27997.1)及pET-30a载体的质粒图谱,设计引物如下。omp19_F:CCGGAATTCATGGGAATTTCAAAAGCAAG(下划线部分为EcoR Ⅰ酶切位点);omp19_R:CCGCTCGAGTCAGCGCGACAGCGTCACGG(下划线部分为XhoⅠ酶切位点),扩增片段大小为534 bp,引物由北京擎科新业生物技术有限公司合成。
1.2.2目的基因扩增按细菌基因组DNA提取试剂盒说明提取DNA,以其为模板,扩增omp19基因。聚合酶链反应(polymerase chain reaction,PCR)体系(20 μl):DNA模板0.5 μl,2×Taq Master Mix 10 μl,灭菌蒸馏水8.5 μl,上、下游引物各0.5 μl。扩增参数:95 ℃预变性5 min;95 ℃变性1 min,59 ℃退火1 min,72 ℃延伸2 min,共30个循环;72 ℃延伸5 min。PCR产物经1.5%琼脂糖凝胶电泳验证后,用琼脂糖凝胶DNA回收纯化试剂盒进行纯化(按说明书进行)。
1.2.3重组质粒构建及阳性克隆筛选将纯化后回收的PCR产物和表达载体pET-30a分别经EcoRⅠ和XhoⅠ双酶切,酶切产物经1.5%电泳后纯化并回收,与T4 DNA连接酶16 ℃连接过夜;将连接产物转入大肠埃希菌DH5a感受态细胞中,挑单菌落摇菌过夜,同时做菌落PCR验证。次日提取质粒(按质粒提取试剂盒说明操作)并进行双酶切验证,送北京擎科新业生物技术有限公司进行序列分析。取序列正确的重组质粒pET-30a-omp19 3 μl,转入大肠埃希菌BL21(DE3)感受态细胞中,涂板,37 ℃孵育过夜,挑取单菌落进行培养。
1.2.4重组Omp19蛋白诱导表达及纯化取鉴定正确的重组菌液1 ml,按1∶100加入含卡那霉素(kanamycin,Kana)抗性的LB液体培养基中,37 ℃ 200 r/min摇菌;至吸光度(optical density,OD)值达0.6~1.0时,按1∶1 000加入诱导剂IPTG,使其终浓度为1.0 mmol/L,37 ℃ 200 r/min诱导4 h;离心,去上清液,加4×蛋白上样缓冲液,煮沸,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析。
将高速离心后的菌液用磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,超声破碎30 min,12 000 r/min离心,沉淀物用8 mol/L尿素溶解45 min,离心,收集上清液,用0.22 μm膜过滤。用注射器手推His标签蛋白纯化柱,流速2.5 ml/min。上样完成后,用至少5×结合缓冲液过柱,洗去杂蛋白;然后用5×洗脱缓冲液洗脱目的蛋白,收集洗脱液时分5管收集,并用BCA蛋白定量试剂盒测定蛋白浓度;洗脱完成后,用10×洗脱缓冲液过柱,彻底洗去残留蛋白,再用10×纯水过柱;最后用20%乙醇过柱以便柱子重复利用。用SDS-PAGE进行纯化效果分析。
1.2.5纯化产物的蛋白免疫印迹鉴定将纯化后获得的Omp19重组蛋白经15%SDS-PAGE分离,半干式电转膜仪将其转至硝酸纤维素膜上;含5%脱脂奶粉的封闭液4 ℃封闭过夜后,用含吐温20的磷酸盐缓冲液(phosphate buffered saline with Tween-20,PBST)洗3次,每次10 min;加入16M免疫血清(1∶100稀释),37 ℃孵育2 h;洗涤后,加入HRP标记的鼠抗羊IgG(1∶20 000稀释),孵育2 h。最后用3, 3′-二氨基联苯胺(diaminobenzidine,DAB)显色液洗膜,加蒸馏水终止显色反应。
1.3 iELISA检测方法的建立


1.3.3iELISA阴性和阳性临界值的确定将纯化后的蛋白按最佳浓度包被,每孔100 μl,37 ℃孵育4 h;用1%无蛋白封闭液4 ℃封闭过夜,用PBST洗涤。取90份羊血清按最佳浓度进行稀释,每孔100 μl,孵育1 h;用PBST洗5次,加二抗,孵育1 h;加100 μl TMB显色液,常温避光显色10 min;最后加50 μl终止液终止反应,用酶标仪读取波长为450 nm时的OD值,通过SPSS软件计算临界值。
1.4 对比实验
将90份羊血清iELISA检测结果与SAT检测结果进行比较,建立四线表。
2 结果
2.1 omp19基因扩增产物的鉴定
omp19基因的PCR扩增产物经1.5%琼脂糖凝胶电泳,结果显示,在约530 bp处可见特异性条带,扩增片段大小与预期大小(534 bp)相符(图1)。

M,Trans2K plus DNA marker; 1 and 2, the amplification of PCR products of omp19 gene.
2.2 重组表达质粒的鉴定
将重组表达质粒pET-30a-omp19进行双酶切鉴定,经1.5%琼脂糖凝胶电泳分析,可见重组质粒被切成2段,包括pET-30a和omp19基因片段,证明连接成功(图2)。重组质粒测序结果也显示,插入的基因片段全长534 bp,与GenBank中登记的omp19基因序列同源性达100%,证明重组质粒构建成功。

M,Trans2K plus DNA marker; 1, identification of recombinant plasmid pET-30a-omp19.
2.3 表达产物的鉴定
2.3.1SDS-PAGE分析表达产物经15%SDS-PAGE分析,在相对分子质量约25 000处可见特异蛋白条带(Omp19相对分子质量约19 500,pET-30a标签大小约5 000),与预期相符,且表达量较大(图3)。目的蛋白主要存在于破碎菌沉淀物中,以包涵体形式表达,纯化效果较好。分管收集洗脱液蛋白后,可见管1、2、3中蛋白浓度较高,管4、5中该浓度可忽略不计(图4)。
2.3.2蛋白免疫印迹分析在相对分子质量25 000附近可见一条带,与目的条带大小相符,且表达量较大,证明纯化后重组蛋白与16M免疫羊血清(效价1∶800)发生了特异性抗原抗体结合,具有免疫原性。在19 000左右处出现另一条带,与考马斯亮蓝染色对比,推测为大肠埃希菌诱导产生的条带,为杂带(图5)。
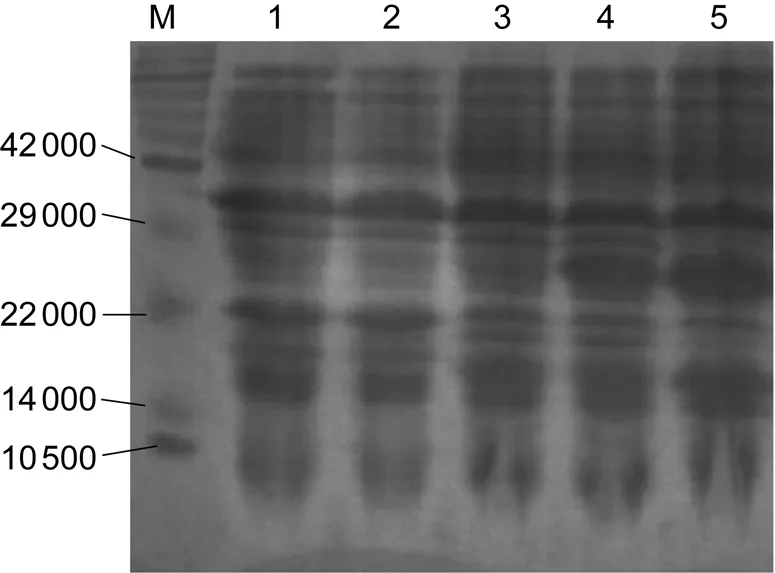
M, multicolor protein marker;1, induced BL21 (DE3) competent cells; 2, vector pET-30a;3, uninduced recombinant plasmid pET-30a-omp19; 4 and 5, induced recombinant plasmid pET-30a-omp19.

M, multicolor protein marker; 1, filtrate of Omp19; 2 to 6, five eluents.

M, multicolor protein marker; 2, purified Omp19.
2.4 iELISA检测结果
2.4.1包被浓度、血清和二抗稀释度的确定经棋盘滴定后,读取OD值,计算出抗原最佳稀释度为1∶100,则其最佳浓度为5.47 μg/ml。一抗和二抗最佳稀释度分别为1∶50和1∶15 000(表1、2)。

表1 Omp19棋盘滴定的值Tab.1 The value of checkerboard titration of Omp19

表2 Omp19蛋白IgG-HRP稀释度的值Tab.2 The value of IgG-HRP dilution of Omp19
2.4.2iELISA临界值的确认根据以上确认的最佳包被浓度、血清和二抗浓度,测定90份羊血清Omp19抗原反应情况,并用SPSS软件对其OD值进行分析。通过受试者工作特征曲线(receiver operating characteristic curve,ROC),算得曲线下面积为0.82,>0.5,表明诊断真实度较高。选灵敏度和特异度之和最大时所对应的OD值,最终确定临界值为0.412,即待测样品的OD450>0.412时为阳性,≤0.412则为阴性。
2.4.3iELISA与SAT结果比对实验通过临界值进一步对iELISA结果进行判断,并与SAT进行比较(表3)。对90份羊血清样品进行iELISA检测,阳性符合率为95.12%,阴性符合率为67.35%。以SAT检测结果为参照,得出iELISA与SAT的检测总符合率(即SAT与iELISA检测结果相一致的样品数除以检测样品总数)为80%。经一致性Kappa检验,Kappa值为0.607 7,为中度一致。对2种方法进行McNemar卡方检验,P=0.000 96,<0.05,认为这2种方法存在显著性差异。

表3 iELISA与SAT结果比较Tab.3 Comparison between iELISA and SAT results
3 讨论
Omp19是布鲁菌菌体外膜脂蛋白,参与布鲁菌对物质的利用过程及细胞壁的产生。它由177个氨基酸组成,存在于所有已知布鲁菌菌种和生物型中。Omp19是布鲁菌重要的免疫原性蛋白。1996年,Tibor等首次克隆表达了Omp19,并证明其具有抗原性,与布鲁菌毒力密切相关[12]。
pET-30a是一个能在原核细胞中高效表达插入的外源基因片段的原核表达载体。本研究通过双酶切omp19基因及pET-30a载体,使其两端产生非互补性黏性末端,保证目的基因正向克隆至pET-30a多克隆位点,使omp19在BL21细胞中正确表达。利用His标签蛋白纯化柱纯化表达蛋白并进行蛋白免疫印迹分析,结果显示Omp19具有免疫原性。
我国GB/T 18645-2002《动物布鲁氏菌病诊断技术》和WS 269-2007《布鲁氏菌病诊断标准》均规定SAT是布鲁菌病血清学诊断的确诊方法。虽然全菌抗原存在交叉凝集现象,但SAT是目前动物和人布鲁菌抗体检测最恰当的方法,我国对布鲁菌病诊断试剂的评价均以此为参照,本研究也将用此法确定为阳性和阴性的标本作为参照。结果显示,以Omp19为抗原,以IgG为酶标二抗的iELISA检测方法与SAT的阳性符合率为95.12%,且从SAT阴性样本中检测出阳性样本。对2种方法的Kappa检验也表明iELISA的总体检测能力达中度以上水平。如果将其开发为诊断试剂,用于布鲁菌检测,配合SAT,可降低漏检率,使更多患者得到及时诊断,为降低慢性布鲁菌病的发生率有积极意义。
以Omp19为包被抗原的iELISA与SAT相比,iELISA阳性检出率较SAT低。有研究者分别用SAT及iELISA对牧场内牛、羊血清进行筛查,结果显示iELISA阳性率低于SAT。SAT以布鲁菌细胞作为抗原。Memish等[13]研究也表明,SAT检测抗体并未区分抗体的IgG和IgM种类。本研究出现阴性符合率偏低的原因可能有:①二抗种类单一,只对IgG类抗体进行了检测,忽略了IgM类抗体;②单一蛋白作为抗原只能检测一种抗体,而血清中存在多种抗布鲁菌的抗体,必然低于以全菌蛋白作为抗原的SAT。联合应用IgG与IgM抗体检测血清,可在增加特异性的同时提高布鲁菌的检出率。
[1] 崔步云.中国布鲁氏菌病疫情监测与控制[J]. 疾病监测,2007, 22(10): 649-651.
[2] 满腾飞,王大力,崔步云,王赢,丁凡,李铁峰,孙辉,魏荣杰,李群,冯子健,殷文武. 2009年全国布鲁氏菌病监测数据分析[J]. 疾病监测,2010, 25(12):944-946.
[3] Olsen S, Tatm F. Bovine brucellosis [J]. Vet Clin North Am Food Anim Pract, 2010, 26(1):15-27.
[4] Golding B, Scott DE, Scharf O, Huang LY, Zaitseva M, Lapham C, Eller N, Golding H. Immunity and protection against Brucella abortus [J]. Microbes Infect, 2001, 3(1): 43-48.
[5] Sowa BA, Kelly K, Ficht TA, Frey M, Adams LG. SDS-soluble and peptidoglycan-bound proteins in the outer membrane-peptidoglycan complex of Brucella abortus [J]. Vet Microbiol, 1991, 27((3-4): 351-369.
[6] Pasquevich KA, Ibaez AE, Coria LM, García Samartino C, Estein SM, Zwerdling A, Barrionuevo P, Oliveira FS, Seither C, Warzecha H, Oliveira SC, Giambartolomei GH, Cassataro J. An oral vaccine based on U-Omp19 induces protection against B. abortus mucosal challenge by inducing an adaptive IL-17 immune response in mice [J]. PLoS One, 2011, 6(1): e16203.
[7] Pasquevich KA, Estein SM, García Samartino C, Zwerdling A, Coria LM, Barrionuevo P, Fossati CA, Giambartolomei GH, Cassataro J. Immunization with recombinant Brucella species outer membrane protein Omp16 or Omp19 in adjuvant induces specific CD4+and CD8+T cells as well as systemic and oral protection against Brucella abortus infection [J]. Infect Immun, 2009, 77(1): 436-445.
[8] Letesson JJ, Tibor A, van Eynde G, Wansard V, Weynants V, Denoel P, Saman E. Humoral immune responses of Brucella-infected cattle, sheep, and goats to eight purified recombinant Brucella proteins in an indirect enzyme-linked immunosorbent assay [J]. Clin Diagn Lab Immunol,1997, 4(5): 556-564.
[9] Tibor A, Saman E, de Wergifosse P, Cloeckaert A, Limet JN, Letesson JJ. Molecular characterization, occurrence, and immunogenicity in infected sheep and cattle of two minor outer membrane proteins of Brucella abortus [J]. Infect Immun,1996, 64(1): 100-107.
[10] 宫晓炜,邱昌庆,蔺国珍,郑福英,曹小安,王光华,周继章. 牛布氏杆菌间接ELISA检测方法的建立[J]. 中国兽医科学,2010, 40(6):598-602.
[11] Cloeckaert A, Tibor A, Zygmut MS. Brucella outer membrane lipoproteins share antigenic determinants with bacteria of the family Rhizobiaceae [J]. Clin Diagn Lab Immunol,1999, 6(4): 627-629.
[12] Tibor A, Decelle B, Letesson JJ. Outer membrane proteins Omp10, Omp16, Omp19 of Brucella spp. are lipoproteins [J]. Infect Immun, 1999, 67(9): 4960-4962.
[13] Memish ZA, Almuneef M, Mah MW, Qassem LA, Osoba AO. Comparison of the Brucella Standard Agglutination Test with the ELISA IgG and IgM in patients with Brucella bacteremia [J]. Diagn Microbiol Infect Dis, 2002, 44(2): 129-132.

