全血γ干扰素释放试验在儿童和成人中的结核病诊断价值
鲍磊,李涛,卢水华
1. 复旦大学附属华山医院感染科,上海 200040; 2. 上海市公共卫生临床中心,上海 201508
结核病是由胞内感染病原菌——结核分枝杆菌(Mycobacteriumtuberculosis)引起的感染性疾病。全球约1/3人口受结核分枝杆菌感染,其中5%~10%最终发展为活动性结核,表现出发热、消瘦、盗汗等临床症状,即通常所说的结核病;而大部分机体感染结核分枝杆菌后,体内持续存在针对其特异性抗原的免疫反应,无相应临床症状,称为潜伏性结核[1, 2]。由于结核分枝杆菌感染后病灶和临床表现多样,结核病的诊断非常复杂。在过去的近1个世纪,结核菌素皮肤试验(tuberculin skin test, TST)是诊断结核病的主要方法,但由于其使用的纯化蛋白衍生物(purified protein derivative,PPD)会与卡介苗(bacillus Calmette-Guérin,BCG)接种及环境中存在的其他非结核分枝杆菌等存在交叉反应,所以在BCG高接种地区如中国可导致较多的假阳性结果。
以T细胞介导的免疫反应为基础的γ干扰素释放试验(interferon γ release assay, IGRA)是近年来研发并用于临床的一种新型免疫诊断方法,主要利用结核分枝杆菌特有的一段基因序列——RD1编码产生的6 kDa早期分泌抗原靶分子(early secreted antigenic target of 6 kDa,ESAT-6)和培养滤过蛋白10(culture filtrate protein 10,CFP-10)作为抗原,体外刺激机体特异性T细胞,产生细胞因子γ干扰素(interferon γ,IFN-γ),通过检测所释放的IFN-γ而进行结核分枝杆菌感染的诊断。由于RD1序列只存在于结核分枝杆菌中,不存在于BCG和环境中大部分其他分枝杆菌中,因此提高了检测的灵敏度和特异度。
目前IGRA有2种商用试剂盒:一种是通过酶联免疫斑点法(enzyme-linked immunospot assay,ELISPOT),计数外周血单核细胞经ESAT-6和CFP-10刺激后分泌IFN-γ的细胞个数,试剂盒为T-SPOT.TB;另一种试剂盒为QuantiFERON-TB Gold In-Tube(QFT-GIT),其主要原理是用ESAT-6和CFP-10刺激全血后,通过酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测上清液中IFN-γ的量,达到诊断结核分枝杆菌感染的目的。2005年QFT-GIT成为美国食品药品管理局(Food and Drug Administration,FDA)批准的第2个用于结核分枝杆菌感染辅助诊断的IGRA,操作更简便,不需分离单核细胞,但在我国尚未上市和使用[3]。现有的关于这项新技术的研究主要集中在欧美等结核病低发病率国家,对其在结核病高发地区中的应用报道较少,而对该检测方法在儿童中的诊断价值尚存在争议[4-6]。中国作为结核病高发地区,有较高的BCG接种率。本研究主要就QFT-GIT在中国成人和儿童中的结核病诊断价值进行评价。
1 材料与方法
1.1 研究对象
临床怀疑结核病的成人患者共60例,于2010年12月~2011年12月就诊于复旦大学附属华山医院,具有1条或以上下列表现:①发热、消瘦、盗汗等全身症状;②咳嗽、咳痰、咯血、胸痛等;③腹部包块、腹泻、便血等;④尿频、尿急、尿痛等;⑤头痛、呕吐、意识不清等;⑥腰背疼痛,伴有或不伴有病理性骨折等;⑦皮疹、皮下结节、淋巴结炎等。临床怀疑结核病的16岁以下患儿共60例,于2010年12月~2011年8月就诊于上海市公共卫生中心和复旦大学附属儿科医院,同样具有上述表现。所有入组患者均抽取静脉血行QFT-GIT检测。QFT-GIT结果不影响临床治疗方案的制订。所有入组儿童和成人的人类免疫缺陷病毒(human immunodeficiency virus,HIV)检测均为阴性。收集每例患者的基本信息、临床表现、实验室检查结果、影像学资料、病理报告、治疗方案等相关信息,根据以下分类标准进行诊断和分类[7](表1)。
1.2 QFT-GIT
QFT-GIT购自澳大利亚Cellestis公司,试剂盒包括阴性对照管(灰帽管)、阳性对照管﹝包被植物血凝素(phytohaemagglutinin,PHA),紫帽管﹞及TB抗原管﹝分别包被ESAT-6、CFP-10、TB7.7 (p4),红帽管﹞,其他试剂包括用于ELISA操作的微孔板、格林稀释液、Buffer洗剂等。QFT-GIT检测分2个步骤进行。步骤1:收集全血,进行刺激,采集上清液。首先在每个特定的全血收集管内分别收集1 ml全血,然后将所有采血管摇晃混匀后于37 ℃培养箱培养16~24 h,离心后收集上清液。步骤2:通过ELISA测量上清液中的IFN-γ。TB抗原管中的读数减去阴性对照管中的读数作为结核分枝杆菌特异性抗原刺激机体反应产生的IFN-γ量。如果该值≥0.35 IU/ml且≥25%阴性对照管,视为结果阳性。如果该值<0.35 IU/ml 或≥0.35 IU/ml但<25%阴性对照管,同时阳性对照管≥0.5 IU/ml,则视为阴性结果。如果该值<0.35 IU/ml或≥0.35 IU/ml但<25%阴性对照管,同时阳性对照管<0.5 IU/ml;或阴性对照管>8.0 IU/ml,视为结果不确定。
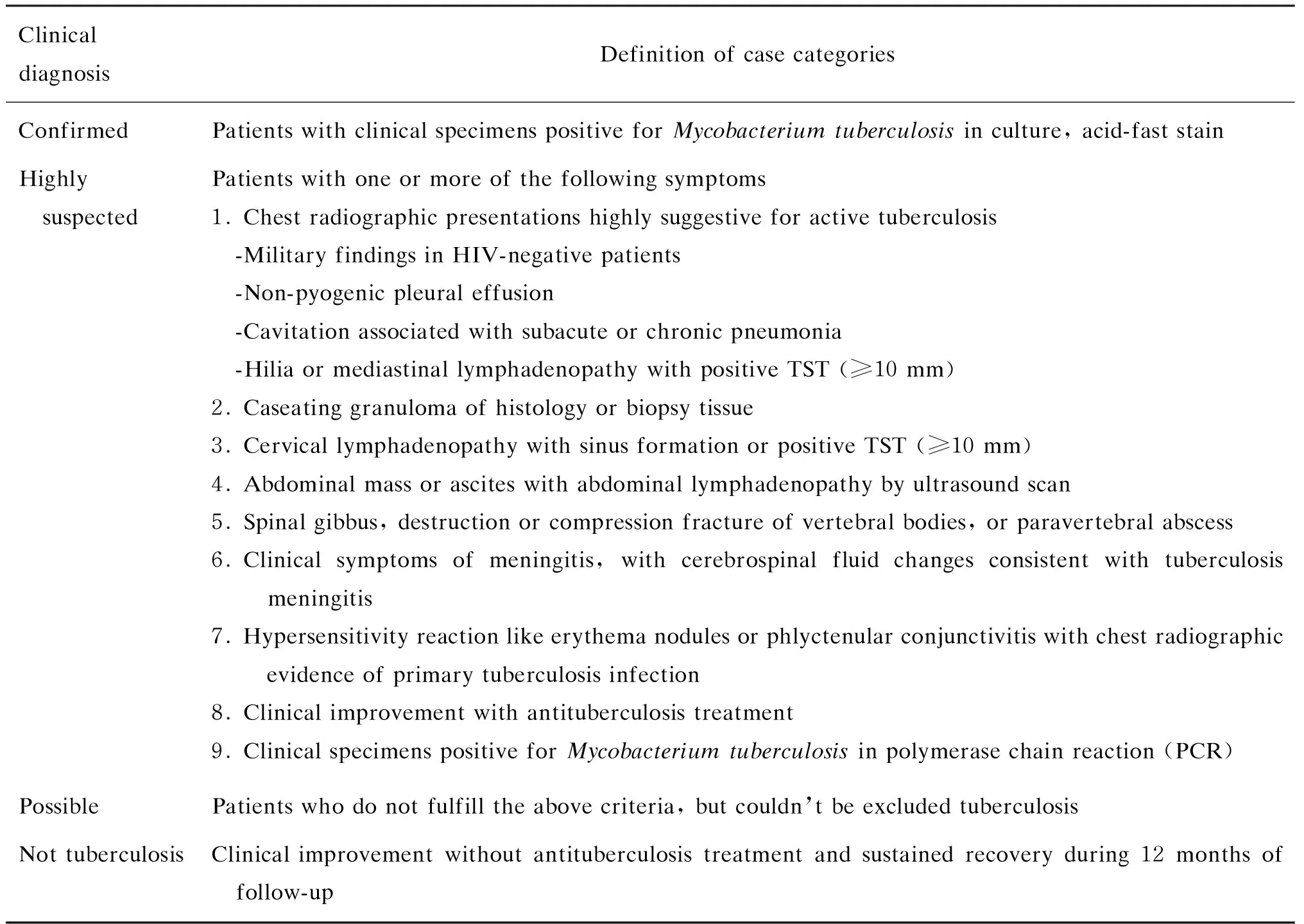
表1 结核病诊断与分类Tab.1 Diagnostic standards and classification of tuberculosis
1.3 统计方法
灵敏度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)、阳性似然比、阴性似然比用于描述QFT-GIT的诊断价值;通过二项分布计算95%可信区间(confidence interval,CI),卡方检验用于比较QFT-GIT在儿童和成人中的结核病诊断价值,P<0.05为有统计学差异。所有统计均采用SPSS 19.0。
2 结果
2.1 基本临床信息
本研究共入组儿童和成人患者各60例。根据上述诊断分类标准,分为确诊结核病、高度怀疑结核病、可疑结核病和排除结核病4组。其中确诊结核病组共23例儿童和9例成人患者,高度怀疑结核病组共8例儿童和22例成人患者,可疑结核病组共3例儿童和3例成人患者,排除结核病组26例儿童和26例成人患者。由于可疑结核病组的最终诊断不明确,故未纳入最后的数据分析和讨论。对其他3组患者的年龄、性别、临床症状、病灶部位、影像学表现、BCG接种情况、治疗药物等相关信息进行整理和分析(表2、3)。
2.2 QFT-GIT结果
60例儿童患者的QFT-GIT结果显示,23例确诊结核病的患儿中,20例检测结果阳性、3例阴性;8例高度怀疑结核病的患儿中,6例阳性、2例阴性;26例排除结核病的患儿中,2例阳性、23例阴性、1例结果不确定。60例成人患者的QFT-GIT结果显示,9例确诊结核病的患者中,6例阳性、1例阴性、2例结果不确定;22例高度怀疑结核病的患者中,16例阳性、5例阴性、1例结果不确定;26例排除结核病的患者中,4例阳性、22例阴性(表4)。其中确诊结核病和高度怀疑结核病的儿童及成人患者的QFT-GIT结果统计见图1。
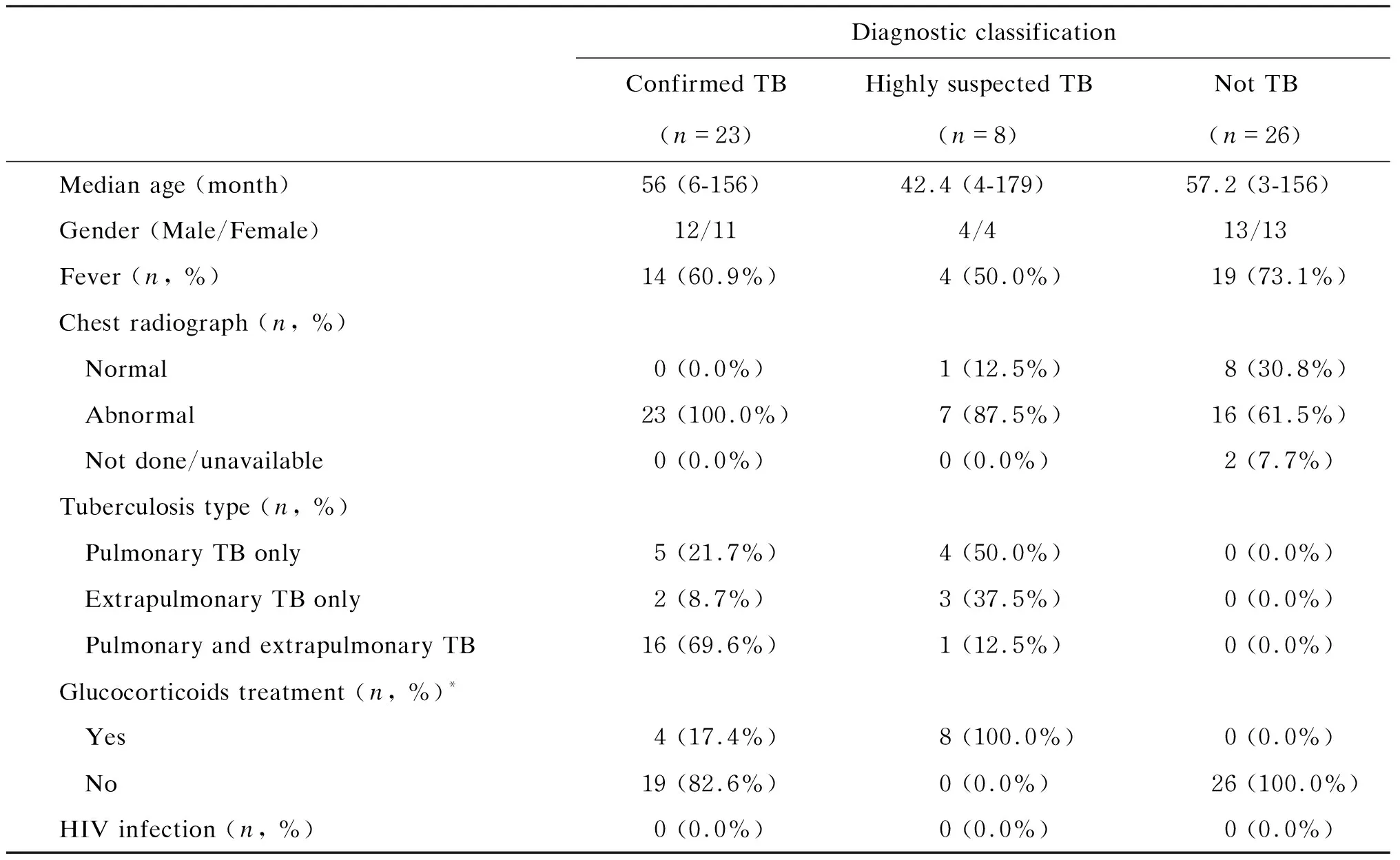
表2 儿童患者的基本信息Tab.2 Demographic and clinical details of children
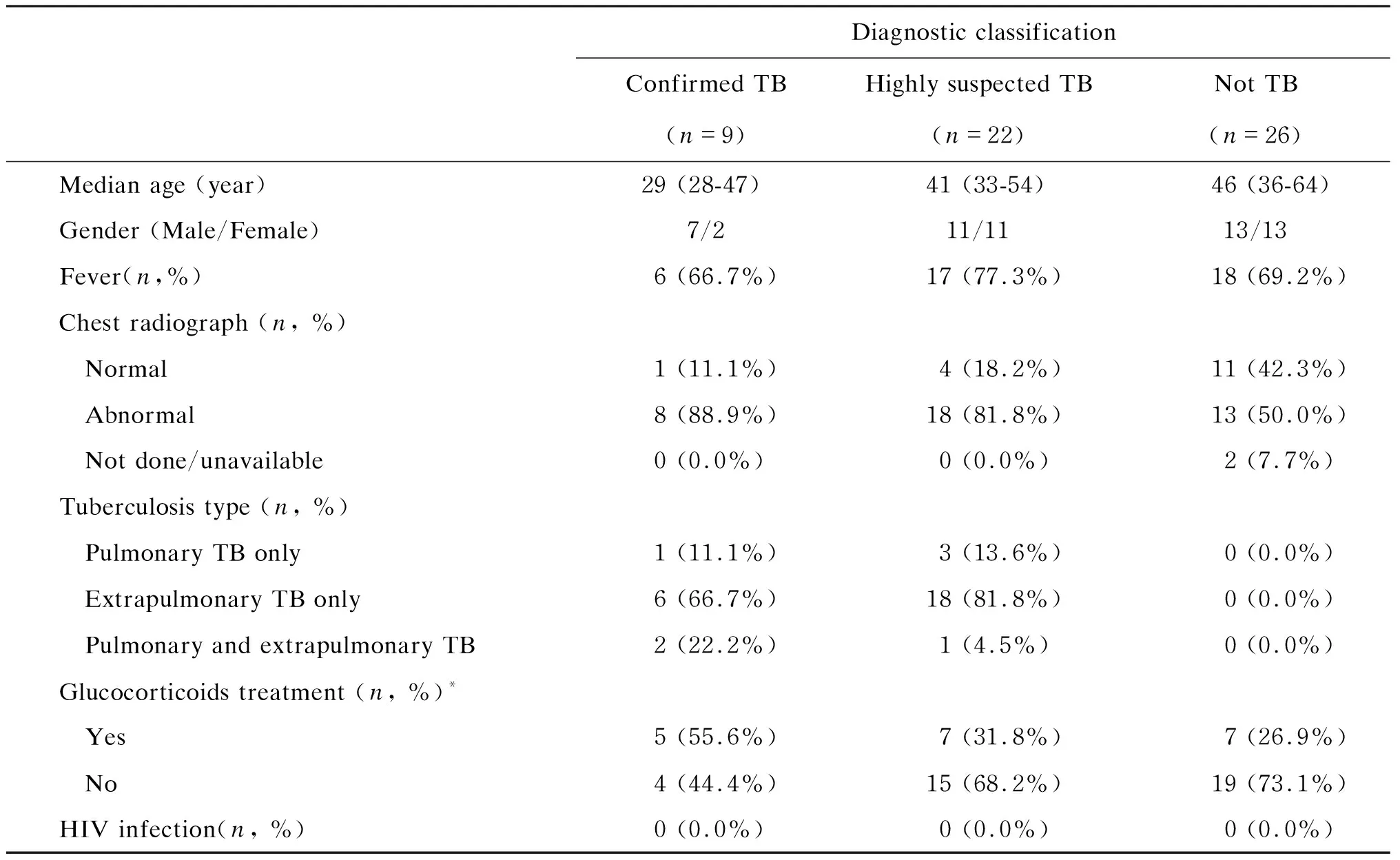
表3 成人患者的基本信息Tab.3 Demographic and clinical details of adults
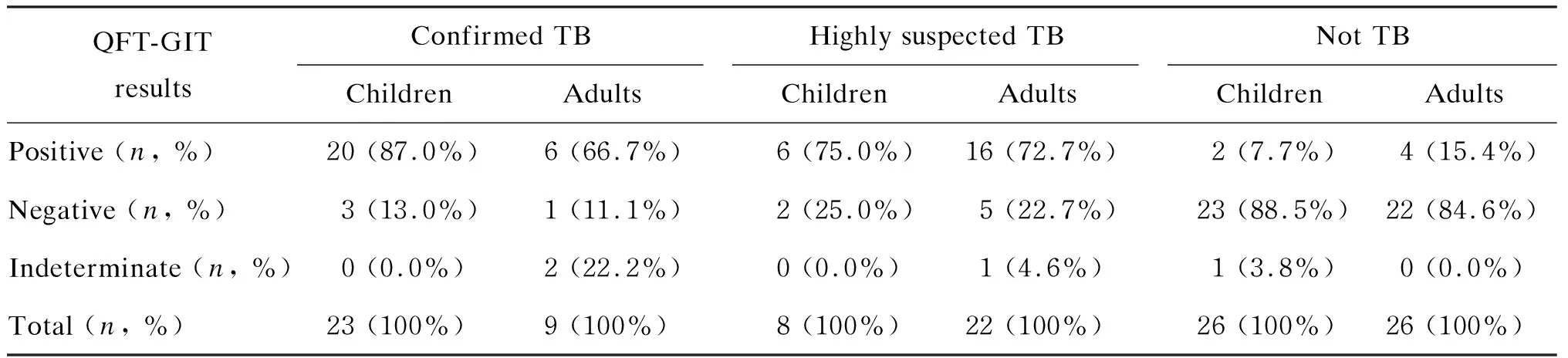
表4 各组患者QFT-GIT结果Tab.4 Results of QFT-GIT in each diagnostic classification
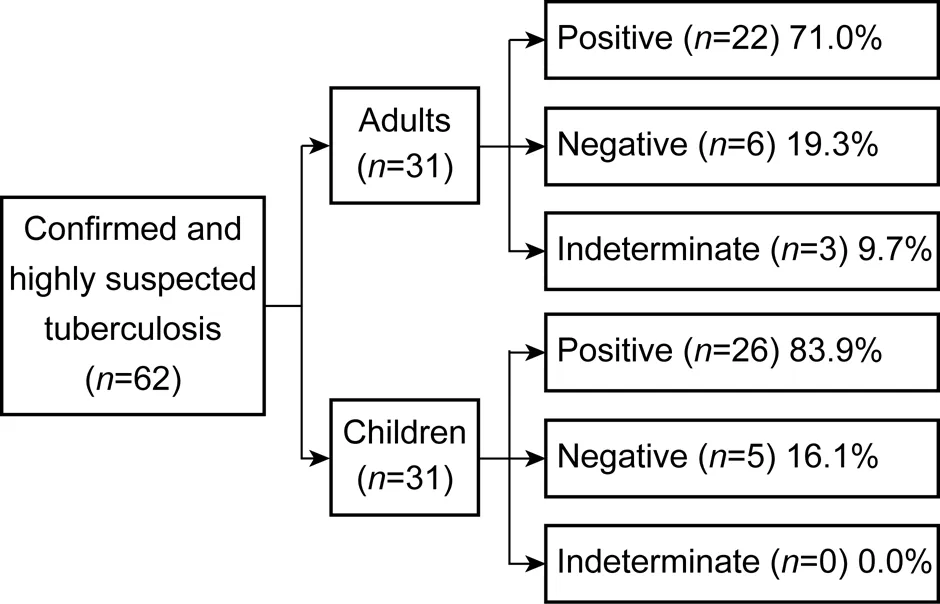
图1 确诊结核病和高度怀疑结核病组QFT-GIT结果Fig.1 QFT-GIT results of patients with confirmed and highly suspected tuberculosis
2.3 QFT-GIT的诊断价值指标
本研究以确诊结核病和高度怀疑结核病组患者作为结核病患者,排除结核病组患者作为非结核病患者,对QFT-GIT在儿童和成人中的结核病诊断价值进行分析。由于可疑结核病组患者的最终诊断不明确,无法判断QFT-GIT结果,最终没有纳入分析中。在儿童中,QFT-GIT用于诊断结核病的灵敏度为83.87%(95% CI 为66.33%~94.55%),特异度为92.00%(95% CI为73.97%~99.02%),PPV为92.86%(95% CI为76.50%~99.12%),NPV为82.14%(95% CI为63.11%~99.12%),阳性似然比为10.48,阴性似然比为0.18。在成人中,QFT-GIT用于诊断结核病的灵敏度为78.57%(95% CI为59.05%~91.70%),特异度为84.62%(95% CI 为65.13%~95.64%),PPV为84.62%(95% CI为65.13%~95.64%),NPV为78.57%(95% CI为59.05%~91.70%),阳性似然比为5.11,阴性似然比为0.25(表5)。
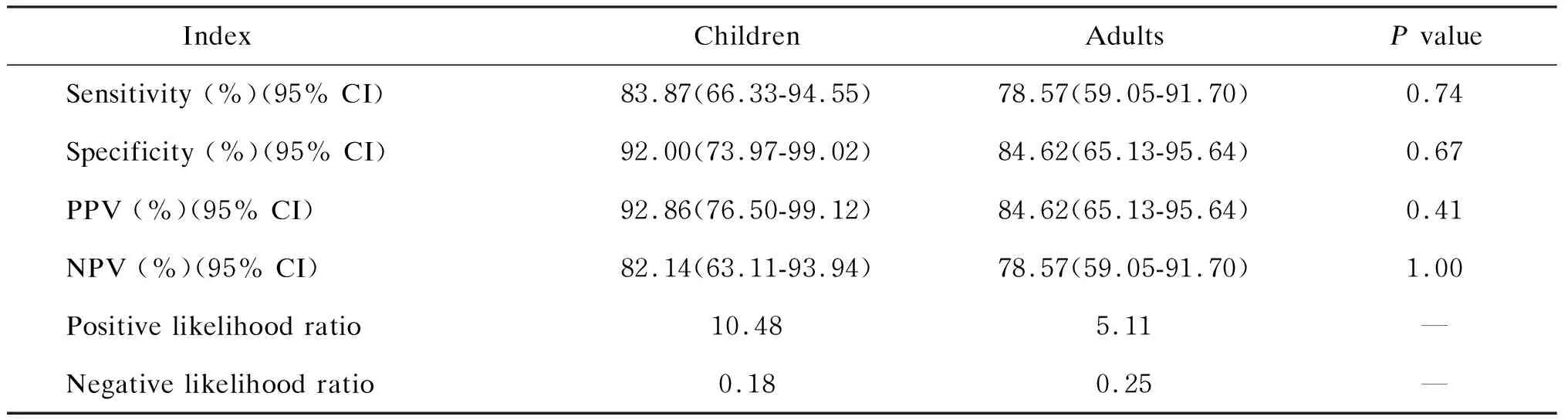
表5 QFT-GIT在儿童和成人中的结核病诊断价值Tab.5 Value of QFT-GIT in diagnosis of tuberculosis in children and adults
3 讨论
目前用于诊断结核病的方法各有不足之处:结核分枝杆菌感染的病灶多种多样,临床表现也各不相同,通过临床症状和影像学表现诊断结核病不够准确;TST 由于与BCG及环境中其他非结核分枝杆菌的交叉反应,易出现假阳性结果[8, 9]。一项印度研究显示,TST的灵敏度和特异度分别为68.9% (95% CI为60.6%~77.2%)和75.5% (95% CI为66.8%~84.2%)[10]。细菌培养至少需2周才能得到培养结果。据估计,近20%的结核病患者痰涂片和痰培养结果是阴性的[11],即使最终痰培养能获得阳性结果,约50%的患者痰涂片快速检测结果也是阴性的[12]。因此,结核病诊断需有更高准确率、更方便、更快捷的诊断技术。
T细胞介导的IGRA是基于机体对结核分枝杆菌特异性抗原的免疫反应进行的检测,其优越性明显高于TST[13-15]。一项关于IGRA在活动性结核中应用的meta分析显示,全血QFT-GIT检测的灵敏度为80%(95% CI为75%~84%),特异度为79% (95% CI为75%~82%)[16]。另一项德国研究表明,QFT-GIT用于诊断儿童结核病的灵敏度和特异度分别为93%(95% CI为77%~99%)和100% (95% CI为91%~100%)[6]。我国云南省进行的一项对2种IGRA商用试剂盒在结核病诊断中应用的研究结果显示,QFT-GIT用于诊断肺结核的灵敏度为88.4%,肺外结核为78.3%,特异度为76.9%[17]。另外,对于QFT-GIT在潜伏性结核诊断中的应用,研究显示其用于筛查潜伏性结核的价值要优于传统的PPD皮试[18]。本研究主要评价QFT-GIT在中国(结核病高发、BCG高接种)结核病诊断中的价值,不仅统计成人数据,还对QFT-GIT在儿童中的应用进行分析和评价,比较其在成人与儿童中结核病诊断价值的差异。
从研究数据可看出,无论在儿童还是在成人中,QFT-GIT的灵敏度和特异度均达75%以上。尤其在儿童中的灵敏度和特异度超过80%,较成人高出5个百分点以上。QFT-ITG在儿童结核病诊断中的PPV和NPV分别为92.86%(95% CI为76.50%~99.12%)和82.14%(95% CI为63.11%~99.12%),较成人中的84.62%(95% CI为65.13%~95.64%)和78.57%(95% CI为59.05%~91.70%)高。虽然这一差异没有统计学差异(P>0.05),但仍有一定的提示意义,并与预期相符合[19]。分析原因后认为,儿童与成人相比,潜伏性结核的比例较少,由于潜伏性结核导致的阳性结果比例低于成人,所以其用于结核病的诊断特异度和PPV要明显高于成人,这需更大样本量来佐证。
综上所述,基于全血ELISA检测T细胞特异性释放的IFN-γ进行结核病诊断在中国具有很好的应用价值,其在儿童中较少受潜伏性结核的影响,因此儿童PPV高于成人。
[1] Young DB, Gideon HP, Wilkinson RJ. Eliminating latent tuberculosis [J]. Trends Microbiol, 2009, 17(5): 183-188.
[2] Barry CE 3rd, Boshoff HI, Dartois V, Dick T, Ehrt S, Flynn J, Schnappinger D, Wilkinson RJ, Young D. The spectrum of latent tuberculosis: rethinking the biology and intervention strategies[J]. Nat Rev Microbiol, 2009, 7(12): 845-855.
[3] Mazurek GH, Jereb J, Lobue P, Iademarco MF, Metchock B, Vernon A; Division of Tuberculosis Elimination, National Center for HIV, STD, and TB Prevention, Centers for Disease Control and Prevention (CDC). Guidelines for using the QuantiFERON-TB Gold test for detecting Mycobacterium tuberculosis infection, United States [J]. MMWR Recomm Rep, 2005, 54(RR-15): 49-55.
[4] Dogra S, Narang P, Mendiratta DK, Chaturvedi P, Reingold AL, Colford JM Jr, Riley LW, Pai M. Comparison of a whole blood interferon-gamma assay with tuberculin skin testing for the detection of tuberculosis infection in hospitalized children in rural India [J]. J Infect, 2007, 54(3): 267-276.
[5] Connell TG, Ritz N, Paxton GA, Buttery JP, Curtis N, Ranganathan SC. A three-way comparison of tuberculin skin testing, QuantiFERON-TB gold and T-SPOT.TB in children [J]. PLoS One, 2008,3(7): e2624.
[6] Detjen AK, Keil T, Roll S, Hauer B, Mauch H, Wahn U, Magdorf K. Interferon-gamma release assays improve the diagnosis of tuberculosis and nontuberculous mycobacterial disease in children in a country with a low incidence of tuberculosis [J]. Clin Infect Dis, 2007, 45(3): 322-328.
[7] Rachow A, Clowes P, Saathoff E, Mtafya B, Michael E, Ntinginya EN, Kowour D, Rojas-Ponce G, Kroidl A, Maboko L, Heinrich N, Reither K, Hoelscher M. Increased and expedited case detection by Xpert MTB/RIF assay in childhood tuberculosis: a prospective cohort study [J]. Clin Infect Dis, 2012, 54(10): 1388-1396.
[8] Snider DE Jr. Bacille Calmette-Guérin vaccinations and tuberculin skin tests [J]. JAMA, 1985, 253(23): 3438-3439.
[9] Judson FN, Feldman RA. Mycobacterial skin tests in humans 12 years after infection with Mycobacterium marinum [J]. Am Rev Respir Dis, 1974, 109(5): 544-547.
[10] Syed Ahamed Kabeer B, Raman B, Thomas A, Perumal V, Raja A. Role of QuantiFERON-TB gold, interferon gamma inducible protein-10 and tuberculin skin test in active tuberculosis diagnosis [J]. PLoS One, 2010, 5(2): e9051.
[11] Ashenafi S, Aderaye G, Zewdie M, Raqib R, Bekele A, Magalhaes I, Lema B, Habtamu M, Rekha RS, Aseffa G, Maeurer M, Aseffa A, Svensson M, Andersson J, Brighenti S. BCG-specific IgG-secreting peripheral plasmablasts as a potential biomarker of active tuberculosis in HIV negative and HIV positive patients [J]. Thorax, 2013, 68(3): 269-276.
[12] Siddiqi K, Lambert ML, Walley J. Clinical diagnosis of smear-negative pulmonary tuberculosis in low-income countries: the current evidence [J]. Lancet Infect Dis, 2003, 3(5): 288-296.
[13] Feng Y, Diao N, Shao L, Wu J, Zhang S, Jin J, Wang F, Weng X, Zhang Y, Zhang W. Interferon-gamma release assay performance in pulmonary and extrapulmonary tuberculosis [J]. PLoS One, 2012, 7(3): e32652.
[14] Zhang S, Shao L, Mo L, Chen J, Wang F, Meng C, Zhong M, Qiu L, Wu M, Weng X, Zhang W. Evaluation of gamma interferon release assays using Mycobacterium tuberculosis antigens for diagnosis of latent and active tuberculosis in Mycobacterium bovis BCG-vaccinated populations [J]. Clin Vaccine Immunol, 2010, 17(12): 1985-1990.
[15] Jiang W, Shao L, Zhang Y, Zhang S, Meng C, Xu Y, Huang L, Wang Y, Wang Y, Weng X, Zhang W. High-sensitive and rapid detection of Mycobacterium tuberculosis infection by IFN-gamma release assay among HIV-infected individuals in BCG-vaccinated area [J]. BMC Immunol, 2009, 10: 31.
[16] Sester M, Sotgiu G, Lange C, Giehl C, Girardi E, Migliori GB, Bossink A, Dheda K, Diel R, Dominguez J, Lipman M, Nemeth J, Ravn P, Winkler S, Huitric E, Sandgren A, Manissero D. Interferon-gamma release assays for the diagnosis of active tuberculosis: a systematic review and meta-analysis [J]. Eur Respir J, 2011, 37(1): 100-111.
[17] 李晓菲, 赵勤, 汪亚玲, 余文林. 两种结核分枝杆菌相关γ-干扰素定量检测试剂盒检测结核分枝杆菌感染结果比较研究[J]. 中国防痨杂志, 2011, 33(5): 267-270.
[18] 翁绳凤, 刘佳文, 康丽军, 刘威, 刘宏蕴, 李宝玲, 朱新颖, 何燕. 干扰素体外释放酶联免疫法在结核潜伏感染诊断中的价值[J]. 临床肺科杂志, 2012, 17(6): 1062-1064.
[19] Mazurek GH, Jereb J, Vernon A, LoBue P, Goldberg S, Castro K; IGRA Expert Committee, Centers for Disease Control and Prevention (CDC). Updated guidelines for using interferon gamma release assays to detect Mycobacterium tuberculosis infection—United States, 2010 [J]. MMWR Recomm Rep, 2010, 59(RR-5): 1-25.

