芳环上硝基取代基对苯甲酸功能化聚苯乙烯-Eu(III)配合物光致发光性能的双重影响
许泽清 高保娇 侯晓东
(中北大学化学工程系,太原030051)
1 引言
键合型聚合物-稀土配合物发光材料是一种高性能稀土发光材料,此类材料既保持了稀土配合物优异的场致发光性能,又具有高分子化合物良好的力学性能与易于加工成型的特点,还可使发光材料内部呈均相特性,1-3此类材料在场致发光材料与器件领域具有潜在的发展前景,是一类需要大力发展的材料.在前期的研究中,我们将对稀土离子兼具有配位与敏化双重功能的芳羧酸基团(苯甲酸和萘甲酸)化学键联于聚苯乙烯(PS)侧链,制备了能强烈敏化稀土离子发光的大分子配体,从而获得了高性能的高分子-稀土配合物.4,5
芳羧酸基团的结构本身(芳环结构本身)会强烈地影响其三线态与发光稀土离子共振能级的匹配程度,从而显著地影响芳羧酸-稀土配合物的发光性能;6,7另一方面,芳羧酸芳环上的取代基也会对能级的匹配程度产生影响,从而影响芳羧酸-稀土配合物的发光性能.7,8鉴于此考虑,我们将硝基苯甲酸键合于聚苯乙烯大分子侧链,制备了硝基苯甲酸功能化的聚苯乙烯,9本文以该功能化的聚苯乙烯为大分子配体,分别制备了二元和三元光致发光高分子-稀土配合物,深入研究了硝基取代基对高分子-稀土配合物发光性能的影响.研究发现,若以Eu(III)离子为中心离子,芳环上的硝基取代基对苯甲酸功能化高分子-稀土配合物的荧光发射有着正性影响,可有效降低苯甲酸配基的三线态,增强苯甲酸配基与Eu(Ⅲ)离子共振能级的匹配程度,显著提高高分子-稀土配合物光致发光性能.但是,芳环上的硝基对于有机化合物的荧光发射一般具有强淬灭作用,10,11在本文所研究的高分子-稀土配合物发光体系中,此淬灭作用也同样会发生,即使配合物浓度很低,但随着溶液中配合物的浓度增大,高分子-Eu(Ⅲ)配合物的发光强度会不断降低,显现出芳环上硝基取代基的负性影响.关于芳环上硝基取代基对稀土配合物光致发光性能的上述两种相反的影响作用,小分子稀土配合物的研究未见文献报道,芳羧酸功能化的大分子-稀土配合物的研究也未见文献报道.本文的研究结果在光致发光高分子-稀土配合物研究领域及在理论与实际应用两方面都具有明显的参考价值.
2 实验部分
2.1 试剂与仪器
聚苯乙烯(PS,北京燕山石化分公司,Mr=8×104);1,4-二氯甲氧基丁烷(BCMB,自制);3-硝基-4-羟基苯甲酸(NHBA,湖北楚盛威化工有限公司),分析纯;3-甲酰基-4羟基苯甲酸(FHBA),分析纯;对羟基苯甲酸(HBA,上海柏懿化工有限公司),分析纯;邻菲罗啉(Phen,天津市大茂化学试剂厂),分析纯;N,N-二甲基甲酰胺(DMF,天津市博迪化工股份有限公司),分析纯;三氧化二铕(Eu2O3,国药集团化学试剂有限公司),分析纯;其余试剂均为市售分析纯试剂.
1700型傅里叶变换红外(FTIR)光谱仪(美国Perkin-Elmer公司);UV-2602型紫外-可见(UV-Vis)分光光度计(上海尤尼柯公司);DRX300型核磁共振仪(瑞士Bruker公司);HITACHIF-2500荧光光度计(日本日立公司).
2.2 高分子-稀土配合物的制备与表征
2.2.1 硝基苯甲酸功能化聚苯乙烯PS-NBA的制备与表征
按照文献9所述步骤(稍有改动),将硝基苯甲酸键合于聚苯乙烯侧链.(1)以BCMB为氯甲基化试剂,制得氯含量约为13%(质量分数)的氯甲基化聚苯乙烯(CMPS).(2)在DMF溶液中,以三乙胺为缚酸剂,于70°C恒温下使CMPS与3-硝基-4-羟基苯甲酸之间的亲核取代反应进行8 h,制得侧链键合有硝基苯甲酸(NBA)配基的功能化聚苯乙烯PSNBA.在相同反应条件下,也制得侧链键合有苯甲酸(BA)配基的功能化聚苯乙烯PS-BA.(3)采用紫外分光光度法测定功能化聚苯乙烯PS-NBA大分子链中NBA的键合量,测得键合度为2.63 mmol·g-1.(4)测定PS-NBA的FTIR光谱与核磁共振氢谱(1HNMR),表征其化学结构.9
2.2.2 高分子-稀土配合物的制备与表征
2.2.2.1 二元配合物PS-(NBA)3-Eu(III)的制备
用盐酸溶液(V/V=1:1)溶解三氧化二铕,对溶液进行加热浓缩,形成三氯化铕结晶(EuCl3·6H2O).准确称取0.50 g功能大分子PS-NBA(NBA的总键合量为1.32 mmol),将其溶解于50 mL DMF中,并用NaOH溶液调节至pH=6-7,再加入0.16 g(0.44 mmol)三氯化铕晶体,使之溶解(溶液中大分子链PS-NBA上的配基NBA与Eu(III)离子的摩尔比为3:1),将溶液置于50°C的水浴上,在搅拌条件下使配合反应进行8 h.配位反应结束后,用乙醇为沉淀剂,沉淀出聚合物,经洗涤与干燥,即得二元高分子-稀土配合物PS-(NBA)3-Eu(III).按同样方法也制得二元高分子-稀土配合物PS-(BA)3-Eu(III).
2.2.2.2 三元配合物PS-(NBA)3-Eu(III)-(Phen)1的制备
准确称取0.50 g改性聚苯乙烯PS-NBA(NBA的总键合量为1.32 mmol),将其溶解于25 mL DMF中,并用NaOH溶液调节至pH=6-7,加入0.16 g(0.44 mmol)三氯化铕晶体及0.086 g(0.44 mmol)的邻菲罗啉,将溶液置于50°C的水浴上,在搅拌条件下使配合反应进行8 h.反应结束后,以乙醇为沉淀剂,沉淀出聚合物,用乙醇和蒸馏水洗涤,真空干燥,即得三元配合物PS-(NBA)3-Eu(III)-(Phen)1.
按同样方法也制得三元高分子-稀土配合物PS-(BA)3-Eu(III)-(Phen)1.
2.2.2.3 配合物的表征
KBr压片法测定二元配合物PS-(NBA)3-Eu(III)与三元配合物PS-(NBA)3-Eu(III)-(Phen)1的红外光谱,表征它们的化学结构;使用UV-Vis分光光度计测定各种物质在DMF中的紫外吸收光谱,进一步证实它们的化学结构.
2.3 高分子-稀土配合物荧光发射光谱的测定
以DMF为溶剂,分别配制一定浓度的二元配合物PS-(NBA)3-Eu(III)和三元配合物PS-(NBA)3-Eu(III)-(Phen)1溶液,使用荧光光谱仪,以最佳激发峰(先以Eu3+离子于620 nm的特征发射扫描各种配合物的激发光谱,确定最佳激发峰)测定各溶液中诸物质的荧光发射光谱.
分别将二元配合物PS-(NBA)3-Eu(III)和三元配合物PS-(NBA)3-Eu(III)-(Phen)1溶于氯仿中,在培养皿中流延成膜,置于温度为40°C的烘箱中,除去溶剂,干燥成膜(膜的厚度约为60 μm),测定固体薄膜的荧光发射光谱.
3 结果与讨论
3.1 大分子-稀土配合物的化学结构
本研究通过两步大分子反应(氯甲基化反应与亲核取代反应),将硝基苯甲酸(NBA)配基键合在聚苯乙烯侧链,形成功能化聚苯乙烯PS-NBA;然后使PS-NBA与Eu(III)离子(3:1的摩尔比)在溶剂DMF中进行配位反应,制得二元高分子-稀土配合物PS-(NBA)3-Eu(III)溶液;也在溶液中加入Phen小分子第二配体(与Eu3+离子的摩尔比为1:1),制得三元高分子-稀土配合物PS-(NBA)3-Eu(III)-(Phen)1溶液;最后使用沉淀剂将配合物从溶液中析出.制备上述配合物的溶液均为高分子稀溶液,溶液中的高分子线团是彼此分离的,大分子链上的配基与稀土离子之间的配位属分子内的配合作用,5即同一条大分子链上的配基与稀土离子之间发生的配合作用(否则就会发生以稀土离子为交联桥的大分子之间的交联现象).因此,所制得的二元配合物PS-(NBA)3-Eu(III)与三元配合物PS-(NBA)3-Eu(III)-(Phen)1应该具有示意图1所示的化学结构.
3.2 配合物的结构表征
3.2.1 红外光谱
图1给出了PS-NBA、二元配合物PS-(NBA)3-Eu(III)及三元配合物PS-(NBA)3-Eu(III)-Phen1的红外光谱.
在改性聚苯乙烯PS-NBA的谱图中,除显示聚苯乙烯的全部特征吸收外,还出现了4个新峰:1714 cm-1处的吸收峰为键合配基NBA的羧羰基C=O的伸缩振动吸收峰,3427 cm-1处的吸收峰为键合配基NBA的羧羟基的伸缩振动吸收,在1614 cm-1处出现了硝基N=O键的伸缩振动吸收峰.而在二元配合物PS-(NBA)3-Eu(III)的谱图中,NBA的羧羰基C=O于1714 cm-1处的伸缩振动吸收峰消失,而在1545和1423 cm-1处出现了羧基的反对称伸缩振动吸收峰和对称伸缩振动吸收峰,表明在键合配基NBA中,其羧基中的两个氧原子均与Eu(III)离子发生了配位作用,即键合配基NBA的羧基以双齿配基的形式与Eu(III)离子发生了鳌合配位,形成了二元高分子-稀土配合物;另外,于414 cm-1处还出现了Eu―O键的伸缩振动吸收峰.在三元配合物PS-(NBA)3-Eu(III)-(Phen)1的谱图中,同样,配基NBA的羧羰基C=O的伸缩振动吸收峰已消失,在1541和1426 cm-1处出现了羧基的反对称伸缩振动吸收峰和对称伸缩振动吸收峰,在414 cm-1处也出现了Eu―O键的伸缩振动吸收峰;另外,还在1579 cm-1出现了红移后的Phen分子中C=N键的特征吸收峰.上述谱峰数据的变化充分证实,PS-NBA大分子链上配基NBA的羧基与Eu(III)离子发生了配位鳌合,形成二元配合物PS-(NBA)3-Eu(III)1,在小分子配体Phen的协同下,则形成三元配合物PS-(NBA)3-Eu(III)-(Phen)1.
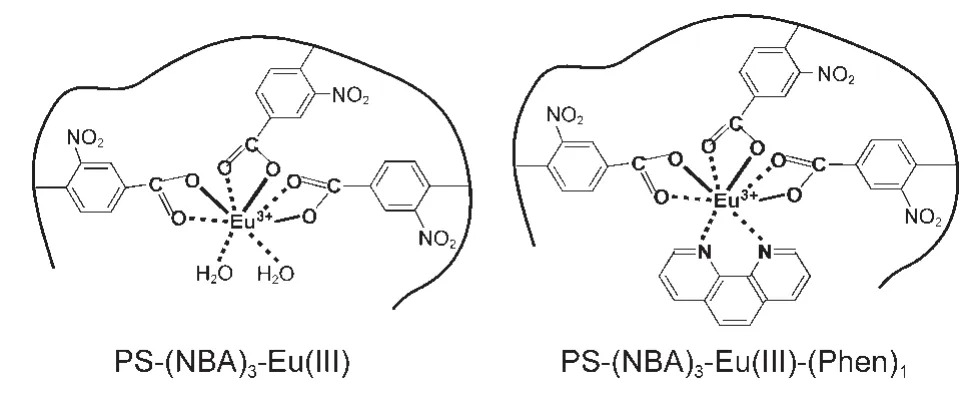
示意图1 二元及三元配合物的化学结构Scheme 1 Chemical structures of binary and ternary complexes

图1 PS-NBA及二元和三元配合物的FTIR光谱Fig.1 Fourier transform infrared(FTIR)spectra of PSNBA,binary and ternary complexes
3.2.2 配合物的紫外吸收光谱
图2给出了改性聚苯乙烯PS-NBA、Phen、二元配合物PS-(NBA)3-Eu(III)及三元配合物PS-(NBA)3-Eu(III)-(Phen)1的紫外吸收光谱.从图2可以看到,改性聚苯乙烯PS-NBA在265-340 nm范围具有强的紫外吸收,在290 nm附近具有最强的吸收峰,归属于PS-NBA分子结构中苯环和羰基的π-π*电子跃迁;自由配体Phen在290和325 nm处有两个特征吸收峰,分别归属于Phen的π→π*跃迁和n→π*跃迁.

图2 PS-NBA、Phen与配合物的紫外吸收光谱Fig.2 UV absorption spectra of PS-NBA,Phen,and complexes solvent:N,N-dimethylformamide(DMF)
从图2还可以看到,当聚合物PS-NBA与Eu(III)离子配位形成二元配合物PS-(NBA)3-Eu(III)后,仍具有强的紫外吸收,且吸收峰的形状与PS-NBA十分相似,只是特征吸收峰稍有红移(287 nm→291 nm),进一步表明大分子配体PS-NBA与Eu(III)离子之间形成了稳定的配合物结构.Eu(III)离子在紫外区吸收很弱,故上述谱图数据还说明二元配合物PS-(NBA)3-Eu(III)的紫外吸收来自于大分子配体PS-NBA,与中心离子基本无关,配合物的发光来自于键合配基NBA对Eu(III)离子的能量传递(见下文).
从图2也可以看到,在三元配合物PS-(NBA)3-Eu(III)-(Phen)1的紫外吸收光谱中,于295和327 nm处出现2个吸收峰,前者是Phen的部分谱带与PSNBA的吸收峰重叠所致,后者则归属Phen的第二个特征吸收带.显然,与大分子配体PS-NBA及自由配体Phen的吸收光谱相比,三元配合物的紫外吸收峰发生了明显的红移,这是由于配基NBA及Phen通过O、N原子与Eu(III)离子配位后,形成多个螯合环,使中心离子周围的π电子云密度变大,共轭体系增大,电子离域化程度增加,跃迁能量降低,从而产生红移现象.上述谱图数据对比的结果充分表明,Eu(III)离子与两种配体之间已配位成键,说明三元配合物的紫外吸收来自于大分子配体PS-NBA与小分子配体Phen的协同吸收,配合物的发光是两种配体对Eu(III)离子能量传递所致(见下文).
3.3 苯环上硝基取代基对配合物荧光发射的正性影响
3.3.1 二元配合物的荧光发射光谱
将二元配合物PS-(NBA)3-Eu(III)溶解于DMF,形成浓度为4.0×10-6mol·L-1的溶液,以620 nm为发射波长,先测定二元配合物PS-(NBA)3-Eu(III)在DMF溶液中的激发光谱,确定最佳激发波长(278 nm),在此基础上测定该二元配合物在DMF溶液中的荧光发射光谱,示于图3.为进行比较,也在相同浓度的条件下(4.0×10-6mol·L-1),分别配制了二元配合物PS-(BA)3-Eu(III)及EuCl3的溶液,测定了它们的荧光发射光谱,也示于图3.
图3显示,(1)两种二元配合物与EuCl3的发射谱带的位置与形状相同,表明配合物发射出Eu(III)离子的特征荧光,谱图中主要显示出Eu(III)离子580 nm处的5D0→7F0跃迁、593 nm处的5D0→7F1跃迁与620 nm处的5D0→7F2跃迁所导致的发射,其中5D0→7F2跃迁所产生的发射最强.(2)两种二元配合物的发射峰既窄(色纯度高)又强,且荧光强度远比EuCl3强(分别提高了16倍与7倍),说明两种苯甲酸功能化的大分子配体对Eu(III)离子的荧光发射都发生了显著的敏化作用,即产生了Antenna效应,即大分子侧链上的配基NBA及BA吸收能量后,由三重态以非辐射方式将能量传递给Eu(III)离子,然后受激的Eu(III)离子再以辐射方式跃迁到基态能级,从而发射出Eu(III)离子的特征荧光,正是配基NBA及BA的敏化作用使得二元配合物的荧光发射远强于EuCl3的荧光发射.(3)两种二元配合物的荧光发射强度是不同的,PS-(NBA)3-Eu(III)的荧光强度远比PS-(BA)3-Eu(III)要强,表明键合在大分子侧链的两种配基NBA与BA相比较,NBA对Eu3+离子荧光发射具有更强的敏化作用,即具有更强的能量传递作用,充分显示出苯环上硝基取代基对二元高分子-稀土配合物PS-(NBA)3-Eu(III)荧光发射的正性影响.
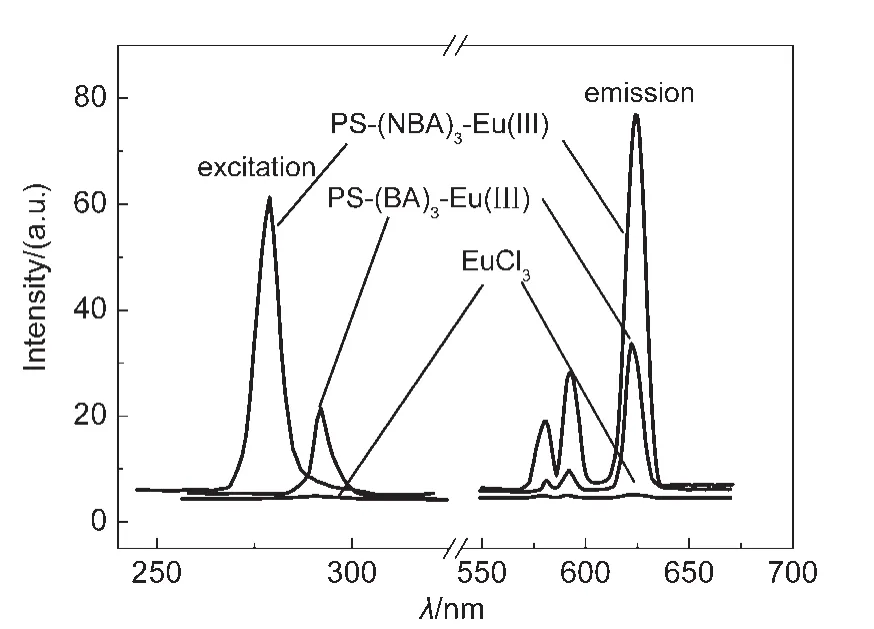
图3 PS-(NBA)3-Eu(III)、PS-(BA)3-Eu(III)和EuCl3的激发与荧光发射光谱Fig.3 Excitation and fluorescence emission spectra of PS-(NBA)3-Eu(III),PS-(BA)3-Eu(III),and EuCl3 solvent:DMF;cEu(III)=4.0×10-6mol·L-1
根据Antenna效应理论,12,13稀土有机配合物发光强度主要决定于两个因素:(1)配基对紫外光的吸收能力的大小.配基光吸收能力越强,向稀土离子传能的能力也越强.(2)配基向中心离子传递能量的效率,而该效率又主要取决于配基三线态(T1)与中心离子共振能级(最低激发态能级)的匹配程度,匹配程度越好,能量传递效率越高.上述两种因素相比较,后者是影响配合物发光强度最重要的因素.14,15
对于Eu(III)离子的敏化,配基三线态与其共振能级的能隙在3000 cm-1附近时,能量传递效率最高.7苯甲酸(BA)配基三线态的能量值约为24000 cm-1,14而Eu(III)离子共振能级(5D0)的能量值为17277 cm-1,16两者之间的能隙约为7000 cm-1(>>3000 cm-1),显然,能隙太大,能级是较为不匹配的,导致配合物PS-(BA)3-Eu(III)较低的荧光发射强度.配基NBA的苯环上含有硝基取代基,此硝基取代基通过n-π*跃迁(硝基氧原子孤对n电子轨道与芳环π*轨道之间的跃迁),发生配基内的电荷转移(ILCT),17-19使配基激发单线态的能量被耗损,从而导致NBA配基三线态能量的降低(对硝基苯甲酸的最低三线态能量约为20000-21000 cm-1).17,18结果,大幅度降低了配基NBA三线态与Eu(III)离子共振能级之间的能隙,使之接近于3000 cm-1,良好的能级匹配程度导致配合物PS-(NBA)3-Eu(III)发射出高强度的荧光.
以硫酸喹啉的1mol·L-1硫酸溶液为标准(该标准物质的量子效率ϕs=0.546,激发波长346 nm),在298 K分别测定了硫酸喹啉溶液、配合物PS-(NBA)3-Eu(III)和PS-(BA)3-Eu(III)溶液的折光率、吸光度和荧光发射强度,按(1)式计算了两种配合物的总量子效率ϕx1和ϕx2.

式中,ns、nx分别为标准溶液与配合物溶液的折光率;As、Ax分别为标准溶液与配合物溶液的吸光度;Is、Ix分别为标准溶液与配合物溶液的荧光发射强度.
测定结果为配合物PS-(NBA)3-Eu(III)的ϕx1=17.27%,配合物PS-(BA)3-Eu(III)的ϕx2=5.98%.显然,配合物PS-(NBA)3-Eu(III)的荧光量子效率远高于配合物PS-(BA)3-Eu(III)的荧光量子效率,进一步表明大分子侧链键合配基NBA(其芳环上含有硝基取代基),其三线态能量与Eu3+离子的共振发射能级之间具有良好的匹配性,导致了高的能量传递效率.
3.3.2 三元配合物的荧光发射光谱
以Phen小分子配体为第二配基,分别制备了三元配合物PS-(NBA)3-Eu(III)-Phen1和PS-(BA)3-Eu(III)-Phen1,并配制了它们的DMF溶液(4.0×10-6mol·L-1),测定了荧光发射光谱,测定结果如图4所示.
比较图4与图3,可以发现,两种三元配合物的荧光发射强度均明显高于对应的二元配合物,充分折射出第二配体Phen的作用.在三元配合物中,加入小分子第二配体后,一方面可增加中心离子周围的配基数目,使所形成的螯合环共轭体系增大,第一配体和第二配体通过“协同效应”使配合物的光能吸收和传递能力都得到增强;18另一方面,第二配体的加入,可以有效地替代Eu(III)离子周围的配位水分子,有效地避免了羟基―OH振动带来的荧光淬灭.13两种因素的共同作用,使得以小分子配体Phen为第二配基的三元配合物的光致发光性能明显高于二元配合物.更重要的是,图4中清楚地显示,三元配合物PS-(NBA)3-Eu(III)-Phen1的荧光发射强度明显高于三元配合物PS-(BA)3-Eu(III)-Phen1,其原因仍在于硝基取代基大幅度降低了第一配基NBA的三线态能量,导致该三线态与Eu(III)离子共振能级具有了良好的匹配程度,致使三元配合物PS-(NBA)3-Eu(III)-Phen1产生了高强度的荧光发射,这同样显示出了苯环上硝基取代基对三元高分子-稀土配合物PS-(NBA)3-Eu(III)-Phen1荧光发射的正性影响.

图4 三元配合物PS-(NBA)3-Eu(III)-Phen1和PS-(BA)3-Eu(III)-Phen1的激发与荧光发射光谱Fig.4 Excitation and fluorescence emission spectra of ternary complexes of PS-(NBA)3-Eu(III)-Phen1and PS-(BA)3-Eu(III)-Phen1
3.3.3 配合物固体薄膜的荧光发射光谱
易于成膜是聚合物-稀土离子发光配合物的一大优势性能,这为它们的实际应用提供了极大的方便.本研究采用延流成膜法制备了配合物的固体薄膜,图5(a)给出两种二元配合物PS-(NBA)3-Eu(III)和PS-(BA)3-Eu(III)固体薄膜的荧光发射光谱,图5(b)给出两种三元配合物PS-(NBA)3-Eu(III)-Phen1和PS-(BA)3-Eu(III)-Phen1固体薄膜的荧光发射光谱.图5(a)显示,配合物PS-(NBA)3-Eu(III)固体薄膜的荧光发射强度明显高于配合物PS-(BA)3-Eu(III),图5(b)则显示,配合物PS-(NBA)3-Eu(III)-Phen1固体薄膜的荧光发射强度明显高于配合物PS-(BA)3-Eu(III)-Phen1,再次显现出苯环上硝基取代基对苯甲酸功能化高分子-稀土配合物荧光发射的正性影响.
一般认为“硝基是荧光淬灭基团”,硝基化合物是“非荧光”化合物,但是新近的研究结果表明,对于某些稀土配合物,硝基也是一种“荧光敏化基团”,17,18本文上述研究结果进一步证实了这一新概念.

图5 二元(a)和三元(b)配合物固体薄膜的荧光发射光谱Fig.5 Fluorescence emission spectra of solid films of binary(a)and ternary(b)complexes
3.4 苯环上硝基取代基对配合物荧光发射的负性影响
3.4.1 二元配合物的荧光发射强度与浓度的关系
以DMF为溶剂,在4.0×10-4-4.0×10-6mol·L-1的浓度范围内,配制了浓度系列变化的二元配合物PS-(NBA)3-Eu(Ⅲ)和 PS-(BA)3-Eu(Ⅲ)的溶液,测定了它们的荧光发射光谱,分别示于图6(a)与图6(b).
由图6(b)看出,在稀溶液范围内,当二元配合物PS-(BA)3-Eu(Ⅲ)的浓度从 4.0×10-6mol·L-1增大至4.0×10-4mol·L-1时,其荧光发射强度也随之变强,符合一般稀土配合物荧光发射光谱的变化规律(当然,浓度太大时可能会发生浓度淬灭现象,比如配合物浓度增至0.02 mol·L-1或稀土离子质量增至11.4%20,21).但是,在图6(a)中却出现了异常的变化规律:在稀溶液中,当二元配合物PS-(NBA)3-Eu(Ⅲ)的浓度从4.0×10-6mol·L-1增大至4.0×10-4mol·L-1时,其荧光发射强度逐渐变弱,呈现出苯环上硝基取代基对配合物荧光发射的负性影响.导致此结果的原因是硝基对荧光化合物的淬灭作用,此淬灭作用是由荧光共振能量转移(FRET)现象(激发态给体分子的能量转移至受体分子的现象,或激发态的电子给体将电子转移至电子受体的现象)所引起的,22-24这是目前广为报道的一种光物理过程.22随着配合物浓度的增大,体系中硝基的浓度也在增大,荧光共振能量转移(FRET)现象不断被强化,即处于激发态的稀土配合物将其能量转移至与之相邻的配合物中硝基受体的程度不断加强,导致二元稀土配合物PS-(NBA)3-Eu(Ⅲ)荧光发射强度不断弱化.上述实验事实充分折射出苯环上硝基取代基对苯甲酸功能化高分子-稀土配合物荧光发射的负性影响.

图6 配合物PS-(NBA)3-Eu(III)(a)和PS-(BA)3-Eu(III)(b)的荧光发射光谱随浓度的变化Fig.6 ChangeoffluorescenceemissionspectraofPS-(NBA)3-Eu(III)(a)and PS-(BA)3-Eu(III)(b)with concentrtions
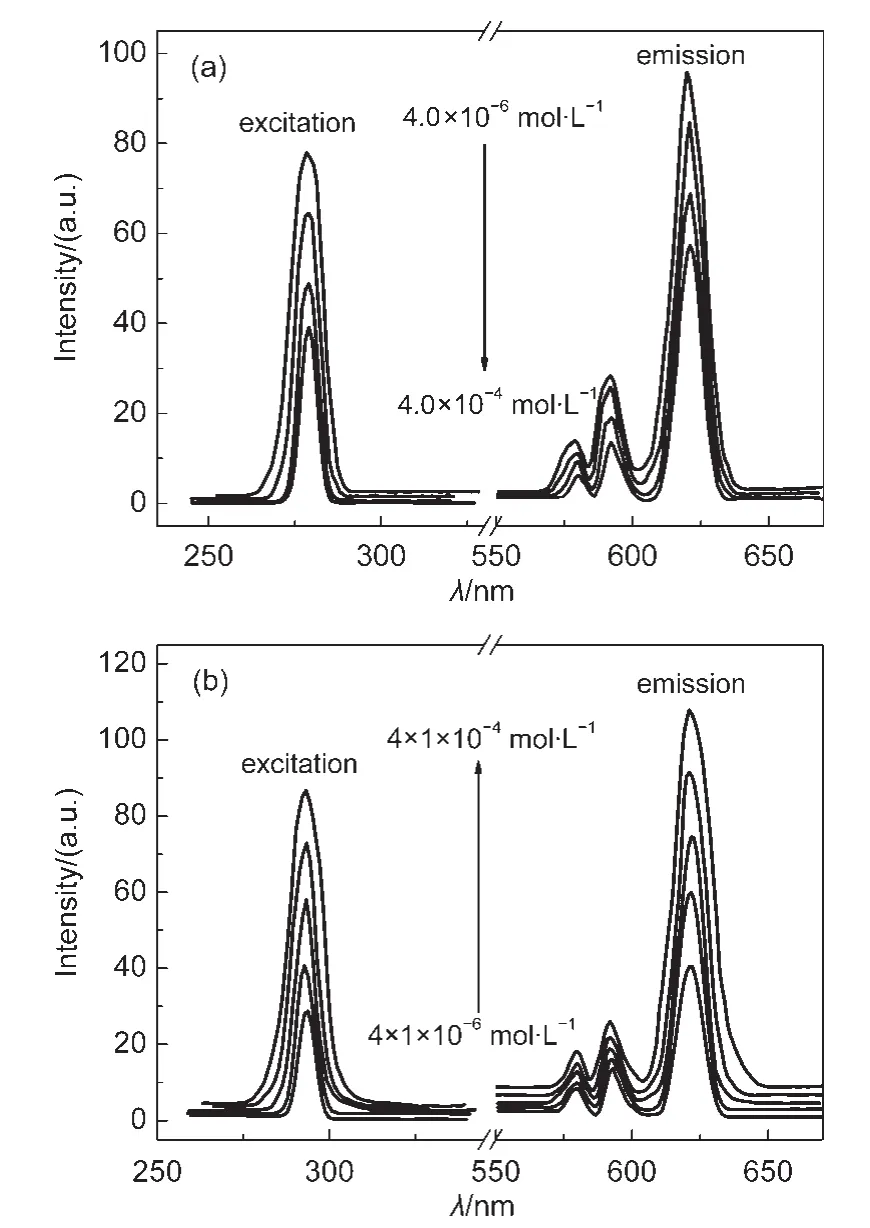
图7 配合物PS-(NBA)3-Eu(III)-Phen1(a)和配合物PS-(BA)3-Eu(III)-Phen1(b)的荧光发射光谱随浓度的变化Fig.7 Change of fluorescence emission spectra of PS-(NBA)3-Eu(III)-Phen1(a)and PS-(BA)3-Eu(III)-Phen1(b)with concentrtion
3.4.2 三元配合物的荧光发射强度与浓度的关系
以DMF为溶剂,在4.0×10-4-4.0×10-6mol·L-1的浓度范围内,也配制了浓度系列变化的三元配合物 PS-(NBA)3-Eu(Ⅲ)-Phen1和 PS-(BA)3-Eu(Ⅲ)-Phen1的溶液,测定了它们的荧光发射光谱,分别示于图7(a)与图7(b).
从图7(a)和图7(b)也看到了与图6(a)和图6(b)相似的实验结果,在稀溶液范围内,三元配合物PS-(BA)3-Eu(Ⅲ)-Phen1(图7(b))的荧光发射强度随浓度增大而变强,而三元配合物PS-(NBA)3-Eu(Ⅲ)-Phen1(图7(a))的荧光发射强度,却随着浓度从4.0×10-6mol·L-1增大至4.0×10-4mol·L-1,逐渐变弱,同样反映出硝基对荧光化合物的淬灭作用,即同样折射出苯环上硝基取代基对苯甲酸功能化高分子-稀土配合物荧光发射的负性影响.
4 结论
本研究在制备硝基苯甲酸(NBA)功能化聚苯乙烯(PS-NBA)的基础上,制备了二元高分子-稀土配合物PS-(NBA)3-Eu(Ⅲ)和三元高分子-稀土配合物PS-(NBA)3-Eu(Ⅲ)-Phen1,重点研究了芳环上硝基取代基对苯甲酸功能化高分子-稀土配合物光致发光性能的影响.当中心离子为Eu(Ⅲ)离子时,芳环上的硝基取代基对苯甲酸功能化高分子-稀土配合物的荧光发射有着正性影响,通过配基内的电荷转移,可有效降低苯甲酸配基的三线态,增强苯甲酸配基与Eu(Ⅲ)离子共振能级的匹配程度,显著提高高分子-稀土配合物光致发光性能.另一方面,芳环上的硝基对于上述二元及三元高分子-稀土配合物的荧光发射具有淬灭作用,当其浓度从4.0×10-6mol·L-1增大至4.0×10-4mol·L-1,配合物将共振能量转移(FRET)至硝基的程度增强,淬灭作用加剧,使配合物的荧光发射逐渐变弱,表现出硝基取代基对上述配合物发光性能的负性影响.
(1) Setua,S.;Menon,D.;Asok,A.;Nair,S.;Koyakutty,M.Biomaterials2010,31,714.doi:10.1016/j.biomaterials.2009.09.090
(2)Shunmugam,R.;Tew,G.N.Polym.Adv.Technol.2007,18,940.
(3)Li,D.G.;Zhu,J.;Cheng,Z.P.;Zhang,W.;Zhu,X.L.React.Funct.Polym.2009,69,240.doi:10.1016/j.reactfunctpolym.2009.01.008
(4) Zhang,R.X.;Gao,B.J.;Wei,X.P.Acta Phys.-Chim.Sin.2012,28,223.[张瑞霞,高保娇,卫霄鹏.物理化学学报,2012,28,223.].doi:10.3866/PKU.WHXB201111171
(5) Gao,B.J.;Fang,L.;Men,J.Y.Polymer2012,53,4709.doi:10.1016/j.polymer.2012.07.059
(6) Maji,S.;Viswanathan,K.S.J.J.Lumines.2008,128,1255.doi:10.1016/j.jlumin.2007.12.002
(7) Liu,T.H.;Duan,G.J.;Zhang,Y.P.;Fang,J.;Zeng,Z.Z.Spectrochim.Acta Part A2009,74,843.doi:10.1016/j.saa.2009.06.062
(8)Hilder,M.;Junk,P.C.;Kynast,U.H.;Lezhnina,M.M.J.Photochem.Photobiol.A2009,202,10.doi:10.1016/j.jphotochem.2008.10.026
(9) Xu,Z.Q.;Gao,B.J.;Hou,X.D.Chinese Journal of Applied Chemistry2014,31,133.[许泽清,高保娇,侯晓东.应用化学,2014,31,133.
(10) Heinz,B.;Schmierer,T.;Laimgruber,S.;Gilch,P.J.Photochem.Photobiol.A2008,199,27.doi:10.1016/j.jphotochem.2008.06.011
(11) Gai,L.Z.;Mack,J.;Liu,H.;Xu,Z.;Lu,H.;Li,Z.F.Sens.Actuators B2013,182,1.
(12) Taha,Z.A.;Ajlouni,A.M.;Al-Hassan,K.A.;Hijazi,A.K.;Faiq,A.B.Spectrochim.Acta Part A2011,81,317.doi:10.1016/j.saa.2011.06.018
(13)Fu,Y.L.;Zhang,J.C.;Lv,Y.G.;Cao,W.L.Spectrochim.Acta Part A2008,70,646.doi:10.1016/j.saa.2007.08.014
(14)Yan,B.;Wang,W.J.;Song,Y.S.Spectrochim.Acta,Part A2007,66,1115.doi:10.1016/j.saa.2006.05.024
(15) Pei,J.;Geng,X.T.;Yan,J.B.;Zhang,Y.H.;Zhao,Y.J.Alloy.Compd.2006,426,363.doi:10.1016/j.jallcom.2006.02.030
(16)Yang,S.P.;Yang,H.;Yu,X.B.;Wang,Z.M.J.Mol.Struct.2003,659,97.doi:10.1016/j.molstruc.2003.08.008
(17)Tsaryuka,V.;Kudryashova,V.;Gawryszewska,P.;Szostak,R.;Vologzhanina,A.K.;Klemenkova,Z.;Legendziewicz,J.;Zolin,V.J.Photochem.Photobiol.A2012,239,37.
(18)Marmodée,B.;Klerk,J.S.;Ariese,F.;Gooijer,C.;Kumke,M.U.Anal.Chim.Acta2009,652,285.doi:10.1016/j.aca.2009.06.006
(19)Sivakumar,S.;Reddy,M.L.P.;Cowley,A.H.;Vasudevan,K.V.Dalton Transactions2010,39,776.doi:10.1039/b917256d
(20)Yan,C.H.;Hu,H.H.;Xu,C.J.;Zhu,W.;Zhang,M.;Bu,X.R.J.Photochem.Photobiol.A2009,204,19.doi:10.1016/j.jphotochem.2009.02.012
(21) Liu,D.;Wang,Z.G.;Yu,H.;You,J.Eur.Polym.J.2009,45,2260.doi:10.1016/j.eurpolymj.2009.05.014
(22) Chu,F.H.;Yang,J.J.Optik2011,122,2246.doi:10.1016/j.ijleo.2011.03.002
(23)Rosso,P.G.D.;Almassio,M.F.;Palomar,G.R.;Garay,R.O.Sens.Actuators B2011,160,524.
(24) Patra,D.;Mishra,A.K.Sens.Actuators B2001,80,278.doi:10.1016/j.snb.2011.08.021

