戊型肝炎病毒IV型衣壳蛋白缺失突变体原核表达与性质
邱义兰,吴俊文,邱果,李桑,李烨,刘胜姿,刘如石,3
1 湖南师范大学生命科学学院,湖南 长沙 410081 2 湖南师范大学医学院,湖南 长沙 410013 3 湖南农业大学生物科学技术学院, 湖南 长沙 410128
戊型肝炎是全球最主要的病毒性肝炎之一,由HEV感染导致,戊型肝炎多数呈自限性,其症状与甲肝相似,但症状更重,死亡率更高,该病孕妇死亡率高达 20%,慢性肝病患者合并戊型肝炎感染容易引发肝衰竭,病死率达70%[1-4]。HEV 至少可以分为 4 个基因型,在中国主要流行的是基因Ⅰ型和基因Ⅳ型 HEV。根据易感宿主又可以分为 2 个大类:一类 (H类) 仅分离于人类,包括基因Ⅰ型和基因Ⅱ型,是迄今病因明确的大规模戊肝爆发的病原体,实验动物目前只成功感染非人灵长类;另一类(Z类) 广泛分布于世界各地,只见于小规模流行和临床散发病例,可以感染多种哺乳动物,目前研究发现猪为 Z类HEV的天然宿主[5-7]。由于缺乏可靠的 HEV细胞培养模型及动物模型,对完整 HEV的研究较少,因此,H类和Z类在跨种间感染入侵宿主细胞机制的差异,以及致病机理至今还不清楚。
HEV ORF2 编码主要结构蛋白,形成病毒衣壳蛋白,介导HEV与宿主的吸附。现有的研究结果证明,HEV的主要中和表位位于 ORF2的aa384-606之间,也是主要介导HEV与嗜性细胞吸附的区域[2-3,8-10]。本实验室在表达基因Ⅰ型HEV衣壳蛋白的基础上,进一步利用大肠杆菌表达基因Ⅳ型 HEV衣壳蛋白缺失体 (ORF2 aa384-606),并研究了重组表达蛋白的免疫反应性质和部分物理性质,证明表达的基因Ⅳ型HEV衣壳蛋白模拟了天然病毒颗粒的中和表位,其与受体的结合方式与天然病毒结合受体的方式可能一致,为进一步从分子水平研究戊型肝炎病毒基因Ⅰ型和基因型Ⅳ感染宿主细胞差异的机制打下了基础。
1 材料与方法
1.1 材料
HEV基因:基因Ⅳ型HEV ORF2 (aa384-606)基因来源于我国戊肝病人的血清标本 (厦门大学夏宁邵教授惠赠),单克隆抗体15B2和8C11、HRP-羊抗鼠二抗、HRP-羊抗人 IgG和 HRP-羊抗人IgM (夏宁邵教授惠赠);pMD-18T、Taq酶、T4 DNA连接酶、EcoRⅠ和NdeⅠ (TaKaRa公司);DNA胶回收试剂盒与质粒提取试 (上海生工生物工程技术服务有限公司);蛋白质相对分子质量标准 (Genestar公司);硝酸纤维素膜(Schleicher & Schuell公司);HRP-DAB底物显色试剂盒 (TIANGEN公司)。
1.2 方法
1.2.1 rP24基因的编码序列克隆与构建表达载体

1.2.2 重组蛋白的表达和纯化
挑取筛选的单克隆菌株,接种到5 mL LB液体培养基中 (含有100 μg/mL Kan+) 37 ℃培养至OD600值达到0.6,加入终浓度为0.4 mmol/L的 IPTG进行诱导表达,SDS-PAGE分析重组蛋白的表达情况。表达的包涵体蛋白先溶于4 mol/L尿素,然后样品透析到20倍体积以上的PBS溶液 (20 mmol/L NaCl, 2.68 mmol/L KCl, 10 mmol/L Na2HPO4, 1.76 mmol/L KH2PO4, pH 7.4) 中 4℃复性,2−3 h更换一次PBS溶液,4 ℃、8 000×g离心 10 min,收集离心后的上清液即为复性的重组蛋白。
用10倍柱体积的PBS先平衡离子交换层析柱 (DEAE-5PW,21.5 mm×150 mm,日本TOSOH公司) 将复性蛋白样品上柱,以2倍柱床体积的PBS缓冲液过柱,然后线性梯度 0–1 mol/L NaCl/PBS洗脱液进行洗脱,流速为1.0 mL/min,收集280 nm吸收值大于0.5 AU的蛋白峰,每管收集1 mL,SDS-PAGE分析收集组分的蛋白纯度。
收集离子交换柱纯化重组蛋白,上样于平衡好的分子筛层析柱 (TSK-GEL G 3 000 SW 7.5 mm×300 mm,日本 TOSOH),流速为0.5 mL/min,收集280 nm吸收值大于0.2 AU的蛋白峰,每管收集1 mL,SDS-PAGE分析收集组分的蛋白纯度。
1.2.3 蛋白印迹实验 (Western blotting)
蛋白样品经 12%的 SDS-PAGE后转移到PVDF膜进行杂交:用含 5%的脱脂奶的 TBS(100 mmol/L Tris·HCl, 150 mmol/L NaCl, pH7.5)缓冲液封闭 2 h。加入用脱脂奶稀释的抗 HEV ORF2鼠源单克隆抗体,室温反应 2 h;TBST缓 冲 液 (100 mmol/L Tris·HCl, 150 mmol/L NaCl, 0.05% Tween-20, pH 7.5) 洗膜3次,每次10 min;加入HRP酶标羊抗鼠,室温反应2 h,用TBST洗膜3次,每次10 min,用HRP-DAB显色试剂盒显色。
1.2.4 酶联免疫吸附分析 (ELISA)
将纯化的 rP24重组蛋白用碳酸盐缓冲液(3.5 mmol/L NaHCO3, 15 mmol/L Na2CO3,3 mmol/L NaN3) 稀释抗原至终浓度为1 μg/mL,聚苯乙烯板的每孔包被100 μL,37 ℃包被2 h;弃孔内液体,PBST洗涤1次,每孔加入200 μL封闭液 (2%明胶,0.5%酪蛋白,0.1% ProClin 300),37 ℃封闭2 h后抽干;加入样品稀释液(2% 明胶,0.5% 酪蛋白,0.1% ProClin 300,15% 新生牛血清) 稀释的待检样品 100 μL,37 ℃孵育30 min,PBST洗涤3次;每孔加入封闭液稀释的 HRP-羊抗人二抗 100 μL,37 ℃孵育30 min,PBST洗涤3次;每孔加入100 μL显色液,37 ℃避光显色10 min,加终止液终止显色液,450 nm/620 nm双波长检测各孔的OD值。
1.2.5 纯化后蛋白的动态光散射
动态光散射专用的石英比色皿用 0.22 μm微孔滤膜过滤的超纯水反复冲洗20遍以上。待测样品经 4 ℃、15 000×g 离心 15 min 后,取 50 μL样品至比色皿中,待温度平衡到25 ℃时,将比色皿放入动态光散射仪 (美国 PROTEIN SOLUTION公司,DYNAORO99-D-50型) 样品架进行测量,入射波长为824 nm,溶剂为PBS,采用Regulation算法计算,根据需要设置过滤参数和分析分辨率。
1.2.6 纯化蛋白非变性聚丙烯酰胺凝胶电泳(Native Blue PAGE)
非变性电泳参考 Wittig等[11]的方法,稍作修改,具体步骤如下:配制 13%的分离胶,蛋白样品和上样缓冲液按 1∶1的比例混匀上样,先恒压100 V于4 ℃电泳,待样品进入浓缩胶后,恒压300 V继续电泳,当蛋白样品在分离胶中泳动达到分离胶的 1/3处时,更换为 1/10负极缓冲液,然后固定、染色与脱色。
2 结果与分析
2.1 原核表达载体的构建与鉴定
P24基因经过 PCR 扩增后,产物用 1.5%琼脂糖进行电泳检测,结果在500−750 bp之间发现唯一一条清晰、大小约为600 bp DNA条带(图1A),与P24基因理论值大小相符。连接到T载体上后送上海生工测序,结果显示该序列与GenBank中基因Ⅳ型HEV基因序列 (GenBank Accession No. AB161717.1) 完全一致。然后将P24基因亚克隆到pTO-T7表达质粒中,重组质粒 pTO-T7-P24经NdeⅠ和EcoRⅠ双酶切和电泳检测后,结果在 600 bp位置处观察到 DNA条带,说明P24基因已经成功克隆到表达载体上 (图 1B)。
2.2 rP24的诱导表达
将诱导好的重组rP24菌株和仅转化空母体质粒的对照组菌株制备蛋白样品并进行SDS-PAGE检测,结果在rP24重组菌株诱导表达的试验组中可以观察到一条相对较粗的蛋白条带,其相对分子质量大小约为25 kDa,与基因Ⅳ型HEV rP24的理论分子量23.25 kDa基本一致,这种分子量大小的差异可能是重组蛋白构象与天然蛋白不一致造成的。而在对照组中没有出现这一分子量大小的蛋白条带 (图 2A),说明rP24在重组菌株中可能获得了高效表达。Western blotting结果显示,表达的重组蛋白与鼠源抗HEV ORF2蛋白单克隆抗体15B2发生特异性反应 (图2B),进一步说明P24基因在大肠杆菌中获得了高效表达,而且具有良好的免疫反应性。
2.3 抗原蛋白的大量表达及包涵体纯化
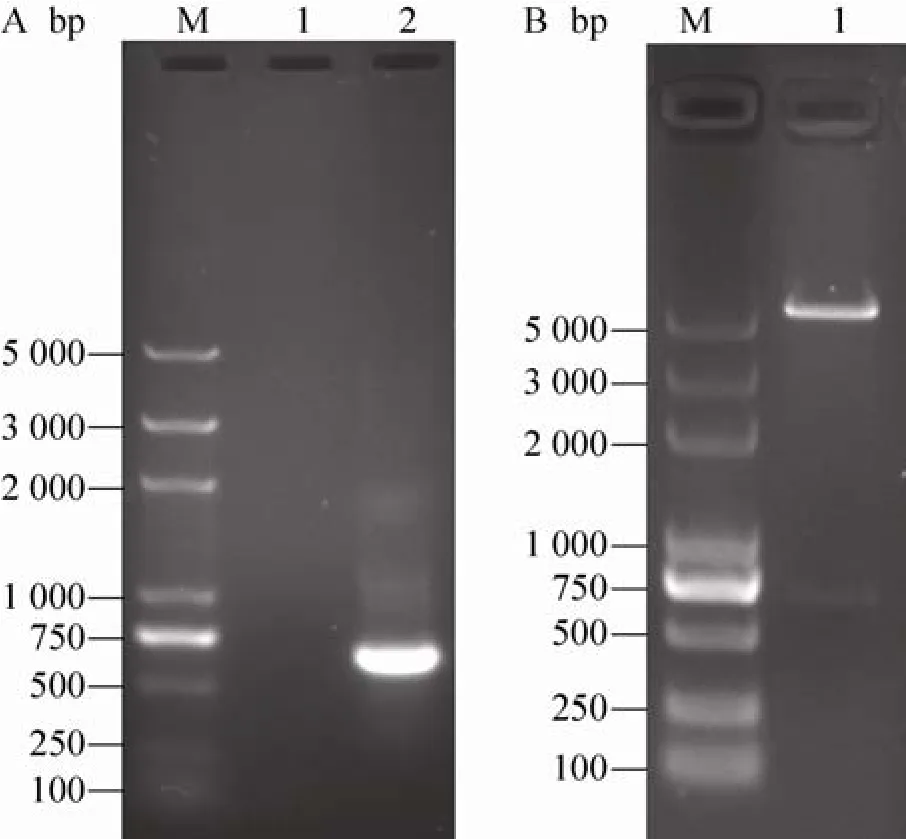
图1 HEV IV型p24基因原核表达载体的构建与鉴定Fig. 1 Construction and identification of prokaryotic expression plasmid of genotype Ⅳ HEV P24 gene. (A)PCR products of genotype Ⅳ HEV P24 gene. M: DNA marker DL5000; 1: negative control; 2: PCR products of genotype Ⅳ HEV P24 gene. (B) Restriction map recombinant plasmid by enzyme digestion. M: DNA marker DL5000; 1: recombinant plasmid pTO-T7-P24 digested by NdeanⅠd EcoRⅠ.
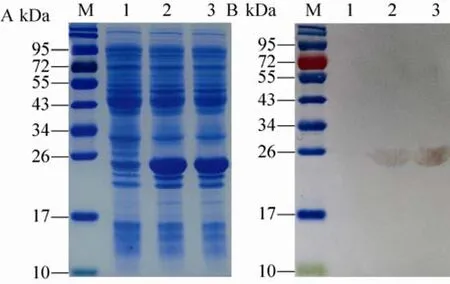
图2 HEV IV型p24基因在大肠杆菌中的表达鉴定Fig. 2 Identification of recombinant genotype ⅣHEV rP24 protein expressed in E. coli. (A) SDS-PAGE analysis of recombinant genotype Ⅳ HEV P24 protein expressed in E. coli. M: protein marker; 1: total protein expression profile of E. coli tranfected pTO-T7 with IPTG induction; 2–3: total protein expression profile of E. coli tranfected pTO-T7-P24 with IPTG induction. (B)Western blotting analysis of genotype Ⅳ HEV rP24 expressed in E. coli with 15B2. M: protein marker; 1:immunoblotting profile with 15B2 of total protein expression of E. coli tranfected pTO-T7 with IPTG induction; 2–3: immunoblotting profile with 15B2 of total protein expression of E. coli tranfected pTO-T7-P24 with IPTG induction.
超声破碎细胞后,取100 μL细胞悬液4 ℃、12 000×g离心10 min,分别收集上清和沉淀,制备蛋白样品进行 SDS-PAGE,结果显示,重组目的蛋白主要分布在沉淀,说明目的蛋白的表达是以包涵体的形式存在 (图 3A)。经过Bandscan软件分析rP24在沉淀中占到总蛋白的96%。通过用缓冲液Ⅰ (20 mmol/L Tris·HCl,5 mmol/L EDTA, 100 mmol/L NaCl, pH 7.4) 和TritonX-100缓冲液Ⅰ洗涤,去除部分杂蛋白。洗涤后的包涵体蛋白在2 mol/L、4 mol/L、8 mol/L尿素/缓冲液Ⅰ中均能溶解,但是rP24在2 mol/L尿素/缓冲液Ⅰ中溶解度较小,在4 mol/L尿素/缓冲液Ⅰ中溶解量很大,且rP24能形成同源二聚体,4 mol/L尿素/缓冲液Ⅰ中不能溶解的部分在8 mol/L尿素/缓冲液Ⅰ中可以溶解 (图3B),而且经过包涵体洗涤后,去除了相当部分杂蛋白,目的蛋白获得了有效的纯化。Western blotting结果说明不论是单体还是二聚体都能与单克隆抗体 15B2有很强的反应,进一步说明rP24具有良好的免疫反应性 (图3C)。本研究表达的蛋白分子量约为25 kDa,二聚体蛋白的分子量约为40 kDa,小于正常天然蛋白二聚体分子量 46.5 kDa。这可能既有重组蛋白构型问题而导致相对分子量的偏差,也可能还存在通过蛋白质的疏水作用,使蛋白质的高级结构变得更加紧密,导致相同电泳条件下泳动速度加快,从而使二聚体的相对分子量变小。
2.4 蛋白的复性、反应活性检测与纯化
将4 mol/L尿素/bufferⅠ溶解的rP24于4 ℃的PBS中透析复性,然后将复性样品进行SDSPAGE。结果显示 rP24复性后以单体和二聚体的形式存在,目的蛋白复性后,单体的量变小,二聚体的量增大。目的蛋白与抗HEV ORF2蛋白鼠源单克隆抗体8C11的Western blotting结果显示,复性后的蛋白具有良好的免疫反应性(图4A, B)。将一抗改用HEV阳性血清进行免疫印迹检测,结果显示聚体与血清能发生强烈的反应,单体与血清的反应能力相对弱一些,而且复性蛋白样品在95–113 kDa之间有明显免疫印迹反应条带,说明rP24具有形成寡聚体蛋白的能力 (图4C, D)。而复性样品在SDS存在条件下煮沸处理后,蛋白质的构想发生改变,不能形成二聚体,蛋白只能以单体蛋白条带存在。
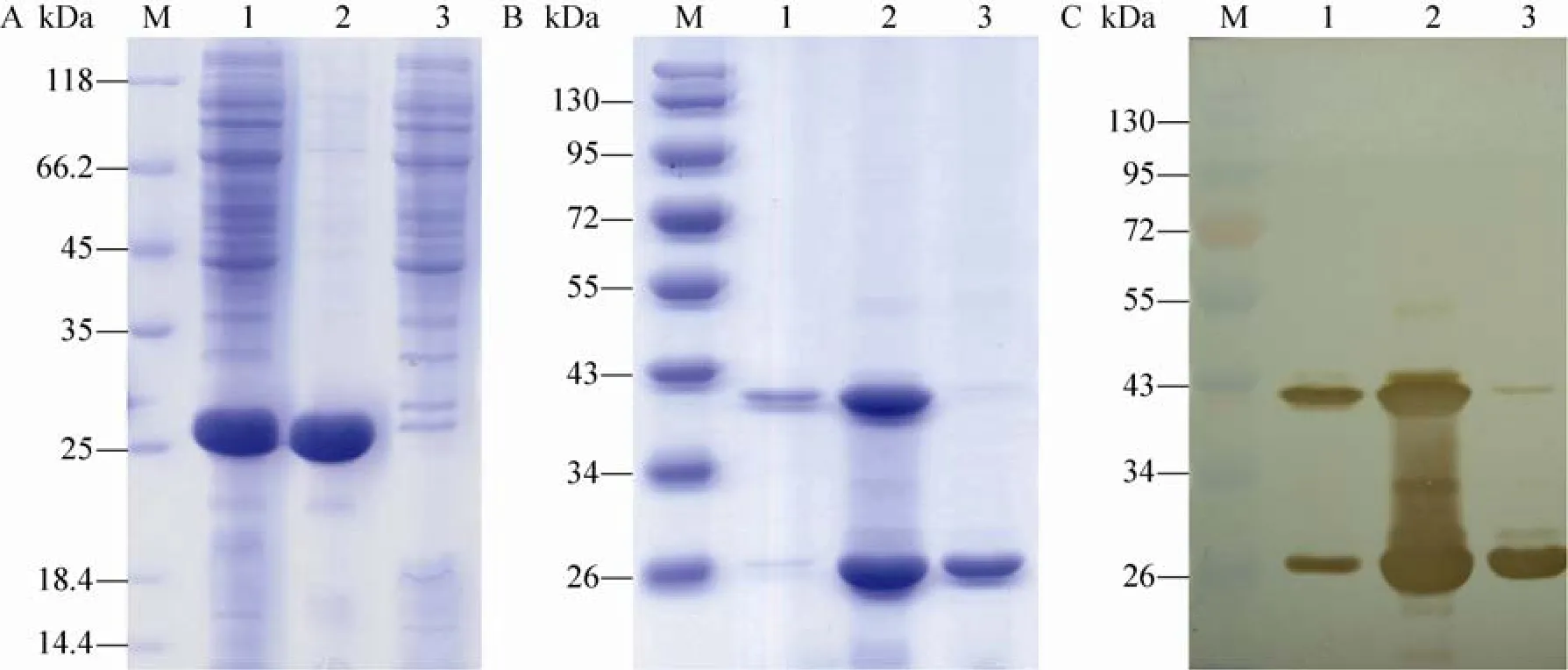
图3 重组IV HEV rP24蛋白包涵体纯化Fig. 3 Purification of recombinant genotype Ⅳ HEV rP24 inclusion body protein. (A) SDS-PAGE analysis the expression forms of P24 protein. M: protein marker; 1: total protein expression profile of cell lysis solution with IPTG induction; 2: precipitation of cell lysis solution with IPTG induction; 3: supernatant of cell lysis solution with IPTG induction. (B) SDS-PAGE analysis dissolubility of rP24 resolved in different concentration of urea. M: protein marker; 1–3: rP24 protein dissolved in 2 mol/L, 4 mol/L, 8 mol/L urea/BufferⅠrespectively. (C) immunoblotting profile of rP24 protein with 15B2 of dissolved in 2 mol/L, 4 mol/L, 8 mol/L urea/BufferⅠrespectively. M: protein marker; 1–3: rP24 protein dissolved in 2 mol/L, 4 mol/L, 8 mol/L urea/BufferⅠrespectively.
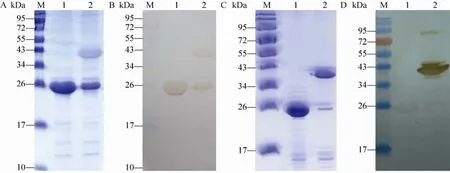
图4 重组P24蛋白免疫反应活性分析Fig. 4 Immunoreacivity analysis of renatured recombinant rP24. (A) and (C) SDS-PAGE analysis of renatured rP24.M: protein marker; 1: renatured recombinant rP24 (boiled); 2: renatured rP24 (no boiled). (B) Immunoblotting profile of rP24 to 8C11. (D) Immunoblotting profile of rP24 to HEV positive serum. M: protein marker; 1: renatured rP24(boiled); 2: renatured rP24 (no boiled).
这些结果说明rP24可以通过透析复性,蛋白复性后可以以单体、二聚体和多聚体的形式存在,其中二聚体结合最为紧密,即使在 SDS存在的不沸水浴条件下仍不被完全破坏。分析aa序列一级结构发现,p24 aa中不含有半胱氨酸,不可能形成二硫键,也没有形成强离子键的 aa基础;再通过 DNASTAR软件包中的Protean程序提供的Kyte-doolittle算法分析,p24 aa199-210为疏水性最强的区域,由于p24为病毒的衣壳蛋白,该疏水区域发生的疏水相互作用可能在形成同源二聚体作用中发挥了重要作用。
通过生物信息学软件分析,rP24一级结构等电点为 5.23,适合使用阴离子交换层析进行纯化,因此采用DEAE-5PW阴离子交换层析柱进行蛋白的纯化,在rP24的离子交换层析图谱上可以发现一个极小穿透峰、一个主峰,另外在层析图谱的主峰前有2个小峰。主峰的出峰时间为24 min左右,占总面积的73.75% (图5A),主峰前的小峰可能是不成熟的蛋白多聚体,由于不能形成正确的空间构象,其表面所带电荷与成熟的蛋白聚体表面所带电荷不一样,所以洗脱的出峰时间也不一样。目的蛋白经过离子交换层析纯化后,蛋白聚体的均一性得到了有效的提高。
分子筛层析不仅能分离纯化目的蛋白,而且还可以起到脱盐的作用。将离子交换层析纯化的蛋白上样于分子筛层析柱 (TSK-GEL G 3 000 SW),洗脱流速为0.5 mL/min,从rP24的凝胶层析图谱中可以看到一个大峰和一个小峰,大峰的出峰时间为 7 min左右,占总面积的80.63%;小峰的出峰时间为5 min左右,小峰面积占总面积的12.93% (图5B),其中的小峰可能是复性后形成的寡聚体蛋白 (图4C,泳道2),其带电性质和二聚体相同,因而在离子交换层析中和二聚体同时被洗脱,但是在凝胶分子筛层析中,由于分子量较大而先被洗脱,收集小峰蛋白进行Native-PAGE (图5C),结果发现,大峰蛋白的分子量介于45 kDa和98 kDa之间,为了进一步鉴定Native blue PAGE上rP24多聚体,同时也为验证收集小峰蛋白为大于45 kDa的rP24多聚体,将收集的第1个峰 (保留时间为5 min) 和第2个峰 (保留时间为7.5 min) 的蛋白分别收集,经过冷冻干燥后,两个峰的蛋白质进行 SDS-PAGE,结果表明,第 1个峰和第 2个峰的蛋白在沸水浴和非沸水浴处理后,均可以形成二聚体蛋白,电泳结果通过Bandscan软件分析显示:纯化后rP24的纯度超过99%,在SDS电泳缓冲液中,单体蛋白的含量极少,主要以二聚体的形式存在 (图6)。
2.5 rP24动态光散射实验
纯化后的rP24样品经过过滤后,用动态光散射仪测量水化分子动力学半径,得到一个质量贡献比 100%的峰,重组 rP24的平均水化半径为7.48 nm (图7),相当于平均分子量90 kDa,rP24的分散度较小,说明rP24经过纯化后,蛋白在PBS溶液中形成平均为四聚体的多种聚合状态,且聚体的均一性很高。
2.6 重组rP24免疫原性
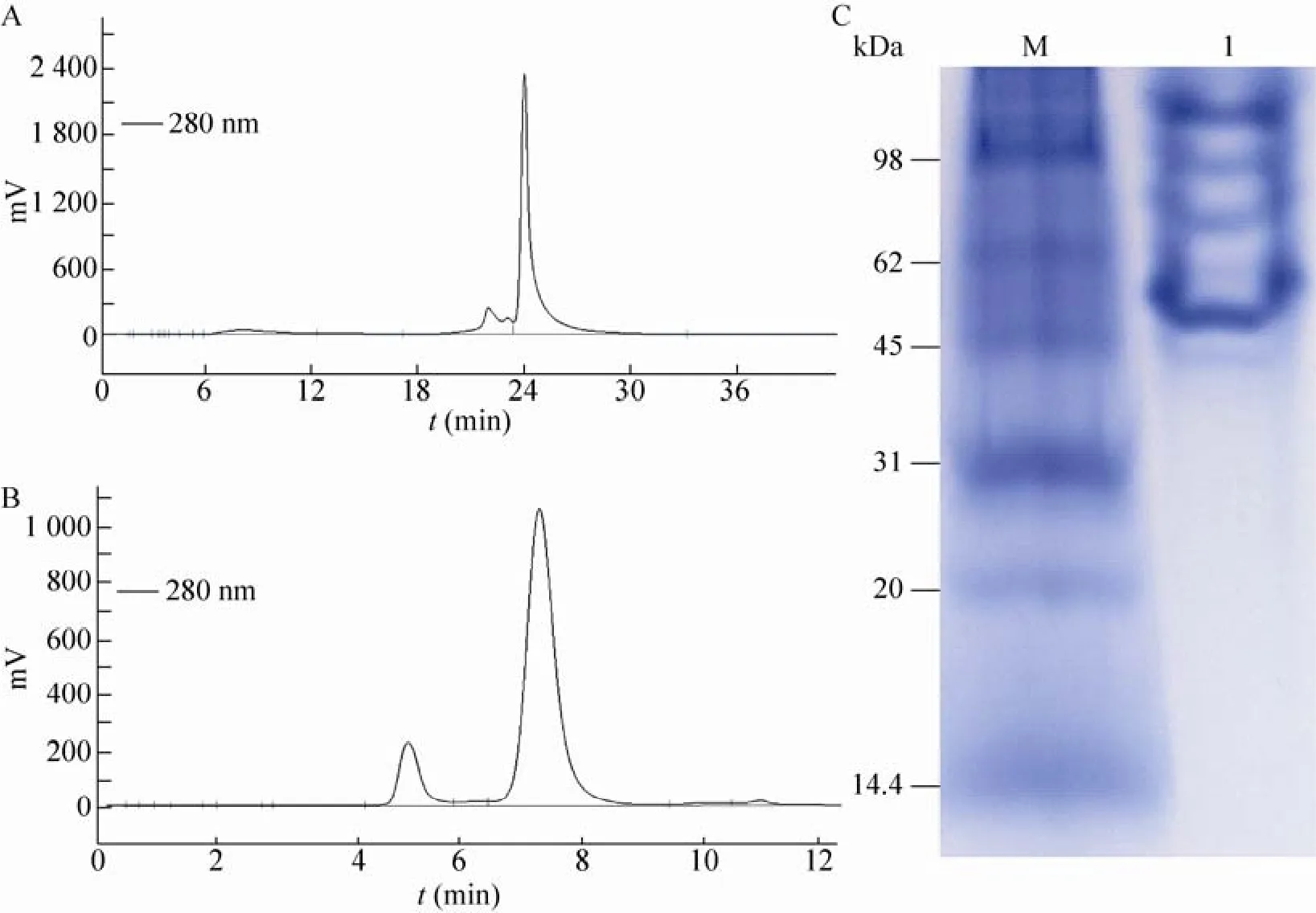
图5 重组P24蛋白的离子交换、分子筛层析与非变性聚丙烯酰胺凝胶电泳Fig. 5 Profile of ion exchange chromatogram and Molecular sieve chromatogram and native-PAGE of rP24. (A)Profile of ion exchange chromatogram of rP24. (B) Profile of molecular sieve chromatogram of rP24. (C)Native-PAGE of rP24 (M: native protein marker; 1: purified rP24).
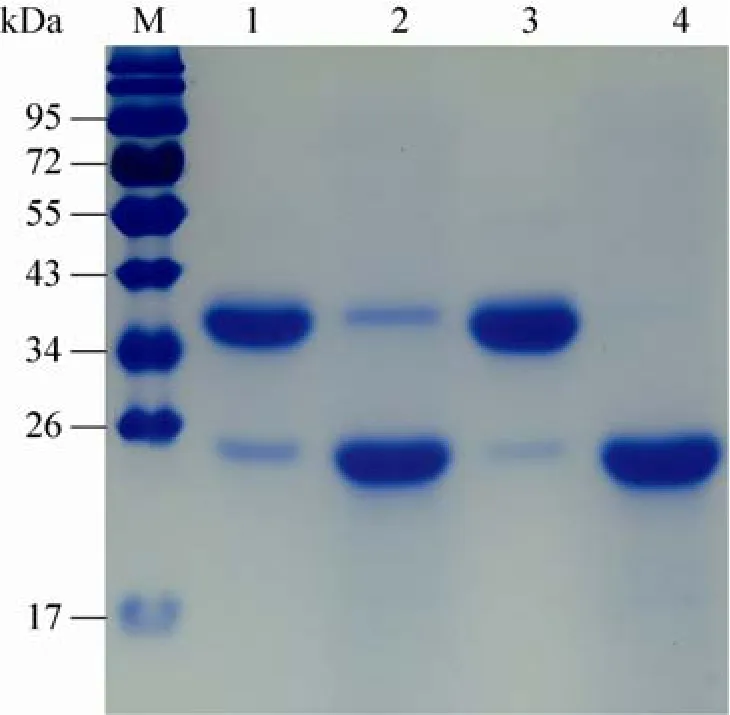
图 6 分子筛层析纯化蛋白SDS-PAGEFig. 6 SDS-PAGE analysis of rP24 after purified by molecular sieve chromatography. M: protein marker; 1:rP24 from the first peak (no boiled); 2: rP24 from the first peak (boiled); 3: rP24 from the second peak (no boiled); 4: rP24 from the second peak (boiled).
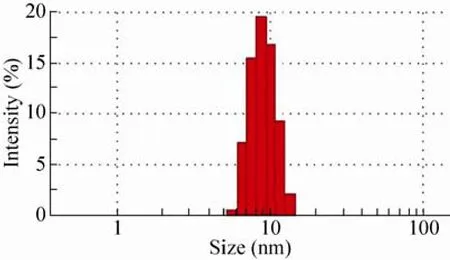
图7 纯化重组P24分子溶液中水化半径的检测Fig. 7 Hydrated radius of purified recombinant p24 protein in solution.
以不同剂量的纯化rP24免疫Balb/C小鼠,免疫后的不同时间从小鼠尾静脉采血检验血清的阳转数,其结果如表1所示,5周时,rP24 2 μg以上剂量免疫的小鼠全部阳转,0.5 μg免疫有6/8只小鼠阳转,小鼠ED50在0.6–1.0 μg之间。同时从该表中还可以看出,小鼠的免疫剂量与免疫产生的抗体持久性呈正相关,免疫小鼠产生的抗体滴度也与免疫剂量呈正相关,因此说明表达的rP24具有良好的免疫原性。
2.7 rP24作为抗原检测血清的特异性
HEV只有一种血清型,不同基因型的HEV抗原都能与 HEV阳性血清反应。本研究选用Genelab公司检测的24份HE阳性血清和21份HE阴性血清,用本研究表达纯化的 rP24作为包被抗原包被ELISA板条后,采用间接ELISA法对24份HE阳性血清和21份HE阴性血清进行检测,采用北京万泰公司生产的抗 HEV-IgG诊断试剂盒作为对照,每个样品进行双孔重复。
将血清进行1∶100稀释,以2倍标准阴性血清平均值作为阳性血清的判断标准 (Cut off值为0.216),用统计学软件GraphPad Prism分析间接ELISA结果,结果表明:rP24对21份阴性血清的检测结果为阴性,对 24份阳性血清的检测结果为阳性,阳性血清的数据和阴性血清的数据之间差异极显著性 (P<0.000 1),双孔数据间不存在显著性差异 (P>0.05),该结果与北京万泰和Genelab公司检测的结果一致,实验结果说明重组抗原具有良好的免疫反应性和特异性。
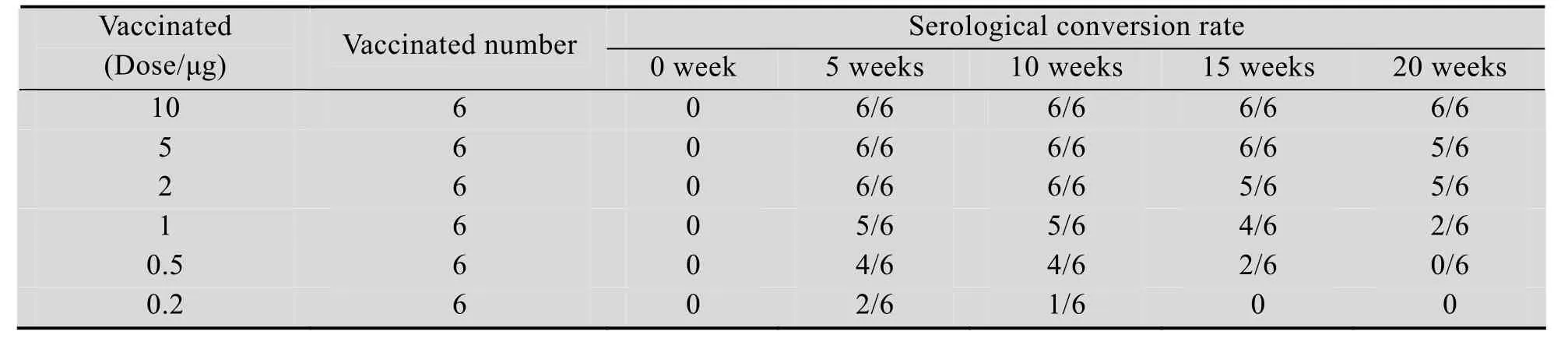
表1 rP24免疫Bal b/C后抗体阳转率与持久性分析Table 1 Analysis of serological conversion rate and antibody persistence of Bal b/C mice vaccinated by recombinant rP24
3 讨论
HE是一个全球性的公共卫生问题,在发展中国家是导致病毒性肝炎的最主要原因,而且时常导致食源性和水源性的暴发流行[12-18]。但病毒感染细胞的机制与致病机制并不清楚。Kapur等[19-21]认为HEV进入肝细胞是在与受体蛋白结合后,由网格蛋白介导的胞吞作用完成。基因Ⅰ型和Ⅱ型HEV只能感染人,基因Ⅲ型和Ⅳ型HEV能感染人和牲畜。两类HEV病毒的宿主不一样,说明可能与细胞上的受体不同有关,并且感染机制也可能会有差异,研究感染差异的原因,将对于防控HEV跨种间感染与传播起到一定的参考作用。
HEV ORF2编码的病毒衣壳是病毒的最外层,因此也包含了病毒的主要中和表位。利用HEV类病毒颗粒模拟病毒是研究病毒感染机制差异性的最佳选择。Li等[22]利用大肠杆菌表达基因Ⅱ型HEV ORF2 aa 368-606,获得融合蛋白p239能通过二聚体的相互作用形成一个直径为23 nm的类病毒颗粒。p239蛋白中具有多个中和表位,蛋白颗粒能很好的模拟HEV的空间结构[22-23]。何水珍等[24-25]利用Ⅱ型 HEV P239蛋白吸附 HepG2 细胞的模型来模拟HEV对宿主细胞的吸附,初步确定了p239与细胞相互作用的区域位于ORF2上的aa 423–443,该段多肽可能和病毒上的细胞膜受体结合部位非常靠近或者直接参与构成了病毒与细胞特异性识别的表位。Guu等[21]和 Li等[26]表达非Ⅳ型HEV类病毒颗粒 (aa 118-608),可分为3个线性区域。这3个区域都含有潜在的多聚糖的结合位点,可能与细胞受体结合有关。
但是目前还没有确定找到人肝细胞HEV受体,H类和Z类HEV感染人和动物的差异的分子机制仍待人们去研究和探讨。由于目前还缺乏成熟的HEV细胞培养模型与动物模型,不可能获得大量的具有感染性的HEV,为了研究H类和Z类HEV病毒感染宿主差异的分子机制。我国流行的HEV主要为基因Ⅰ型和基因Ⅳ型,为结合HEV在我国的流行状况,基因Ⅰ型和基因Ⅳ型HEV跨种间感染的机制,研究本研究拟在表达重组基因I型HEVORF2蛋白的基础上,进一步表达Ⅳ型HEV ORF2蛋白,为研究这两类病毒的跨种间感染机制打下基础。
本研究利用基因工程技术表达了基因Ⅳ型HEV衣壳蛋白rP24 (aa 384–606),包含了与细胞相互作用的蛋白区域。重组蛋白通过 TSK-G 3 000 SW分子筛层析柱和DEAE阴离子交换层析柱纯化以后,蛋白的纯度可达 99%以上,SDS-PAGE结果显示纯化后的蛋白在SDS缓冲液中基本上以二聚体形式存在。rP24蛋白与戊型肝炎阳性血清及中和单克隆抗体8C11的免疫印迹实验结果证明重组rP24蛋白具有良好的免疫反应性,能以单体、二聚体和多聚体的形式存在,说明rP24模拟了HEV的中和表位。虽然利用原子力显微镜和透射电镜观察不到 rP24形成类病毒颗粒,但利用动态光散色实验测得蛋白聚体的平均水化半径约为7.48 nm,聚体的均一性良好。同时动物免疫实验证明,rP24具有良好的免疫原性,免疫小鼠的ED50为0.6−1.0 μg。因此以上实验表明,rP24在PBS溶液能形成蛋白多聚体,多聚体具有一定的空间构象,并且还包含了HEV衣壳蛋白的中和表位,因此该重组蛋白作为研究人和动物受体的主要材料,适合进一步研究基因Ⅰ型和基因Ⅳ型HEV感染机制的差异性,从而为预防HEV跨种间传播的研究提供一定的参考作用。下一步我们将以此为材料进一步研究HEV基因Ⅰ型和基因Ⅳ型HEV跨种间感染细胞差异的机制。同时,rP24也可以作为HEV血清诊断试剂的潜在关键原料,具有一定的应用价值。
致谢:此文部分工作由湖南省基础医学重点学科和生物发育工程及新产品研发湖南省协同创新中心资助。
[1]Xiao P, Li R, She R, et al. Prevalence of hepatitis E virus in swine fed on kitchen residue. PLoS ONE,2012, 7 (3): e33480.
[2]Dalton HR, Bendall R, Ijaz S, et al. Hepatitis E: an emerging infection in developed countries. Lancet Infect Dis, 2008, 8(11): 698−709.
[3]Teshale EH, Hu DJ. Hepatitis E: epidemiology and prevention. World J Hepatol, 2011, 3(12):285−291.
[4]Parvez MK, Purcell RH, Emerson SU, et al.Hepatitis E virus ORF2 protein over-expressed by baculovirus in hepatoma cells, efficiently encapsidates and transmits the viral RNA to naïve cells. Virol J, 2011, 8: 159−164.
[5]Yugo DM, Meng XJ. Hepatitis E virus: foodborne,waterborne and zoonotic transmission. Int Environ Res Public Health, 2013, 10(10): 4507–4533.
[6]Wedemeyer H, Pischke S, Manns MP. Pathogenesis and treatment of hepatitis E virus infection.Gastroenterology, 2012, 142 (6): 1388–1397.
[7]Guo QS, Ge SX, Xiong JH, et al. The molecular differences between genotype 1 and genotype 4 of HEV in their neutralization region. Chin J Virol,2007, 23(6): 454–458 (in Chinese).
郭清顺, 葛胜祥, 熊君辉, 等. 戊型肝炎病毒基因 1 型和基因 4 型中和表位区域分子差异研究. 病毒学报, 2007, 23(6): 454–458.
[8]Xiu BS, Feng XY, He J, et al. Use of immuno-dominant epitope derived from genotype 4 as a diagnostic reagent for detecting the antibodies against Hepatitis E Virus. Virol J, 2013, 10: 131.doi: 10.1186/1743-422X-10-131.
[9]Ahmad I, Holla RP, Jameel S. Molecular virology of hepatitis E virus. Virus Res, 2011, 161(1): 47–58.[10]Liang JH, Dai X, Chen D, et al. A single amino acid substitution changes antigenicity of ORF2-encoded proteins of hepatitis E virus. Int J Mol Sci, 2010, 11(8): 2962–2975.
[11]Wittig I, Braun HP, Schägger H. Blue native PAGE. Nat Protoc, 2006, 1(1): 418–428.
[12]Paula VS de, Wiele M, Mbunkah AH, et al.Hepatitis E virus genotype 3 strains in domestic pigs, cameroon. Emerg Infect Dis, 2013, 19(4):686–688.
[13]Khudyakov Y, Kamili S. Serological diagnostics of hepatitis E virus infection. Virus Res, 2011, 161(1):84–92.
[14]Nelson KE, Kmush B, Labrique AB. The epidemiology of hepatitis E virus infections in developed countries and among immunocompromised patients. Expert Rev Anti Infect Ther, 2011, 9(12): 1133–1148.
[15]Rakesh A, Shahid J. Hepatitis E. Hepatology, 2011,54(6): 2218–2226.
[16]Ghezeldasht SA, Miri R, Hedayatimoghadam M, et al. Population movement and virus spreading: HEV spreading in a pilgrimage city, Mashhad in Northeast Iran: an example. Hepat Mon, 2013,13(8): e10255. doi: 10.5812/hepatmon.10255.
[17]Parvez MK. Chronic hepatitis E infection: risks and controls. Intervirology, 2013, 56: 213–216.
[18]Zekavat OR, Makarem A, Karami MY, et al.Serological investigation for hepatitis E virus infection in the patients with chronic maintenance hemodialysis from southwest of Iran. Asian J Transfus Sci, 2013, 7(1): 21–25.
[19]Kapur N, Thakral D, Durgapal H, et al. Hepatitis E virus enters liver cells through receptor-dependent clathrin-mediated endocytosis. J Viral Hepat, 19(6):436–448.
[20]Zhang W, Hua Xg, Quan S, et al. Identification of genotype 4 hepatitis E virus binding proteins on swine liver cells. Virol J, 2011, 8: 482–487.
[21]Guu TSY, Liu Z, Ye Q, et al. Structure of the hepatitis E virus-like particle suggests mechanisms for virus assembly and receptor binding. Pro Nat Acad Sci USA, 2009, 106(31): 12992–12997.
[22]Li SW, Zhang J, Li Y, et al. A bacterially expressed particulate hepatitis E vaccine: antigenicity,immunogenicity and protectivity on primates.Vaccine, 2005, 23(22): 2893–2901.
[23]Li SW, Tang XH, Seetharaman J, et al.Dimerization of hepatitis E virus capsid protein E2s domain Is essential for virus-host interaction. PLoS Pathog, 2009, 5(8): e1000537. doi:10.1371/journal.ppat.1000537.
[24]He SZ, Miao J, Zheng ZZ, et al. Putative receptor-binding sites of hepatitis E virus. J Gen Virol, 2008; 89: 245–249.
[25]He SZ, Zheng ZZ, Wu T, et al. The establishment of cellular attachment model for hepatitis E virus(HEV) and its application in the identification of HEV cellular attachment region. Chin J Virol,2006, 22(6): 426–430 (in Chinese).
何水珍, 郑子峥, 吴婷, 等. 戊型肝炎病毒细胞吸附模型的建立及病毒吸附区域初步研究. 病毒学报, 2006, 22(6): 426–430.
[26]Li TC, Yamakawa Y, Suzuki K, et al. Expression and self-assembly of empty virus-like particles of hepatitis E virus. J Virol, 1997, 71: 7207–7213.

