口服无乳链球菌弱毒疫苗对罗非鱼肠道影响的组织学观察
全琛宇,杨 磊,王 凯,王 瑞,李丽萍,梁万文,甘 西,李 健,3*,陈 明*
(1.广西水产研究所广西水产遗传育种与健康养殖重点实验室,广西南宁530021;2.广西大学动物科学技术学院,广西南宁530005;3.广西大学食品与质量安全研究中心,广西南宁530005)
无乳链球菌(Streptococcus agalactiae)又称B群链球菌(group B streptococci,GBS),在自然界中广泛分布,是一种重要的人兽共患病原菌[1-3],也是一种重要的水产动物致病菌[4-5]。鱼类无乳链球菌病的流行与暴发在许多国家均有报道[5-9],给罗非鱼养殖业带来严重的经济损失。近年来,鱼类无乳链球菌病在我国的发生率呈上升趋势,特别是位于我国南部的广东、广西和海南等地暴发严重[10-11]。目前,对于罗非鱼链球菌病的防治方法多样,其中使用疫苗免疫是最重要的方法之一。因此,我国正大力发展罗非鱼无乳链球菌病疫苗的研究,并取得一定进展[12-13]。本试验利用自行研制的无乳链球菌口服疫苗免疫罗非鱼,应用HE 染色方法观察肠绒毛形态结构、杯状细胞以及上皮内淋巴细胞的分布和数量,探讨该疫苗的免疫机制及不同免疫剂量的免疫效果,以期为该疫苗的深入研究和推广应用积累资料。
1 材料与方法
1.1 材料
试验用罗非鱼由广西水产研究所国家级罗非鱼良种场提供,体重为100 g±10 g,体长为15cm±2cm;无乳链球菌GX035弱毒苗由广西水产研究所鱼类病害防治实验室提供。
1.2 方法
1.2.1 饲养管理 罗非鱼饲养于室内水箱中(规格:70cm×50cm×40cm),各组水质均为脱氯自来水,全天供氧。试验期间水温保持在27 ℃~29 ℃,每周换水2/3。每天饲喂2 次(8:00 和16:00),日投饲率为2%~3%。
1.2.2 试验分组与处理 选用体重为100g±10g,体长为15cm±2cm 的健康罗非鱼共125尾,随机分为5 个试验组,每组25 尾鱼。免疫前驯养2周。试验Ⅰ、Ⅱ、Ⅲ、Ⅳ组为免疫组,分别投喂剂量为1.0×106、1.0×107、1.0×108、1.0×109CFU/mL的口服型无乳链球菌GX035 弱毒苗(每100g饲料用100 mL 相应浓度的菌悬液拌匀后在50 ℃烘箱中烘干),试验Ⅴ组为空白对照组,投喂未添加疫苗的饲料,按照2.5g/尾进行投喂。
1.2.3 组织切片制备 免疫接种15d后,从各组中随机抽取1尾(共5尾)罗非鱼进行解剖,迅速取出前肠、中肠和后肠分别制样。前肠在胃后端至肠道的第一个弯曲之间取材,中肠在肠道的第一个弯曲至最后一个弯曲之间取材,后肠在肠道最后一个弯曲至肛门之间取材,各肠段长度约1cm。将肠段浸入pH7.2~7.4的磷酸盐缓冲液中冲洗肠道内容物,使用Bouin固定液固定各肠段后,制作石蜡切片,HE染色,显微镜观察[15]。
1.2.4 各指标的形态观察和测量 参照黄玉章等[16]提供的方法,每段肠道选取5张染色效果较好的切片于400倍镜下对以下指标进行观察:肠绒毛、各肠段肌层厚度、杯状细胞、上皮内淋巴细胞,并应用图像分析系统(Superimage verson 6.0.1.2)对其进行拍照和测量。
1.2.5 攻毒试验 免疫20d后,所有鱼(各组均为20尾)均按照1.67×107CFU/尾的剂量腹腔注射感染无乳链球菌,记录攻毒后10d内各组鱼的死亡数,并计算相对免疫保护率(RPS)。

1.2.6 数据处理 应用SPSS 19.0统计软件的单因素方差分析进行生物学统计。结果用“平均值±标准差”表示。P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果
2.1 罗非鱼肠绒毛长度的变化
各试验组不同肠段的肠绒毛长度均呈现前肠最长,中肠次之,后肠最短的规律。免疫组与对照组不同肠段肠绒毛长度相比,差异均不显著(P>0.05)(表1)。
2.2 罗非鱼肠道肌层厚度的变化
各试验组不同肠段的肌层厚度均呈现前肠最薄,中肠次之,后肠最厚的规律。免疫组与对照组相比较,前肠肌层厚度:免疫Ⅰ组与对照组相比有增厚,但差异不显著(P>0.05),免疫Ⅱ组~Ⅳ组较对照组增加20.96%、20.09%、31.51%,差异极显著(P<0.01);中肠肌层厚度:免疫Ⅰ组与对照组相比有缩短,但差异不显著(P>0.05),免疫Ⅱ组~Ⅳ组较对照组均有增加趋势,其中免疫Ⅳ组较对照组增加17.01%,差异极显著(P<0.01);后肠肌层厚度:各免疫组较对照组均增厚,其中免疫Ⅱ组增加10.95%,差异显著(P<0.05),免疫Ⅳ组增加19.41%,差异极显著(P<0.01)(表2)。
2.3 罗非鱼肠道黏膜的形态结构观察
肠黏膜层具有环形皱襞、肠绒毛和小肠腺,黏膜上皮由柱状细胞、杯状细胞和内分泌细胞等组成[15-16]。400倍镜下观察,各组肠段肠黏膜都较完整,层次分明。肠绒毛排列整齐,肠黏膜上皮细胞形状规则,排列紧密,染色鲜明。各免疫组肠绒毛顶端稍有脱落,固有层中轴稍有增宽(图1)。
2.4 对杯状细胞分布及数量的影响
罗非鱼肠道组织经HE 染色后,显微镜下观察杯状细胞呈蓝色或空泡状。各肠段上皮均有杯状细胞分布,散在分布于柱状细胞之间,其顶部胞质因大量糖原颗粒拥塞而膨胀,底部纤细,呈高脚杯状。HE染色后,其顶部多糖成分因水解而呈现空泡状(图1)。免疫后各免疫组肠道内,呈蓝色的杯状细胞数量均比对照组有所减少,差异极显著(P<0.01)(表3)。
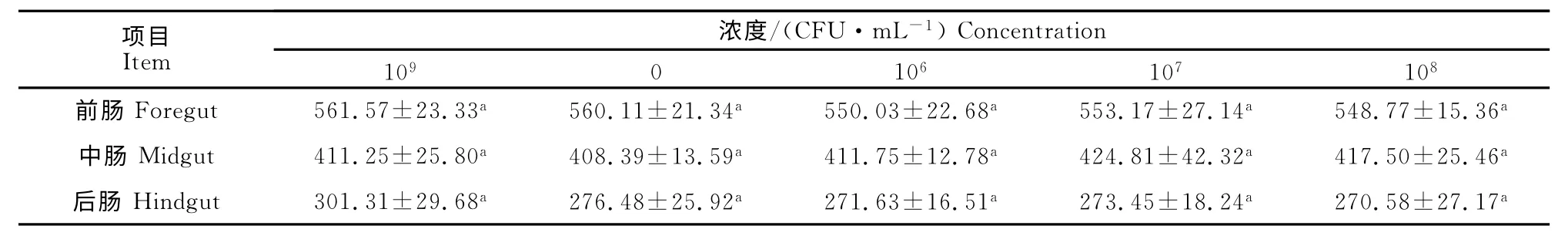
表1 罗非鱼肠绒毛长度的变化Table 1 Length changes of intertinal villi of tilapia μm
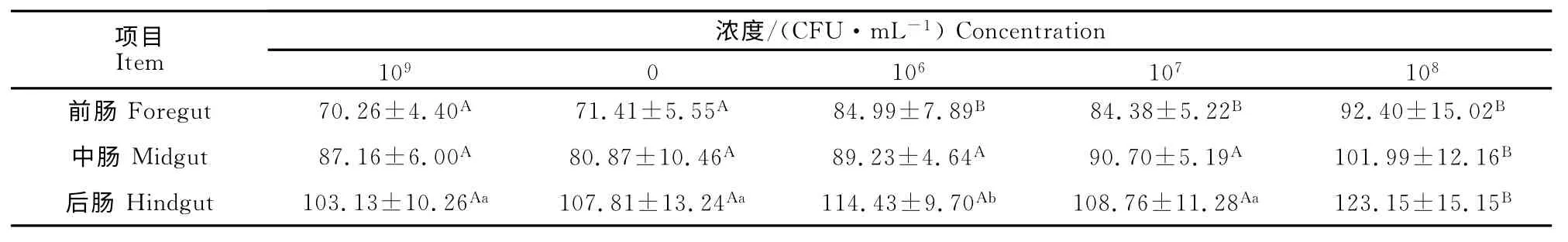
表2 罗非鱼肠肌层厚度的变化Table 2 Mucular layer thickness changes of intertinal villi of tilapia μm
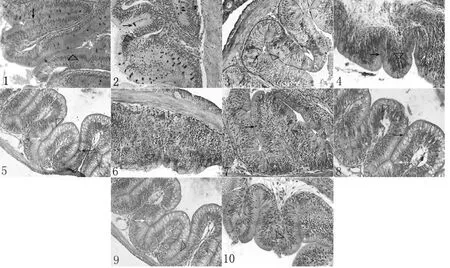
图1 对照组和免疫组罗非鱼肠绒毛形态图(400×)Fig.1 The morphology intestinal villi of tilapia in control group and immunized groups(400×)
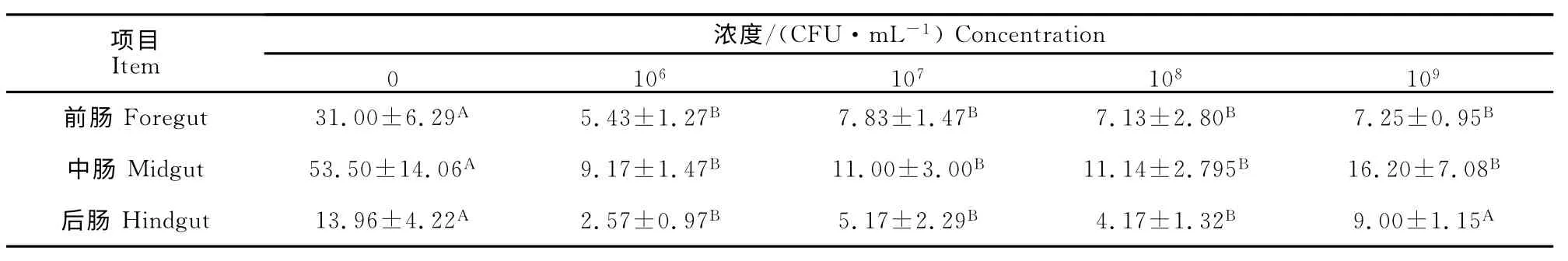
表3 罗非鱼杯状细胞数量变化Table 3 Quantity changes of goblet cells in intestine of tilapia
2.5 对上皮内淋巴细胞分布及数量的影响
对照组肠道上皮内淋巴细胞多数位于上皮细胞基膜附近,少量见于上皮游离面,各免疫组肠道上皮淋巴细胞的分布则有所不同,上皮游离面的淋巴细胞增多,而且在固有层的分布亦增多,出现聚集现象(图1)。各免疫组前肠上皮内淋巴细胞数量与对照组相比较,差异均不显著(P>0.05);免疫各组中肠上皮内淋巴细胞数量与对照组相比较均显著增加,其中免疫Ⅰ组、Ⅱ组、Ⅳ组分别比对照组增加31.97%、31.51%、42.43%,差异极显著(P<0.01),免疫Ⅲ组增加19.66%,差异显著(P<0.05);免疫各组后肠上皮内淋巴细胞数量与对照组相比较也均显著增加,其中免疫Ⅰ组(1.0×106CFU/mL)、免疫Ⅱ组(1.0×107CFU/mL)和免疫Ⅳ组(1.0×109CFU/mL)分别比对照组增加34.82%、33.21%、38.32%,差异极显著(P<0.01),免疫Ⅲ组(1.0×108CFU/mL)比对照组增加27.09%,差异显著(P<0.05)(表4)。
2.6 攻毒后的保护效果
试验Ⅰ~Ⅳ组的相对保护率分别为16.67%、27.78%、55.56%和66.67%,Ⅳ组相对保护率最高(表5)。
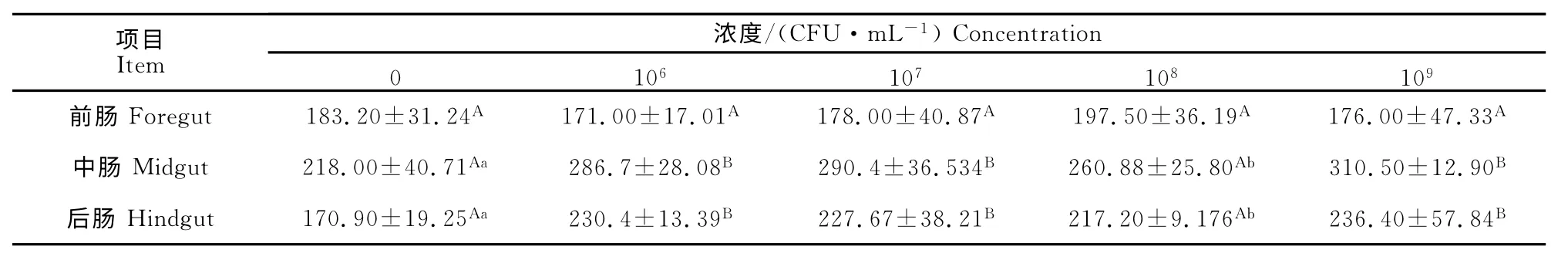
表4 罗非鱼肠道上皮内淋巴细胞数量变化Table 4 Quantity changes of intraepithelial lymphocytes of tilapia
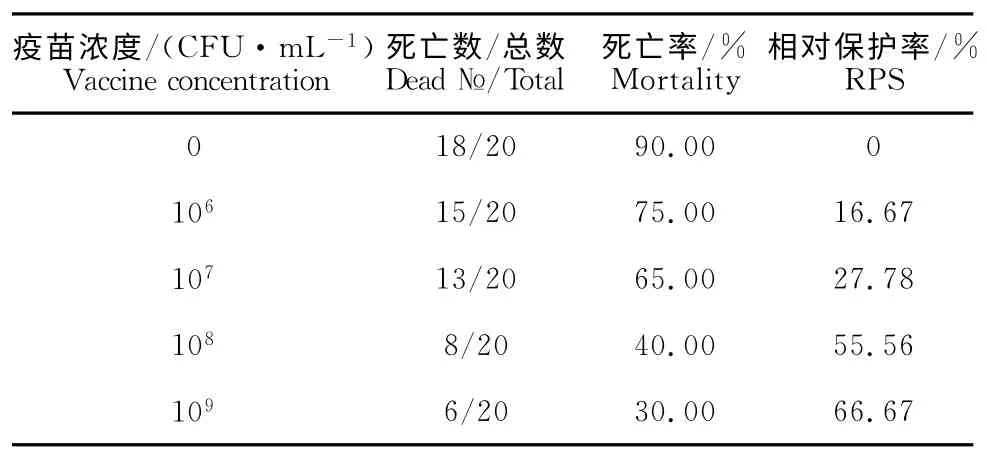
表5 免疫保护试验结果Table 5 The results of immune protection test
3 讨论
肠上皮内淋巴细胞是一群特殊的淋巴细胞,主要见于肠绒毛上皮细胞间,是机体免疫系统中与外来抗原以及微生物最先接触的免疫细胞,参与肠道黏膜免疫反应,处于免疫防御的第一线[16-17]。肠黏膜上皮与肠腔大量微生物、食物抗原接触后,可通过调节肠上皮内淋巴细胞以预防肠腔致病微生物侵袭和对无害抗原产生耐受[24]。因此,肠上皮内淋巴细胞数量的变化在一定程度上反映肠道局部黏膜免疫反应状况。黄春兰等[18]研究表明,口服免疫ISCOMs疫苗一定时间后能够刺激肠上皮内淋巴细胞增殖,且不同肠段的变化规律不同;前、中肠变化趋势相似,均表现为先下降后上升,其中免疫后14 d肠上皮内淋巴细胞与对照组相比总体呈下降趋势,21d后数量开始上升,而后肠上皮淋巴细胞在免疫后7d小幅上升后持续降低,21d后达到试验期间最低值。研究结果表明,免疫后15d,中、后肠上皮内淋巴细胞与对照组相比总体呈上升趋势,且免疫Ⅳ组1.0×109CFU/mL 效果最明显;而前肠上皮内淋巴细胞数量与对照组相比差异均不显著。表明口服疫苗后,疫苗直接进入肠道,可激活上皮内淋巴细胞。不同肠道上皮内淋巴细胞数量变化规律不同,不同浓度的疫苗免疫后产生的效果不同,免疫后15d,免疫Ⅳ组1.0×109CFU/mL 上皮内淋巴细胞数量增殖最多,效果最明显。不同肠道上皮内淋巴细胞数量变化呈现不同规律,分析原因可能是前、中、后肠的生理结构不同,从而免疫功能有所区别,但不同肠道上皮内淋巴细胞数量变化的具体规律以及对鱼体免疫功能的影响还需进一步深入研究析。
黏液细胞是黏液分泌的生理基础,它是鱼类上皮中的一种腺体细胞,广泛分布在皮肤、鳃、消化道等部位。这类细胞分泌的黏液除了具有机械性屏障、化学屏障,调节渗透压、润滑等作用外,黏液中含有的黏多糖、糖蛋白、免疫球蛋白及各种水解性酶类等非特异性的免疫活性物质,可抵抗病原微生物入侵,从而保护鱼体不受细菌、病毒等的侵害[18,20]。杯状细胞是典型的黏液细胞,主要分布于消化道和呼吸道黏膜的上皮内。正常情况下,底部狭窄形成长柄状附着于基膜上,顶部充满分泌颗粒而膨大,呈高脚杯状,经HE 染色后为蓝色或空泡状。杯状细胞是肠道黏膜免疫应答的重要成员,其数量及形态的变化在一定程度上反映肠道的局部免疫状况。本试验结果表明,各免疫组肠道内,呈蓝色的杯状细胞数量均比对照组有所减少,差异极显著(P<0.01),但呈空泡状的杯状细胞明显增多,且主要分布于肠绒毛底部或上部。表明经口服免疫后,杯状细胞呈现活跃的分泌状态,无乳链球菌弱毒苗在一定程度上能增强肠道杯状细胞的合成分泌功能。此外,良好的肠道黏膜形态结构对保持鱼类的健康及维持正常生产性能具有重要意义[21-22]。研究结果表明,各免疫组肠黏膜都较完整,但均发现肠绒毛顶端稍有脱落,固有层中轴稍有增宽的现象,表明弱毒苗免疫后,罗非鱼相关免疫反应被激活,肠道会发生轻微的炎症反应,出现肠道组织结构轻微损伤等现象。赖翔等[23]研究证明,饲粮添加苏氨酸能在一定程度上减缓PRV 弱毒苗诱导的免疫应激带来的断奶仔猪生长性能下降和肠道损伤;一些研究证明[16,24-25],黄芪多糖、低聚木糖、木聚糖酶等饲料添加剂可促进鱼的生长发育,促进受损肠黏膜细胞的修复;因此在使用无乳链球菌弱毒苗免疫时,可在饲养过程中适当配合使用饲料添加剂,以改善弱毒苗的不良影响。
组织学观察表明,无乳链球菌口服弱毒疫苗可刺激肠道上皮内淋巴细胞活化增殖,促进肠道杯状细胞的合成及分泌功能等,其中以免疫Ⅳ组1.0×109CFU/mL变化最为明显;同时攻毒感染试验结果显示,免疫组的罗非鱼因不同免疫剂量产生了不同程度的免疫保护,其中以免疫Ⅳ组1.0×109CFU/mL效果最为理想,相对保护率达到66.67%。试验结果表明,该疫苗可通过激活肠道上皮内淋巴细胞、杯状细胞的免疫功能从而产生对机体的有效保护,其中以1.0×109CFU/mL 的疫苗浓度免疫保护效果最好。
[1]邓江红,杨永弘.B组链球菌的分子生物学诊断和基因分型研究进展[J].中华儿科杂志,2005,43(11):832-835.
[2]Schuchat A.Epidemiology of group B streptococcal disease in the United States:shifting paradigms[J].Clin Microbiol Rev,1998,11(3):497-513.
[3]Trigo G,Ferreira P,Ribeiro N,et al.Identification of immunoreactive extracellular proteins ofStreptococcus agalactiaein bovine mastitis[J].Can J Microbiol,2008,54(11):899-905.
[4]Amal M N A,Zamri Saad M.Streptococcosis in tilapia(Oreochromis niloticus):a review[J].Pertanika J Tropical Agr Sci,2011,32(2):195-206.
[5]Suanyuk N,Kong F,Ko D,et al.Occurrence of rare genotypes ofStreptococcus agalactiaein cultured red tilapiaOreochromissp.and Nile tilapiaO.niloticusin Thailand-Relationship to human isolates[J].Aquaculture,2008,284:35-40.
[6]Bowater R O,Forbes Faulkner J,Anderson I G,et al.Natural outbreak ofStreptococcus agalactiae(GBS)infection in wild giant Queensland grouper,Epinephelus lanceolatus(Bloch),and other wild fish in northern Queensland[J].Aust J Fish Disea,2012,35(3):173-186.
[7]Geng Y,Wang K Y,Huang X L,et al.Streptococcus agalactiae,an emerging pathogen for cultured Ya-fish,Schizothorax prenanti,in China[J].Transb Emerg Dis,2012,59(4):369-375.
[8]Suanyuk N,Sukkasame N,Tanmark N,et al.Streptococcus iniaeinfection in cultured Asian sea bass(Lates calcarifer)and red tilapia(Oreochromissp.)in southern Thailand[J].Songklanakarin J Sci Technol,2010,32(4),341-348.
[9]Pourgholam R,Laluei F,Saeedi A A,et al.Distribution and molecular identification of some causative agents of streptococcosis isolated from farmed rainbow trout (Oncorhynchus mykiss,Walbaum)in Iran[J].Iran J Fish Sci,2011,10(1),109-122.
[10]卢迈新,黎 炯,叶 星,等.广东与海南养殖罗非鱼无乳链球菌的分离鉴定与特性分析[J].微生物学通报,2010,37(5):766-744.
[11]李 波,陈 明,李莉萍,等.广西罗非鱼链球菌病病原的生化鉴定及药敏试验[J].中国畜牧兽医,2008,35(10):93-95.
[12]黎 炯,叶 星,可小丽,等.罗非鱼无乳链球菌Sip基因的克隆、表达及免疫原性分析[J].水产生物学报,2012,36(4):626-631.
[13]陈 贺,吴灶和,王 蓓,等.无乳链球菌灭活疫苗对罗非鱼的免疫效果[J].广东海洋大学学报,2012,32(6):50-56.
[14]徐增辉,陈汉忠,陈 明,等.海豚链球菌疫苗对罗非鱼免疫功能的影晌[J].大连水产学报,2008,23(6):413-418.
[15]房慧伶,曾文宗.尼罗罗非鱼肠道的细微结构及组织化学的研究[J].广西农业大学学报,1992,11(3):121-126.
[16]黄玉章,林 旋,王全溪.黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响[J].动物营养学报,2012,22(1):108-116.
[17]吕 健.肠上皮内淋巴细胞研究进展[J].胃肠病学,2011,16(5):311-312.
[18]黄春兰,林 旋,李艳红,等.两种免疫方式对欧洲鳗鲡肠上皮内淋巴细胞和杯状细胞的影响[J].福建农业学报,2009,24(6):565-569.
[19]徐革锋,陈侠君,杜 佳.鱼类消化系统的结构、功能及消化酶的分布与特性[J].水产学杂志,2009,22(4):49-55.
[20]黄智慧,马爱军,汪 岷.鱼类体表黏液分泌功能与作用研究进展[J].海洋科学,2009,33(1):90-94.
[21]关海红,徐 伟.唇鱼骨鱼消化系统的形态学和组织学特点[J].吉林农业大学学报,2012,34(3):329-333,347.
[22]许晓娟,李加儿,区又君.鱼类消化系统研究进展[J].水产科学,2009,28(6):350-354.
[23]赖 翔,毛湘冰,余 冰,等.饲粮添加苏氨酸对伪狂犬病毒诱导的免疫应激仔猪生长性能和肠道健康的影响[J].动物营养学报,2012,24(9):1647-1655.
[24]张荣斌,曹俊明,黄燕华.低聚木糖对奥尼罗非鱼肠道形态、菌群组成和抗嗜水气单胞菌感染的影响[J].上海海洋大学学报,2112,21(2):233-240.
[25]聂国兴,王俊丽,朱命炜,等.小麦基础饲料添加木聚糖酶对尼罗罗非鱼肠道食糜粘度和绒毛、微绒毛发育的影响[J].水产学报,2007,31(1),54-61.

