化学改性甘蔗渣对固定化细胞发酵产丁醇的影响
孔祥平,贺爱永,陈佳楠,陈吴方,尹春燕,陈攀,吴昊,姜岷南京工业大学生物与制药工程学院 材料化学工程国家重点实验室, 江苏 南京 211816
化学改性甘蔗渣对固定化细胞发酵产丁醇的影响
孔祥平,贺爱永,陈佳楠,陈吴方,尹春燕,陈攀,吴昊,姜岷
南京工业大学生物与制药工程学院 材料化学工程国家重点实验室, 江苏 南京 211816
旨在研究化学改性的甘蔗渣作为固定化载体对丙酮丁醇梭菌Clostridium acetobutylicum XY16发酵制备生物丁醇的影响。首先利用不同浓度的聚乙烯亚胺 (PEI)和1 g/L戊二醛 (GA) 对甘蔗渣表面进行化学改性,增强甘蔗渣对Clostridium acetobutylicum XY16的附载能力。经4 g/L聚乙烯亚胺和1 g/L戊二醛改性的甘蔗渣 (添加量10 g/L) 应用到固定化批次发酵中,发酵36 h后丁醇和总溶剂浓度最高,分别达到了12.24 g/L和21.67 g/L,同时溶剂的生产速率达到0.60 g/(L·h),生产速率比游离细胞和未改性甘蔗渣固定化细胞分批发酵分别提高了130.8%和66.7%。在此基础上对改性甘蔗渣固定化的细胞进行6次重复批次发酵,丁醇和总溶剂的产量稳定,溶剂生产速率逐渐提高至0.83 g/(L·h),同时转化率也提高至0.42 g/g。
丁醇,甘蔗渣,聚乙烯亚胺,固定化细胞
丁醇又称正丁醇,作为一种良好的化工原料和新型液体燃料受到广泛的重视[1-5]。与传统的化学方法不同,生物丁醇主要是由梭菌通过厌氧发酵产生,该方法可有效缓解能源短缺和环境污染两大突出问题,目前已经成为研究热点[6-9]。生物法制备丁醇存在发酵周期长、生产速率低、转化率低以及产物浓度低等瓶颈,科研工作者采用了诱变育种、代谢调控、发酵与分离耦合等手段来解决上述问题,其中固定化细胞发酵技术是一种能够显著提高菌株溶剂生产速率的方法。
固定化细胞发酵技术已广泛应用于丁二酸、乳酸、丙酸的生物发酵中, Supaporn等[10]利用棉布对丙酸生产菌株进行包埋法固定,获得了71.8 g/L的丙酸,与游离细胞相比提高了37%,并且减少了乙酸等副产物的产生。Xue等[11]利用棉布和不锈钢丝构建的纤维床固定化丙酮丁醇梭菌JB200单批发酵制备丁醇,100 g/L初糖浓度时溶剂的生产速率达到了0.40 g/(L·h),当降低发酵培养基初糖浓度至80 g/L后,发酵速率提升至0.47 g/(L·h),将气提技术与发酵耦合后溶剂生产速率达到0.53 g/(L·h)。天然的固定化材料存在固定化效率低、容易脱附等缺点,对固定化载体的预处理能够有效地提高细胞固定化效率,增强细胞与载体之间的作用力,从而提高生产速率,节约生产成本[12-14]。化学改性后的载体材料表面正电荷量、表面粗糙度、活性基团数等均有所提高,能够大幅增强对细胞的吸附能力,提高固定化细胞在重复批次发酵过程中的生产效率,对固定化细胞体系长期稳定高效运行有至关重要的作用[15-16]。
本文采用聚乙烯亚胺和戊二醛对甘蔗渣进行化学改性,以增强甘蔗渣对细胞的固定效率。考察改性后甘蔗渣对丙酮丁醇梭菌Clostridium acetobutylicum XY16细胞固定效率和分批发酵产丁醇性能的影响。在利用改性甘蔗渣固定化
C. acetobutylicum XY16重复批次发酵制备丁醇的过程中,对固定化纤维床在发酵过程中的稳定性进行了考察。
1 材料与方法
1.1 材料
1.1.1 菌种
Clostridium acetobutylicum XY16为本实验自主筛获得并保藏,保藏号:CCTCC2010011。
1.2 方法
1.2.1 菌体培养方法
种子培养基 (g/L): 酵母粉 3,蛋白胨 5,可溶性淀粉 10,乙酸铵 2,NaCl 2,MgSO43,KH2PO41,K2HPO41,FeSO4·7H2O 0.1,pH 6.0,固体加琼脂20,121 ℃灭菌15 min。
发酵培养基P2 (g/L): K2HPO40.5,KH2PO40.5,乙酸铵 2.2,MgSO4·7H2O 0.2,MnSO4·H2O 0.01,NaCl 0.01,FeSO4·7H2O 0.01,玉米浆1,121 ℃灭菌15 min。
种子液培养条件: 将活化的种子液按5% (V/V)转接到装有种子培养基的100 mL血清瓶中,通N22 min。装液量视需要而定,37 ℃厌氧培养 12 h。
1.2.2 甘蔗渣表面改性方法
将甘蔗渣用粉碎机加工成0.5 cm×1 cm的小块状,甘蔗渣的添加量为10 g/L,洗净烘干后用不同浓度的聚乙烯亚胺溶液 (pH 7.0)浸泡2 h,清洗并烘干。最后使用含有1 g/L的戊二醛的磷酸盐缓冲液浸泡完成交联,清洗、烘干备用。
1.2.3 固定化细胞发酵
固定化细胞单批发酵:将改性后的甘蔗渣按10 g/L的量填充到自制的层析柱 (柱长30 cm,内径3 cm) 中构建成固定化纤维床反应器。将培养12 h的种子液按10% (V/V) 接种到2 L的自制五口烧瓶发酵装置 (装液量1.5 L) 中,通N210 min,37 ℃厌氧培养8 h后打开蠕动泵,使发酵液在用氮气除氧的改性甘蔗渣固定化纤维床中循环,实现细胞的固定化。
1.2.4 固定化细胞连续发酵
连续发酵过程中细胞固定化方法同1.2.3中所述,发酵过程中当葡萄糖浓度降至20 g/L左右时,移除发酵液并泵入新鲜的P2培养基,通N210 min之后进行重复批次发酵。
1.2.5 检测方法
菌体生物量通过测定发酵液在600 nm波长下的吸光度,用OD600来表征。葡萄糖采用SBA-40C型生物传感分析仪检测。发酵产物测定使用浙大智达N2000气相色谱仪,采用火焰离子化检测器(FID),色谱柱为石英毛细管柱,固定相是SE-30,类型为交联,以异丁醇作内标物进行定,具体的检测条件见相关文献[17]。
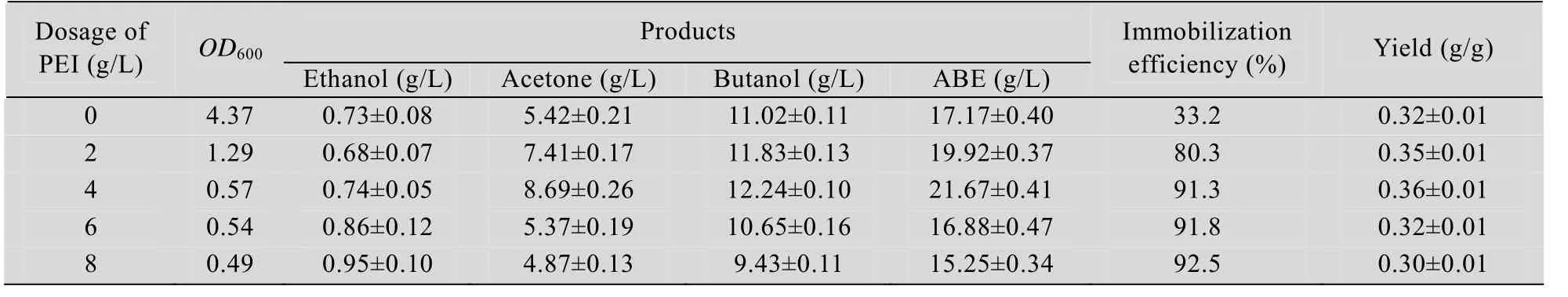
表1 不同聚乙烯亚胺改性剂量对Clostridium acetobutylicum XY16固定化效率和产溶剂性能的影响Table 1 Effects of different dosage of PEI on immobilization efficiency and solvent production
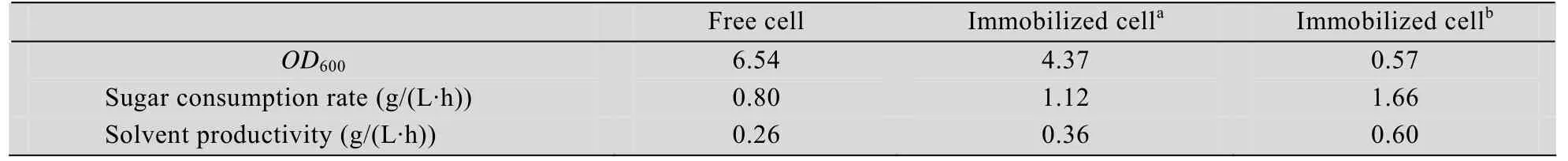
表2 化学改性对甘蔗渣固定化细胞耗糖速率和溶剂生产速率的影响Table 2 Effects of chemically modified sugarcane bagsse on glucose consumption rate and solvent productivity
2 结果与分析
2.1 表面改性剂对甘蔗渣固定化效率及丁醇发酵的影响
甘蔗渣的添加量为10 g/L (表1),不断提高改性试剂聚乙烯亚胺的浓度至4 g/L,经36 h发酵后,葡萄糖(60 g/L)消耗完全,丁醇和总溶剂分别达到12.24 g/L和21.67 g/L,相对于未改性甘蔗渣固定化细胞分批发酵,丁醇浓度提高了11%,总溶剂提高了26%。游离细胞的OD600由6.54降至0.57,固定化效率高达91.3%,通过聚乙烯亚胺改性的甘蔗渣固定化效率得到大幅提高,是未改性甘蔗渣固定化效率的2.75倍。当聚乙烯亚胺的浓度高于6 g/L,总溶剂浓度开始下降,可能由于聚乙烯亚胺与细胞膜表面上的蛋白接触,影响细胞的生长和代谢。由于戊二醛对细胞有强烈的抑制作用,实验中设定戊二醛的添加量为1 g/L。
固定化材料表面改性对耗糖速率和溶剂生产速率都有明显的促进作用 (表2)。与未改性甘蔗渣作为固定化载体的分批发酵相比,耗糖速率和溶剂生产速率分别提高了48.2%和66.7%,说明改性后的甘蔗渣上附载了大量的高活力细胞。
从图1A (改性前) 可以看出,未改性甘蔗渣表面较为平整,在高放大倍数下才能看到少量细胞吸附在甘蔗渣表面,并且呈分散分布; 而图1B (改性后) 中改性甘蔗渣表面褶皱明显,粗糙度增大,吸附了大量细胞,并且呈膜状附着在甘蔗渣表面。
2.2 化学改性甘蔗渣在重复批次发酵中的稳定性考察
利用固定化细胞重复批次发酵可以缩短发酵周期,提高生产速率和转化率。采用含有60 g/L葡萄糖的P2发酵培养基,对化学改性甘蔗渣固定化的丙酮丁醇梭菌XY16进行重复批次发酵,考察化学改性甘蔗渣固定化效果的稳定性。
如图2所示,进行了6次重复批次发酵,发酵结果表明改性后甘蔗渣对于细胞的吸附能力保持稳定。通过6次重复批次发酵,丁醇浓度能够维持在9–10 g/L,总溶剂能够维持在16 g/L左右。溶剂的生产强度达到了0.83 g/(L·h),葡萄糖转化率达到了0.42 g/g,与未改性甘蔗渣作为固定化载体的分批发酵相比,分别提高了130.6%和31.2%。
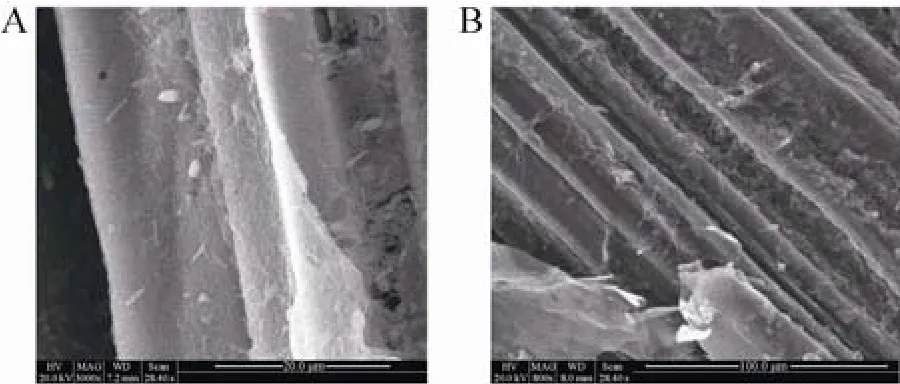
图1 改性前 (A) 和改性后 (B) 甘蔗渣载体固定化细胞电镜图Fig. 1 Scanning electron micrograph of C. acetobutylicum XY16 immobilized by unmodified (A) and modified (B) sugarcane bagasse.
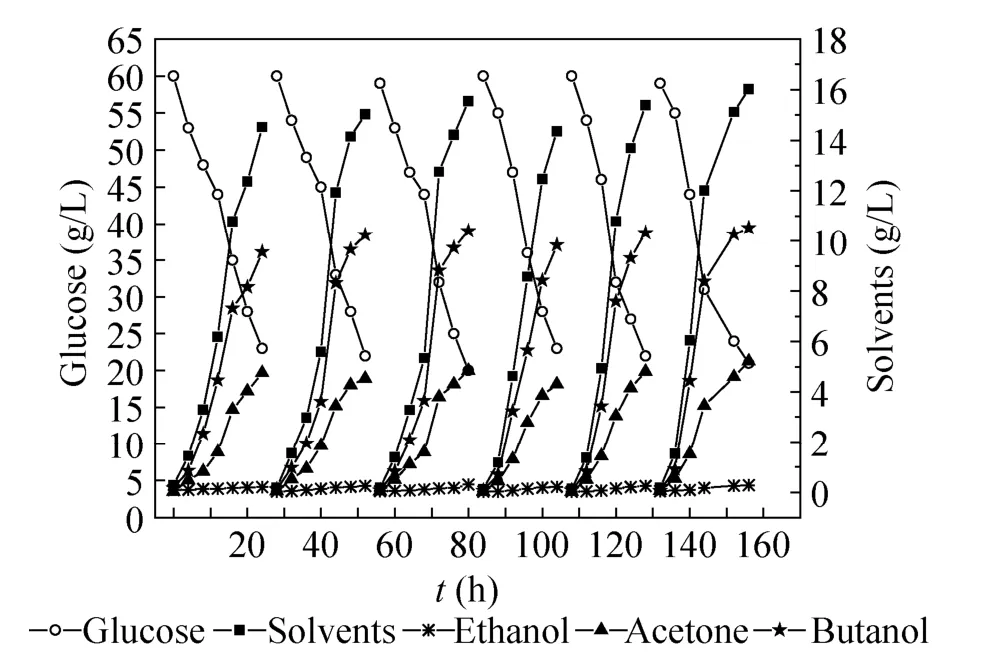
图2 固定化细胞重复批次发酵考察化学改性甘蔗渣的稳定性Fig. 2 Stability of chemically modified sugarcane bagasse in repeat-batch fermentation.
3 结论
利用Clostridium acetobutylicum XY16游离细胞发酵制备丁醇,66 h后发酵结束,消耗53 g/L葡萄糖,丁醇浓度为11.05 g/L,总溶剂为17.16 g/L。游离细胞单批发酵过程发酵周期长、生产速率和转化率低。采用甘蔗渣作为固定化载体进行固定化细胞单批发酵产丁醇,发酵周期缩短为48 h,消耗54 g/L的葡萄糖,同时丁醇和总溶剂浓度分别达到了11.02 g/L和17.17 g/L。采用不同浓度的聚乙烯亚胺对甘蔗渣进行化学改性,考察改性后甘蔗渣作为固定化载体对Clostridium acetobutylicum XY16分批发酵产丁醇的影响。当聚乙烯亚胺浓度为4 g/L时,发酵周期缩短至36 h,丁醇和总溶剂达到最高,分别为12.24 g/L和21.67 g/L,同时细胞固定化效率高达91.3%,是未改性甘蔗渣固定化效率的2.75倍。在改性甘蔗渣固定化细胞分批发酵中,耗糖速率和溶剂生产速率得到明显提高,与未改性甘蔗渣固定化发酵相比分别提高了48.2%和66.7%。
以改性甘蔗渣作为固定化载体进行重复批次发酵,发酵周期缩短至24 h,重复批次发酵后期进一步缩短至20 h,丁醇和总溶剂浓度分别稳定在10 g/L和16 g/L左右。重复批次发酵过程中溶剂的生产速率达到了0.83 g/(L·h), 由于菌体的重复利用和对残糖的控制,葡萄糖转化率提高至0.42 g/g,与未改性甘蔗渣作为固定化载体的分批发酵相比,分别提高了130.6%和31.2%。重复批次发酵过程中转化率的提高可能与高活力细胞的循环使用以及丙酮丁醇梭菌具有较低的木质纤维素降解能力有关[18-22]。由此可见,化学改性甘蔗渣能够增强对细胞的吸附效率和提高菌体产溶剂性能,作为固定化载体能够使固定化细胞发酵长期高效的稳定运行。
REFERENCES
[1] Guo T, Tang Y, Zhang QJ, et al. Clostridium beijerinckii mutant with high inhibitor tolerance obtained by low-energy ion implantation. J Ind Microbiol Biotechnol, 2012, 39(3): 401–407.
[2] Liu Y, Liu HJ, Zhang JA, et al. Research progress in new biofuel butanol. Mod Chem Ind, 2008, 28(6): 28–33 (in Chinese).刘娅, 刘宏娟, 张建安, 等.新型生物燃料: 丁醇的研究进展. 现代化工, 2008, 28(6): 28–33.
[3] Lee SY, Park JH, Jang SH, et al. Fermentative butanol production by Clostria. Biotechnol Bioeng, 2008, 101(2): 209–228.
[4] Dürre P. Biobutanol: an attractive biofuel. Biotechnol J, 2007, 2(12): 1525–1534.
[5] García, V, Päkkilä J, Ojamo H, et al. Challenges in biobutanol production: how to improve the efficiency? Renew Sust Energ Rev, 2011, 15(2): 964–980.
[6] Sun YP, Jin YL, Gao XF, et al. Effects of byproducts from acid hydrolysis of lignocellulose on butanol fermentation by Clostridium acetobutylicum CICC8012. Chin J Appl Environ Biol, 2010, 16(6): 845–850 (in Chinese).孙彦平, 靳艳玲, 郜晓峰, 等. 纤维素酸解副产物对Clostridium acetobutylicum CICC8012 发酵的影响. 应用与环境生物学报, 2010, 16(6): 845–850.
[7] Jin XQ, Wang GL, He BF. Research progress and high yield strategy of acetone-butanol fermentation. Chem Ind Eng Process, 2007, 26(12): 1727–1732 (in Chinese).靳孝庆, 王桂兰, 何冰芳. 丙酮丁醇发酵的研究进展及其高产策. 化工进展, 2007, 26(12): 1727–1732.
[8] Jones DT, Woods DR. Acetone-butanol fermentation revisited. Microbiol Rev, 1986, 50(4): 484–524.
[9] Chiao J, Sun ZH. History of the acetone-butanol-ethanol fermentation industry in China: development of continuous production technology. J Mol Microbiol Biotechnol, 2007, 13: 12–14.
[10] Supaporn S, Yang ST. Enhanced propionic acid fermentation by Propionibacterium acidipropionici mutant obtained by adaptation in a fibrous-bed bioreactor. Biotechnol Bioeng, 2005, 91(3): 325–337.
[11] Xue C, Bai FW. High-titer n-butanol production by Clostridium acetobutylicum JB200 in Fed-Batch fermentation with intermittent gas stripping. Biotechnol Bioeng, 2012, 109(11): 2746–2756.
[12] Kim DN, Park J, Koh WG. Control of cell adhesion on poly (ethyleneglycol) hydrogel surface using photochemical modification and micropatterning technique. J Ind Eng Chem, 2009, 15(1): 124–128.
[13] Kawaguti HY, Buzzano MF, Orsi DC, et al. Effect of the additive polyethylenimine and glutaraldehyde on the immobilization of Erwinia sp. D12 cells in calcium alginate for isomaltulose production. Process Biochem, 2006, 41(9): 2035–2040.
[14] Kamath N, D-Souza SF. Immobilization of ureolytic cells through flocculation and adhesion on cotton cloth using polyethylenimine. Enzyme Microb Technol, 1991, 13(11): 935–938.
[15] Rochex A, Lecouturier D, Pezron I, et al. Adhesion of a Pseudomonas putida strain isolated from a paper machine to cellulose fibres. Appl Microbiol biotechnol, 2004, 65(6): 727–733.
[16] Briandet R, Meylheuc T, Maher C, et al. Listeria monocytogenes Scott A: Cell sufface charge, hydrophobicity, and electron donor and acceptor characteristics under different environmental growth condition. Appl Environ Biotechnol, 1999, 65(12): 5328–5333.
[17] Guo T, Tang Y, Xi YL, et al. Clostridium beijerinckiic mutant obtained by atmosperic pressure glow discharge producing high proportions. Biotechnol Lett, 2011, 33(12): 2379–2383.
[18] Afschar AS, Biebl H, Schaller K, et al. Production of acetone and butanol by Clostridium acetobutylicum in continuous culture with cell recycle. Appl Microbiol Biotechnol, 1985, 22(6): 394–398.
[19] Detlef S, Gerhard G. Effect of cell recycle on continuous butanol-acetone fermentation with Clostridium acetobutylicum under phosphate limitation. Appl Microbiol Biotechnol, 1986, 24(1): 1–5.
[20] Ni Y, Sun ZH. Recent progress on industrial fermentative production of acetone-butanol-ethanol by Clostridium acetobutylicum in China. Appl Microbiol Biotechnol, 2009, 83(3): 415–423.
[21] Weber C, Farwick A, Benisch F. Trends and challenges in the microbial production of lignocellulosic bioalcohol fuels. Appl Microbiol Biotechnol, 2010, 87(4): 1303–1315.
[22] Kumar R, Singh S, Singh O. Bioconversion of lignocellulosic biomass: biochemical and molecular perspectives. J Ind Microbiol Biotechnol, 2008, 35(5): 377–391.
(本文责编 郝丽芳)
Effects of chemically modified sugarcane bagasse on butanol production by immobilized Clostridium acetobutylicum XY16
Xiangping Kong, Aiyong He, Jianan Chen, Wufang Chen, Chunyan Yin, Pan Chen, Hao Wu, and Min Jiang
State Key Laboratory of Materials-Oriented Chemical Engineering, College of Biotechnology and Pharmaceutical Engineering, Nanjing University of Technology, Nanjing 211816, Jiangsu, China
Sugarcane bagasse modified by polyethylenimine (PEI) and glutaraldehyde (GA) was used as a carrier to immobilize Clostridium acetobutylicum XY16 in the process of butanol production. The effects of chemically modified sugarcane bagasse on batch and repeat-batch fermentations were investigated. Batch fermentation was conducted with anaddition of 10 g/L modified sugarcane bagasse and 60 g/L glucose, resulting in a high solvent concentration of 21.67 g/L and productivity of 0.60 g/(L·h) with the treatment of 4 g/L PEI and 1 g/L GA. Compared to the fermentations by free cells and immobilized cells on unmodified sugarcane bagasse, the productivity increased 130.8% and 66.7%, respectively. The fibrous-bed bioreactor also maintained a stable butanol production during repeat-batch fermentations, achieving a maximum productivity of 0.83 g/(L·h) with a high yield of 0.42 g/g.
butanol, sugarcane bagasse, polyethylenimine, immobilized cell
May 3, 2013; Accepted: September, 2013
Min Jiang. Tel/Fax: +86-25-58139937; E-mail: jiangmin@njtech.edu.cn Hao Wu. Tel/Fax: +86-25-58139937; E-mail: wuhao@njtech.edu.cn
孔祥平, 贺爱永, 陈佳楠, 等. 化学改性甘蔗渣对固定化细胞发酵产丁醇的影响. 生物工程学报, 2014, 30(2): 305-309.
Kong XP, He AY, Chen JN, et al. Effects of chemically modified sugarcane bagasse on butanol production by immobilized Clostridium acetobutylicum XY16. Chin J Biotech, 2014, 30(2): 305-309.
Supported by: National Basic Research Program of China (973 Program) (No. 2011CB707405), National Natural Science Foundation of China (No. 21106067), Commonweal Research of CAF (No. 201004001), Key University Science Research Project of Jiangsu Province (No. 11KJA530001).
国家重点基础研究计划 (973计划) (No. 2011CB707405),国家自然科学基金 (No. 21106067),林业公益性专项基金 (No. 201004001),江苏省高校自然科学研究重大项目 (No. 11KJA530001) 资助。

