结核分枝杆菌Rv2628蛋白的免疫生物学特性
殷月兰,高云飞,赵丹,连凯,陈祥,徐正中,潘志明,焦新安扬州大学江苏省人兽共患病学重点实验室 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009
医学与免疫生物技术
结核分枝杆菌Rv2628蛋白的免疫生物学特性
殷月兰*,高云飞*,赵丹,连凯,陈祥,徐正中,潘志明,焦新安
扬州大学江苏省人兽共患病学重点实验室 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009
Rv2628蛋白是结核分枝杆菌Mycobacterium tuberculosis (M. tb) DosR调控的潜伏感染相关抗原。本研究对Rv2628蛋白进行了原核表达和纯化,并以巨噬细胞系和小鼠为研究模型,对其免疫生物学特性进行了分析。SDS-PAGE及Western blotting鉴定结果表明,Rv2628-His融合蛋白以包涵体形式表达,能与兔抗H37Rv多抗血清发生特异性反应,具有较好的免疫反应性。与巨噬细胞系RAW264.7的互作实验结果表明,在1–12 h内Rv2628蛋白能诱导前炎性因子IL-6的上调表达。将纯化的Rv2628融合蛋白皮下免疫BALB/c小鼠,夹心ELISA的测定结果表明,Rv2628蛋白免疫组诱导产生的特异性IFN-γ水平显著高于IL-4的水平 (P<0.000 1),呈现Th1型细胞免疫应答趋势;以Rv262811-30多肽作为包被抗原,通过间接ELISA测定的血清抗体效价能达到1∶1 600,表明Rv2628也能诱导体液免疫应答。总之,Rv2628能促进巨噬细胞炎症反应的发生,激发小鼠产生强烈的Th1型细胞免疫应答和较好的体液免疫应答,具有作为亚单位疫苗的潜力,为M. tb与宿主之间的相互作用奠定了一定的理论基础。
结核分枝杆菌,Rv2628,Th1型应答,前炎性因子,巨噬细胞系
结核病 (Tuberculosis,TB) 是由结核分枝杆菌复合物(Mycobacterium tuberculosis complex, MTBC)引起的一类慢性传染性疾病[1],结核分枝杆菌是结核分枝杆菌复合群中的主要病原菌。结核病的发生、发展进程主要是由M. tb与人体免疫系统之间的相互作用所决定的。当M. tb逃避人体的免疫攻击之后,可在体内持续感染或呈潜伏性感染 (Latent tuberculosis infection, LTBI),肺部的肉芽肿组织是M. tb的主要藏身之处,但肉芽肿内是一个低氧、缺乏营养、低pH值等不利于M. tb生长的微环境,M. tb通过调整代谢活动进入休眠期,达到在宿主体内长期生存的目的[2-4]。最近的研究发现,M. tb对氧浓度改变的适应主要是由激活体内的组分调控系统,包括两种感受激酶 (DosT与DosS)以及反应调节子DosR构成的DosS/DosT-DosR调控复合物介导的[5-7],其中DosR调控系统共调控50个基因的表达,在下调M. tb的新陈代谢过程中发挥重要作用[8-9]。Rv2628是受DosR调控的潜伏感染相关抗原,Klein等研究发现Rv2628能诱导TST+患者产生较强的IFN-γ反应[10]。但是目前对其生物学功能还知之甚少。为此,我们选取了DosR调控基因Rv2628,进行原核表达和纯化,并对其免疫学特性作了初步分析,为进一步研究该蛋白的功能特性奠定了基础。
1 材料与方法

表1 本研究所用引物Table 1 Primers used in this study
1.1 材料
1.1.1 菌株和细胞系
卡介苗BCG、宿主菌E. coli BL21(DE3)、E. coli BL21(DE3)-pET-32a(+)以及巨噬细胞系RAW264.7均由本室保存。
1.1.2 实验动物
6周龄雌性BALB/c小鼠,购自扬州大学比较医学中心。
1.1.3 主要试剂
灭活的结核分枝杆菌H37Rv及兔抗该菌的多抗血清由中国疾控预防控制中心的万康林研究员馈赠;Ni-NTA His Bind purification kit购自Novagen公司;用Ni-NTA His Bind purification kit纯化的BL21(DE3)-pET-32a(+)空载体蛋白及鼠抗该蛋白的多抗血清由本室制备和保存;去内毒素试剂盒购自Norgen公司; Anti-His antibody 购自Roche公司;Purified Rat Anti Mouse IFN-γ、Biotin Rat Anti Mouse IFN-γ、Recombinant Mouse IFN-γ、Purified Rat Anti Mouse IL-4、Biotin Rat Anti Mouse IL-4、Recombinant Mouse IL-4、链亲和素-HRP均购自BD公司;Bovine PPD 购自PrionicsAG公司;TMB购自eBioscience公司;BCIP/NBT、羊抗鼠IgG-HRP均购自Sigma公司;PVDF底96孔ELISPOT板购自Millipore公司;PrimeScriptTMRT reagent kit试剂盒、SYBR Premix Ex TaqTMⅡ试剂盒购自TaKaRa公司;双十八烷基二甲基溴化铵 (DDA)、单磷脂酸A (MPL-A) 购自Avanti公司;Rv262811-30多肽由北京中科亚光生物科技有限公司合成;其余常规试剂均购自沪通国药试剂公司。
1.1.4 主要仪器设备
Biophotometer分光光度仪购自德国Eppendorf公司;细胞计数仪、流式细胞仪FACS Aria购自BD公司;ELISPOT读板仪BIOREADER 5000-Vβ购自Bio-Rad公司;酶标仪TECAN5082购自TECAN公司;7500型实时荧光定量PCR仪购自ABI公司。
1.1.5 引物
扩增Rv2628基因所用引物由南京金斯瑞生物工程有限公司合成,荧光定量PCR引物由大连宝生物工程有限公司合成,引物序列见表1。
1.2 方法
1.2.1 目的基因的扩增
根据GenBank上公布的M. tb 标准株H37Rv的Rv2628基因序列 (ID: 888566),使用Primer Premier 5.0软件分别设计扩增引物,PCR扩增条件:94 ℃ 5 min;94 ℃ 50 s,61 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。
1.2.2 原核表达载体的构建与鉴定
将纯化的PCR产物以KpnⅠ/Hind Ⅲ于37 ℃双酶切4 h,进行1%的琼脂糖凝胶电泳。对目的DNA片段进行纯化回收,原核表达载体pET-32a(+)经同样方法处理,通过连接后转化至大肠杆菌DH5α感受态细胞,对长出的菌落通过PCR与双酶切进行鉴定,并送南京金斯瑞公司进行测序。将测序正确的阳性重组质粒通过热击法转化至表达宿主菌BL21(DE3)感受态细胞中,对鉴定后正确的重组菌命名为BL21(DE3)-pET-32a(+)-Rv2628。
1.2.3 融合蛋白的诱导表达
将构建好的细菌BL21(DE3)-pET-32a(+)-Rv2628及对照菌BL21(DE3)-pET-32a(+)进行诱导表达,IPTG诱导浓度为0.4 mmol/L,30 ℃诱导6 h。诱导产物经12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。
1.2.4 融合蛋白的纯化和鉴定
将以包涵体形式表达的Rv2628蛋白,按照Novagen公司的Ni-NTA His Bind purification kit说明书进行纯化,并对纯化蛋白进行透析去盐处理。将重组蛋白、pET-32a空载体蛋白进行12%的SDS-PAGE,并电转移至硝酸纤维膜上,以兔抗H37Rv多抗血清为一抗,辣根过氧化物酶标记的羊抗鼠IgG的抗体为二抗,以DAB显色,进行蛋白印迹分析。
1.2.5 融合蛋白与细胞表面结合测定
取6 μg纯化的融合蛋白Rv2628、pET-32a空载体蛋白及DMEM培养基分别与小鼠巨噬细胞系RAW264.7于冰上孵育15 min后,1 000 r/min离心10 min,去除上清。洗涤后分别加入1∶200稀释的Rv2628多抗血清、空载体蛋白免疫的血清,4 ℃孵育1 h。每组样品加入1 μL羊抗鼠IgG-FITC,4 ℃孵育40 min。洗涤后,用200 μL含1% BSA的PBS重悬,以流式细胞仪检测融合蛋白与细胞表面的结合。
1.2.6 前炎性因子mRNA相对表达量测定
将纯化的蛋白去除内毒素,具体操作参照Norgen去内毒素试剂盒的说明书。将透析后的蛋白用碧云天BCA蛋白浓度测定试剂盒进行浓度测定。将6孔细胞板中的RAW264.7细胞更换新鲜培养基后,分别加入6 μg的融合蛋白Rv2628、pET-32a空载体蛋白及不加蛋白的对照组进行刺激。于互作后的1、12、24、48 h,以Trizol裂解液收集细胞,提取总RNA,并对提取的总RNA进行DNA的去除。反转录后作为荧光定量PCR试验模板,进行荧光定量PCR。
1.2.7 动物免疫试验
免疫样品的制备和免疫:15只6周龄BALB/c小鼠随机分为3组,每组5只,分别为蛋白免疫组、BCG阳性对照组以及PBS阴性对照组。将25 μg Rv2628融合蛋白重悬于50 μL PBS中,与150 μL的DDA佐剂 (250 μg/mL) 及50 μL的MPL佐剂 (25 μg/mL) 充分乳化混合。取乳化充分的Rv2628蛋白按25 μg/只,皮下注射免疫;BCG按100 μL/只 (1×106CFU),皮下注射免疫;阴性对照组以PBS-DDA/MPL按200 μL/只,皮下注射免疫。第1次免疫2周后,以同样的剂量与方式进行第2次免疫。
夹心ELISA试验检测特异性IFN-γ和IL-4分泌水平:于二次免疫后的第7天,制备小鼠脾脏淋巴细胞,加入到分别包被抗小鼠INF-γ单抗及抗小鼠IL-4单抗的ELISPOT板中,并向孔中分别加入50 µL 终浓度为10 µg/mL 的Rv262811-30、Rv2628和PPD作为刺激原,培养48 h。洗涤后加入生物素化抗小鼠INF-γ、IL-4单抗,作用3 h。加入链亲和素-AKP加入孔中,作用3 h后显色,再加入BCIP/NBT底物液显色,拍干,观察计数。将孔置于立体显微镜下观察,计数每个孔中的蓝斑数。
间接ELISA检测血清中特异性抗体水平:将Rv262811-30多肽用包被液稀释为10 μg/mL,100 μL/孔,4 ℃过夜;次日封闭后,取上述制备的小鼠特异性多抗血清以及阴性血清,以含1% BSA的PBS从1∶100开始作系列倍比稀释,100 μL/孔,37 ℃静置孵育3 h;加入羊抗鼠IgG-HRP抗体,100 μL/孔,37 ℃静置孵育1 h;以80 μL/孔加入TMB显色底物,2 mol/L H2SO4终止反应,以酶标仪读取OD450数值。

图1 Rv2628基因的PCR扩增及pET-32a(+)-Rv2628(b)的鉴定结果Fig. 1 PCR amplification of Rv2628 gene and identification of pET-32a(+)-Rv2628. (A) PCR amplification of Rv2628 gene. (B) Identification of recombinant plasmid by KpnⅠ/Hind Ⅲ. M: DL2000 DNA marker; 1: PCR products of Rv2628 gene; 2: pET-32a(+)-Rv2628 digested with KpnⅠ/Hind Ⅲ; 3: pET-32a(+) digested with KpnⅠ/Hind Ⅲ.
2 结果
2.1 Rv628重组质粒的构建
以H37Rv基因组为模板扩增Rv2628基因,由图1A可以看出,Rv2628基因在相应位置均出现特异性的目的条带,说明该基因扩增成功。将阳性克隆质粒pET-32a(+)-Rv2628双酶切后的回收片段与表达载体连接,进行双酶切鉴定,由图1B可以看出,在相应位置均有载体条带与目的条带出现,说明Rv2628基因与表达载体连接成功。
2.2 Rv2628蛋白的诱导表达及纯化
用Lasergene protean软件分析结果表明,Rv2628是一个等电点为9.01、分子量为13.130 kDa的蛋白,而标签蛋白His-tag、S-tag和Trx-tag的分子量为16.93 kDa,故预期融合蛋白分子量为30 kDa。而经IPTG诱导后的重组菌BL21(DE3)-pET30a- Rv2628 进行的SDS-PAGE结果显示,与空载体菌相比,重组菌的诱导产物在约30 kDa位置出现明显的蛋白条带,表明重组蛋白成功表达 (图2A)。进一步分析发现,Rv2628蛋白主要以包涵体的形式存在。以His标签蛋白纯化试剂盒获得纯化的重组蛋白 (图2B),经BCA蛋白浓度测定试剂盒测定其浓度为2.5 mg/mL。
2.3 Rv2628蛋白的Western blotting鉴定
将融合蛋白Rv2628与兔抗H37Rv血清反应,在30 kDa处有一条特异性条带,而空载体菌则未见明显特异性条带(图3),说明原核表达的Rv2628融合蛋白具有较好的免疫反应性。
2.4 Rv2628蛋白与细胞结合能力分析
对Rv2628蛋白与巨噬细胞的结合能力测定结果表明,Rv2628蛋白+Rv2628多抗组与其余对照组相比,没有显著性的差异 (P>0.05) (图4),表明Rv2628蛋白显示未能明显与巨噬细胞结合。
2.5 前炎性因子mRNA相对表达量的测定
对3种前炎性因子mRNA的相对表达量测定结果显示,Rv2628诱导IL-6 mRNA的相对表达量与对照组相比,在1 h最高,比对照组高20倍(P<0.05)。随着时间的延长,逐渐下降 (图5A)。由以上结果可知,Rv2628能有效地诱导前炎性因子IL-6的产生。
2.6 夹心ELISA测定结果
各免疫组细胞上清中细胞因子的含量如图6所示,以Rv2628蛋白刺激各免疫组的脾脏淋巴细胞时,Rv2628免疫组的IFN-γ和IL-4的含量与阴性对照组的相比,有显著性差异 (* P<0.05);以Rv262811-30多肽刺激的各免疫组中,Rv2628免疫组的IFN-γ水平与阴性对照组相比,有极显著性差异 (** P<0.01),IL-4的水平有显著性差异 (* P<0.05);并且IFN-γ水平要显著高于IL-4的水平 (*** P<0.000 1)。以上结果说明Rv2628能够诱导强烈的Th1型细胞免疫应答。从图6还可看出,PPD不能有效地诱导Rv2628蛋白免疫组产生IFN-γ与IL-4。

图2 Rv2628蛋白的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of Rv2628 protein. (A) Supernatants and sediments of lysate of recombinant E. coli. (B) Rv2628-His after purification. M: protein marker; 1: BL21(DE3)-pET32a indued by IPTG; 2: supernatants of lysate of BL21(DE3)-pET32a(+)-Rv2628 induced by IPTG; 3: sediments of lysate of BL21(DE3)-pET-32a(+)-Rv2628 induced by IPTG; 4: Rv2628-His purified by Ni-NTA His Bind purification kit.
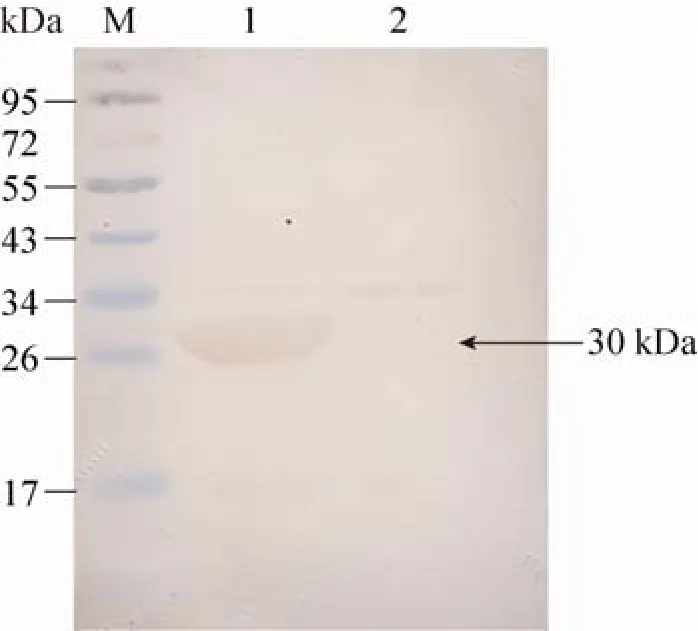
图3 Rv2628蛋白的Western blotting分析Fig. 3 Western blotting analysis of Rv2628 protein. M: protein marker; 1: fusion protein of Rv2628; 2: BL21(DE3)-pET32a indued by IPTG.
2.7 间接ELISA测定结果
以Rv262811-30多肽包板,通过间接ELISA测定了蛋白免疫组的血清中Rv2628抗体水平。结果如图7所示,蛋白免疫组的血清抗体效价为1∶1 600,说明Rv2628蛋白能诱导体液免疫应答。

图4 FACS检测Rv2628蛋白与巨噬细胞的结合活性Fig. 4 FACS analysis of Rv2628 protein binding activity with RAW264.7. (A) The labeled positive cells detected by FACS. (B) Percentage of positive cells.*Polyclonal antibody against Ag85A.
3 讨论
结核病是目前全世界共同面临的主要公共卫生问题,M. tb是导致人类TB的最主要的病原菌,其在长期进化过程中,掌握了多种狡黠的机制来逃避宿主免疫系统的监控和清除,得以在宿主体内存活[11-13]。当M. tb在宿主体内面临缺乏营养、低氧等不利条件时,激活DosS/DosTDosR调控系统,下调其代谢活动、进入休眠期,宿主则处于潜伏感染状态[14],LTBI是TB复发的主要来源,是结核不能被彻底清除的原因之一[15]。DosR调控系统的激活是M. tb进入休眠期的必需途径[4-5],目前对DosR所调控的大部分蛋白的功能还知之甚少,弄清它们在LTBI时期诱导机体免疫应答规律,对于阐明潜伏感染的机制、诊断抗原的筛选、药物靶标的选择以及疫苗的开发具有深远意义。

图5 Rv2628蛋白刺激下细胞中前炎性子mRNA的相对表达量Fig. 5 Relative expression of the proinflammatory cytokine mRNAs after stimulation with Rv2628 protein. (A)IL-6. (B) IL-1β. (C) TNF-α.
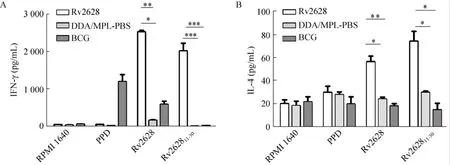
图6 不同免疫组脾脏淋巴细胞分泌IFN-γ和IL-4的水平Fig. 6 Levels of secreting IFN-γ and IL-4 in the spleen cells. (A) The concentration of IFN-γ. (B) The concentration of IL-4. *P<0.05, **P<0.01, ***P<0.001.
Rv2628蛋白是受DosR调控的蛋白之一,在功能分类上被列为一种假定蛋白,对其免疫功能特性的报道很少[16-18]。我们通过生物信息学的手段,对Rv2628与其他M. tb蛋白的互作预测结果显示,该蛋白只与DosR调控的16个蛋白之间具有互作关系,提示该蛋白在M. tb潜伏感染过程中发挥重要作用。另外,我们利用网站的VaxiPred软件对Rv2628蛋白进行表位预测,结果显示该蛋白富含B细胞、CTL表位及T细胞表位,其中第11–30位氨基酸既是B细胞表位,也是T细胞表位。因此我们选取Rv2628基因进行了原核表达及免疫功能特性的研究。在以大肠杆菌作为原核表达系统表达Rv2628的过程中,虽然先后尝试了多种表达载体和诱导条件的优化,但仅获得以包涵体形式表达的Rv2628蛋白。在未获得可溶性表达的情况下,对包涵体蛋白进行了变复性,通过Western blotting结果得知,包涵体蛋白仍具有较好的免疫生物学活性。Rv2628蛋白的原核表达,为进一步研究蛋白的免疫学特性以及功能特性奠定了基础。
M. tb在感染宿主后,机体会激活保护性免疫应答,阻止其进一步发展为活动性结核。肺部巨噬细胞是宿主抵抗外来细菌入侵的第一道防线[19-21],在对抗病原菌免疫反应的早期起到了至关重要的作用。本研究中Rv2628蛋白与小鼠巨噬细胞系的相互作用结果显示,Rv2628蛋白不具有与细胞膜结合活性,但能有效地刺激IL-6的上调表达。该细胞因子具有促进炎症反应的特性;此外,IL-6还能促进T细胞等多种细胞增殖及CTL等多种细胞分化的功能[22]。由此推断Rv2628能促进炎症反应的发生,在先天性免疫应答中发挥作用。另此,还能促进细胞免疫应答的发生,从而达到控制M. tb的早期感染的目的。
M. tb为胞内寄生菌,一般认为以CD4+T细胞产生IFN-γ为特征的Th1型免疫应答,在控制M. tb感染过程中起到了重要作用[23-24]。本研究中将Rv2628蛋白皮下初次免疫和加强免疫小鼠后,能够有效诱导脾脏淋巴细胞产生Rv2628特异性的IFN-γ,并且显著高于诱导产生的IL-4水平,呈现显著的Th1型免疫应答趋势。另外,本实验中Rv2628蛋白及Rv262811-30多肽均不能有效地诱导BCG免疫组产生IFN-γ与IL-4。这与Lin等的报道相一致,他们研究发现,无论是将BCG接种受试儿童或者是免疫BALB/c小鼠,均不能有效地诱导机体产生Rv2628等潜伏感染相关抗原的特异性免疫反应[25]。上述实验结果表明,Rv2628蛋白显示了良好的预防性结核病疫苗潜能。
综上所述,Rv2628 蛋白能促进前炎性因子的产生,从而对M. tb起到杀伤作用,抑制M. tb的早期感染。而Rv2628在获得性免疫方面,显示了较明显的Th1型细胞免疫应答。以上结果为阐明Rv2628蛋白的功能以及M. tb与宿主之间的相互作用奠定了一定的理论基础。

图7 不同免疫组血清中Rv2628抗体水平Fig. 7 Serum antibodies against Rv2628 in different groups.
REFERENCES
[1] Barry CE, Boshoff HI, Dartois V, et al. The spectrum of latent tuberculosis: rethinking the biology and intervention strategies. Nat Rev Microbiol, 2009, 7(12): 845–855.
[2] Reece ST, Kaufmann SHE. Floating between the poles of pathology and protection: can we pin down the granuloma in tuberculosis. Curr Opin Microbiol, 2011, 15: 63–70.
[3] Kapoor N, Pawar S, Sirakova TD, et al. Human granuloma in vitro model, for TB dormancy and resuscitation. PLoS ONE, 2013, 8(1): e53657.
[4] Boon C, Dick T. How Mycobacterium tuberculosis goes to sleep: the dormancy survival regulator DosR a decade later. Future Microbiol, 2012, 7(4): 513–518.
[5] Voskuil MI. Mycobacterium tuberculosis gene expression during environmental conditions associated with latency. Tuberculosis (Edinb), 2004, 84(3/4): 138–143.
[6] Park HD, Guinn KM, Tompa M, et al. Rv3133c/dosR is a transcription factor that mediates the hypoxic response of Mycobacterium tuberculosis. Mol Microbiol, 2003, 48(3): 833–843.
[7] Kendall SL, Movahedzadeh F, Duncan K, et al. The Mycobacterium tuberculosis dosR/S two-component system is induced by multiple stresses. Tuberculosis (Edinb), 2004, 84(3/4): 247–255.
[8] Hu YM, Movahedzadeh F, Stoker NG, et al. Deletion of the Mycobacterium tuberculosis α-Crystallin-Like hspX gene causes increased bacterial growth in vivo. Infect Immun, 2006, 74(2): 861–868.
[9] Sherman DR, Voskuil M, Schnappinger D, et al. Regulation of the Mycobacterium tuberculosis hypoxic response gene encoding alpha-crystallin. Proc Natl Acad Sci USA, 2001, 98(13): 7534–7539.
[10] Klein MR, Leyten EMS, Lin MY, et al. Human T-cell responses to 25 novel antigens encoded by genes of the dormancy regulon of Mycobacterium tuberculosis. Microbes Infect, 2006, 8: 2052–2060.
[11] Jo´zefowski S, Sobota A, Kwiatkowska K. How Mycobacterium tuberculosis subverts host immune responses. BioEssays, 2008, 30: 943–954.
[12] Mariotti S, Sargentini V, Pardini M, et al. Mycobacterium tuberculosis may escape helper T cell recognition by infecting human fibroblasts. Hum Immunol, 2013, 74(6): 722–729.
[13] Chen T, He L, Deng W, et al. The Mycobacterium DosR regulon structure and diversity revealed by comparative genomic analysis. J Cell Biochem, 2013, 114(1): 1–6.
[14] Gengenbacher M, Kaufmann SH. Mycobacterium tuberculosis: success through dormancy. FEMS Microbiol Rev, 2012, 36(3): 514–532.
[15] Druszczyńska M, Kowalewicz-Kulbat M, Fol M, et al. Latent M. tuberculosis infection-pathogenesis, diagnosis, treatment and prevention strategies. Pol J Microbiol, 2012, 61(1): 3–10.
[16] Huygen K, Roupie V, Romano M, et al. Immunogenicity of eight dormancy regulon-encoded proteins of Mycobacterium tuberculosis in DNA-vaccinated and tuberculosis-infected mice. Infect Immun, 2007, 75(2): 941–949.
[17] Koide Y, Yamamura Y, Tsujimura K, et al. Immunogenicity of latency-associated antigens of Mycobacterium tuberculosis in DNA-vaccinated mice. Procedia Vaccinol, 2010, 3: 19–26.
[18] Chiacchio T, Petruccioli E, Vanini V, et al. Higher frequency of T-cell response to M. tuberculosis latency antigen Rv2628 at the site of active tuberculosis disease than in peripheral blood. PLoS ONE, 2011, 6(11): e27539.
[19] Liu PT, Modlin RL. Human macrophage host defense against Mycobacterium tuberculosis. Curr Opin Immunol, 2008, 20: 371–376.
[20] Nathan C, Shiloh MU. Reactive oxygen and nitrogen intermediates in the relationship between mammalian hosts and microbial pathogens. Proc Natl Acad Sci USA, 2000, 97: 8841–8848.
[21] Deretic V, Delgado M, Vergne I, et al. Autophagy in immunity against Mycobacterium tuberculosis: a model system to dissect immunological roles of autophagy. Curr Top Microbiol Immunol, 2009, 335: 169–188.
[22] Chakraborty P, Kulkarni S, Rajan R, et al. Drug resistant clinical isolates of Mycobacterium tuberculosis from different genotypes exhibit differential host responses in THP-1 cells. PLoS ONE, 2013, 8(5): e62966.
[23] George PJ, Anuradha R, Kumaran PP, et al. Modulation of mycobacterial-specific Th1 and Th17 cells in latent tuberculosis by coincident hookworm infection. J Immunol, 2013, 190(10): 5161–1518.
[24] Caccamo N, Guggino G, Joosten SA, et al. Multifunctional CD4(+) T cells correlate with active Mycobacterium tuberculosis infection. Eur J Immunol, 2010, 40(8): 2211–2220.
[25] Lin MY, Geluk A, Tom HM, et al. Lack of immune responses to Mycobacterium tuberculosis DosR regulon proteins following Mycobacterium bovis BCG vaccination. Infect Immun, 2007, 75(7): 3523–3530.
(本文责编 郝丽芳)
Immunological characteristics of Mycobacterium tuberculosis antigen Rv2628
Yuelan Yin*, Yunfei Gao*, Dan Zhao, Kai Lian, Xiang Chen, Zhengzhong Xu, Zhiming Pan, and Xin′an Jiao
Jiangsu Key Laboratory of Zoonosis, Jiangsu Co-Innovation Center for Prevention and Control of Important Animal Infectious Disease and Zoonoses, Jiangsu Province, Yangzhou University, Yangzhou 225009, Jiangsu, China
Antigen Rv2628 of Mycobacterium tuberculosis is associated with latent tuberculosis infection. In this study, Rv2628 was prokaryotic expressed and purified, its immunological characteristics was evaluated with macrophage cell line RAW264.7 and BALB/c mice. The results show that Rv2628 was mainly expressed in form of inclusion body confirmed by SDS-PAGE, and could react with rabbit anti-H37Rv polyclonal antibody detected by Western blotting assay, indicating that the protein had an effective immunoreactivity. The interactions between Rv2628 and macrophage cell line RAW264.7 confirmed that it could effectively induce cells to produce pro-inflammatory cytokines, the relative expression level of IL-6 mRNA was higher than the control group in 1–12 h. BALB/c mice were subcutaneously immunized with Rv2628 protein, the production of IFN-γ and IL-4 in the spleen cells was determined by Sandwich ELISA, in the Rv2628 immunized group, the level of IFN-γ was significantly higher than that of IL-4 (P<0.000 1). It indicated the protein induced Th1-tendency immune responses. At the same time, Rv262811-30peptide used as coating antigen, the murine serum antibody titer detected by indirect-ELISA was 1:1 600, which demonstrated that Rv2628 could also induce humoral immune responses. In summary, Rv2628 could induce specific pro-inflammatory cytokines, affectively induce strongly Th1-tendency immune response and humoral response, it could be a potential target for developing subunit vaccine against TB. In addition, it laid foundation for probing the cross-talk between M. tb and host.
Mycobacterium tuberculosis, Rv2628, Th1 type immunity, pro-inflammatory cytokines, macrophage cell line
July 29, 2013; Accepted: November 5, 2013
Xin′an Jiao. Tel: +86-514-87971136; Fax: +86-514-87311374; E-mail: jiao@yzu.edu.cn*These authors contributed equally to this study.
殷月兰, 高云飞, 赵丹, 等. 结核分枝杆菌Rv2628蛋白的免疫生物学特性. 生物工程学报, 2014, 30(2): 255-264.
Yin YL, Gao YF, Zhao D, et al. Immunological characteristics of Mycobacterium tuberculosis antigen Rv2628. Chin J Biotech, 2014, 30(2): 255-264.
Supported by: National Basic Research Program of China (973 Program) (No. 2012CB518805), National Science foundation of Jiangsu Province, China (No. BK2011446), National Natural Science Foundation of China (No. 31101841), Jiangsu Provincial Key Agricultural Technology Program (No. BE2012367), Priority Academic Program Development of Jiangsu Higher Education Institutions.
国家重点基础研究发展计划 (973计划) (No. 2012CB518805),江苏省自然科学基金 (No. BK2011446),国家自然科学基金 (No. 31101841),江苏省科技支撑计划 (No. BE2012367),江苏高校优势学科建设工程项目资助。

