OSF 1在毕赤酵母菌中的分泌表达及其生物活性
康东红,王燕,张洪美,冯潇雨,曹维,王萍山东大学附属千佛山医院, 山东 济南 250014
医学与免疫生物技术
OSF 1在毕赤酵母菌中的分泌表达及其生物活性
康东红,王燕,张洪美,冯潇雨,曹维,王萍
山东大学附属千佛山医院, 山东 济南 250014
为了研究人成骨细胞刺激因子(Human osteoblast-stimulating factor, OSF-1) 的生物学活性,构建OSF-1高效毕赤酵母表达菌株并表达纯化具有生物活性的OSF-1。首先通过全基因人工合成的方法合成人osf-1基因,并克隆至毕赤酵母分泌表达载体pPIC9K,构建重组表达质粒pPIC9K/osf-1,线性化后电转化酵母宿主菌GS115,构建P. pastoris GS115/ pPIC9K/osf-1,经MD、G418-YPD平板和PCR法筛选,获得多拷贝转化子。阳性表达菌株在25 ℃,经1% 的甲醇诱导表达96 h,重组蛋白的表达量达到最大。经SDS-PAGE电泳分析所表达的重组蛋白约为18 kDa,与人成骨细胞刺激因子相符。表达上清经SP-Sephadex C-50离子交换层析进行纯化,得到纯度达98%以上的OSF-1。Western blotting 鉴定该蛋白对人成骨细胞刺激因子抗体具有良好的抗原性。生物活性测定表明提纯的OSF-1 能促进鼠成骨细胞 MC3T3-E1 的增殖和分化。利用重组毕赤酵母高效分泌表达了有生物活性的OSF-1,为进一步开展其抗骨质疏松活性研究及产业化开发奠定了基础。
OSF-1,毕赤酵母,蛋白表达,纯化,生物活性
随着社会人口老龄化,骨质疏松(Osteoporosis, OP) 已成为世界范围内危害人类健康的日趋严重的医疗问题和社会问题。目前抗OP的药物分为抑制骨吸收和刺激骨形成两大类,但尚不能完全解决OP骨折这一棘手的问题。骨质量由骨小梁的数量和其最佳立体构象所决定。虽然促进骨形成和抑制骨吸收的药物均可增加骨小梁的数量,但对骨小梁最佳立体构象的形成并非理想。成熟骨小梁的构建要经过3个月才能完成,包括细胞分化-骨吸收-骨形成不断的塑建,塑成网状交织的立体结构,用最小能量承载最大负荷,即最佳力学构象。骨骼的内部结构决定它的质量,但在研究骨质疏松时,由于涉及多学科,这一关键点却被忽略。只有切入到这一角度来防治骨质疏松,才能有效地降低OP患者远期骨折的发生率,因此它必将成为骨质疏松研究的热点。因此,寻找及研究能改善骨小梁结构的力学敏感性基因及其活性蛋白将成为必然。
近年发现人成骨细胞刺激因子(Human osteoblast-stimulating factor, OSF-1) 基因属于动力敏感性基因,机械应力在其表达中起着非常关键性的作用[1],其活性产物OSF-1参与了骨细胞对机械应力的应答[2],对骨小梁构象有可能起重要的作用[3-4]。Moustapha等报道机械应力可以上调人骨髓间充质干细胞hMSC-TERT4细胞中OSF-1的表达[5]。三点弯曲实验发现osf-1基因缺失鼠中骨生物力学特性,骨的力量、韧度、弹性极限、硬度、骨量均显著下降;X线分析皮质骨和小梁骨的骨密度也降低。切除OSF-1缺失鼠和正常对照鼠的坐骨神经后发现,正常对照鼠的骨密度严重下降,而OSF-1缺失鼠并未出现此现象,提示OSF-1缺失鼠不能应答外界机械应力[6]。尽管OSF-1对骨骼系统起着重要的作用[7],但作为动力基因的表达产物,对骨小梁立体构象的研究尚未见报道。
成熟的OSF-1含有136个氨基酸,富含半胱氨酸,有5对二硫键[8-9]。由于组织含量甚微,不可能采取提取方法,只有通过基因工程的方法通过原核或真核表达系统来得到OSF-1。由于原核系统缺乏翻译后的加工功能,大肠杆菌表达产物不能正确折叠而影响其稳定性和活性。真核表达系统中,哺乳动物细胞和昆虫细胞表达系统要求培养条件苛刻,操作复杂;同时表达水平不高,价格昂贵。毕赤酵母表达系统具有表达量高、易大规模培养、生产成本低、能进行蛋白质翻译后修饰和生物安全性高等特点被广泛的使用。本研究构建重组毕赤酵母菌,使其能高效、低成本表达OSF-1,并观察OSF-1诱导鼠成骨细胞的增殖和分化,旨在研究OSF-1抗骨质疏松的作用机理,并为其今后产业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞、菌株及质粒
表达载体pPIC9K、E. coli JM109、毕赤酵母Pichia pastoris GS115由大连宝生物工程公司提供;MC3T3-E1鼠成骨细胞 (三代) 购于ATCC。
1.1.2 主要试剂与仪器
限制性内切酶 EcoRⅠ、NotⅠ和SacⅠ、TaKaRa MiniBEST Plasmid Purification Kit Ver. 2.0、TaKaRa Agarose Gel DNA Purification Kit Ver. 2.0、TaKaRa DNA Ligation Kit 购自大连宝生物工程公司;G418购自Sigma公司;酵母提取物购自OXOID公司;多聚蛋白胨购自日本制药株式会社;羊抗OSF1抗体 (ab10849) 购自Abcam公司;辣根酶标记兔抗山羊抗体(ZB-2306) 购自北京中杉金桥公司;MEM EARLES、胎牛血清购自GIBCO公司;CCK-8购自日本同仁化学研究所;碱性磷酸酶测定试剂购自南京建成生物工程研究所。电泳成像装置 (ImageMaster RVD) 由 Pharmacia Biotech提供。恒温器——水浴 (YB-121) 和恒温培养箱(Incubator IC600) 由YAMATO提供。脉冲装置(E. coli Pulser) 由Bio-Rad提供。OD600细胞测定仪 (UL TRSPEC10) 由GE Healthcare BIO-Sciences提供。快速蛋白液相层析系统(FPLC) 由Bio-Rad提供。超滤杯超滤膜购自Millipore公司。倒置显微镜 (OLYMPUS IX70)由奥林巴斯提供。二氧化碳培养箱 (Thermo SCIENTIFIC) 由美国Thermo公司提供。
1.1.3 引物与培养基
依据NCBI公布的基因序列 (Accession No. NM_002825),采用全基因人工合成的方法得到,测序引物、osf-1基因合成和基因测序由大连宝生物工程公司完成。 LB、YPD、YPD-G418、BMGY、BMMY、SOC等培养基参考 Invitrogen公司的毕赤酵母表达手册。
1.2 方法
1.2.1 表达质粒pPIC9k/osf-1的构建
通过NCBI查询目的基因序列(NM_002825),获取osf-1基因序列,用全基因人工合成的方法得到目的基因。首先合成单链小片段DNA,再通过PCR的方法,把单链小片段DNA拼接成一条完整的双链DNA,在425 bp的目的基因的5′末端加入EcoRⅠ酶切位点,在3′末端加入NotⅠ酶切位点。与pMD19-T Simple,构建pMD19/osf-1克隆质粒。取1 μL产物热转化至E. coli感受态细胞JM109 (Code No. D9052)中,涂布平板,37 ℃过夜,提取质粒,用EcoRⅠ和 NotⅠ分别双酶切pMD19/osf-1和pPIC9K,反应条件为37 ℃、4 h,反应体系50 μL。酶切产物在1%琼脂糖凝胶中进行电泳分离,用溴化乙锭染色。长波紫外灯下用手术刀片切下所需条带,放入1.5 mL离心管中,称重。用TaKaRa Agarose Gel DNA Purification Kit Ver. 2.0 回收目的基因和目的载体,并各取1 µL进行1%琼脂糖凝胶电泳。
用TaKaRa DNA Ligation Kit (Code No. 6023)中的连接酶,将osf-1与pPIC9K重组为pPIC9K/osf-1,将其热加入E. coli感受态细胞JM109 (Code No. D9052)中,轻轻混匀,加入800 µL预热的SOC培养基,200 r/min摇床振荡培养1 h,使细菌复苏并表达质粒编码的抗生素抗性标记基因。取200 µL转化的感受态细胞涂布含氨苄青霉素 (50 µL/mL) 的LB平板培养基上,室温放置至液体吸收,37 ℃倒置培养12-16 h。挑选阳性菌落,LB液体培养基中摇菌,提取质粒,测序。
1.2.2 pPIC9K/osf-1转化毕赤酵母
将重组表达质粒pPIC9K/osf-1用SacⅠ酶切使之线性化,电击转化至毕赤酵母菌 GS115。转化菌液涂布RDB平板,30 ℃培养72 h,挑取单克隆,在MD平板上筛选His+表型,分别接种于G418的YPD培养基平板上 (G418浓度分别为0、1和4 mg/mL),30 ℃培养2 d,观察其生长,筛选多拷贝转化子。挑取阳性克隆在MD及MM平板上筛选Mut+表型。用相同的方法转化空载体作对照。本实验所涉及的方法参照Invitrogen 公司毕赤酵母操作手册进行(Invitrogen Corporation. A manual of methods for expression of recombinant proteins. USA)。
1.2.3 PCR鉴定阳性转化子
用灭菌牙签粘取转化平板上的单菌落,使用Lysis Buffer for Microorganism to Direct PCR (TaKaRa Code No. D304),80 ℃变性15 min,得到酵母基因组DNA,作为模板。用GS115作为对照。用TaKaRa LA Taq Kit (TaKaRa Code No. DRR002A),进行PCR扩增,引物为:3' AOX1(5'–3'): GGCAAATGGCATTCTGACATCC; 5' AOX1(5'–3'):GACTGGTTCCAATTGACAAGC。
扩增条件为:94 ℃预变性1 min;98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环。
1.2.4 重组人OSF-1蛋白的诱导表达
经过验证的高拷贝工程菌株按照Invitrogen公司的Multi-Copy Pichia Expression kit操作手册进行发酵表达操作。将阳性克隆菌株接种在YPD培养基中,30 ℃、200 r/min培养至OD600=2-4时,1%种菌液接种至含10 mL BMGY培养基的三角瓶中,分别于25 ℃、200 r/min培养至OD600=4-6时,室温下1 500×g离心5 min,收集菌体,用50 mL BMMY培养基重悬菌体,使OD600=1.5,三角瓶置于25 ℃、200 r/min摇床上进行诱导表达。每24 h向培养基中添加100%甲醇至浓度为1.0%,并分别在诱导0、12、24、36、48、72、96和120 h时取样浓缩进行SDS-PAGE (分离胶浓度为12%) 电泳检测,Bradford定量。
1.2.5 重组人OSF-1蛋白的分离纯化
在1 L三角瓶中发酵300 mL BMMY培养基的工程菌株。经截留分子量为3.5 kDa的透析膜,于4 ℃,PBS缓冲液 (pH 7.6) 中进行透析20 h,每4 h更换磷酸缓冲液。用双蒸水洗SP-Sephadex C-50树脂4次,磷酸缓冲液 (pH 7.6) 洗树脂4次。树脂除气、装柱,用PBS缓冲液,以1.0 mL/min的流速平衡柱子,将透析后的上清液上样,用洗脱液 (20 mmol/L磷酸缓冲液,2 mol/L NaCl,pH 7.6) 洗脱蛋白。根据记录仪上的洗脱曲线确定目的蛋白所在的接收试管,收集目的蛋白溶液经Millipore超滤器 (截留分子量为10 kDa) 进行超滤 (10 000 r/min,20 min) 浓缩除盐后,上清即为纯化蛋白。将得到的蛋白进行SDS-PAGE电泳检测和Bradford定量。
1.2.6 Western blotting检测验证纯化的重组蛋白
经丙烯酰胺凝胶电泳后湿法转PVDF膜,条件为恒流100 mA,1 h,将PVDF膜浸入封闭液 (用TBS配制的3%的BSA)中,室温封闭1 h。加1:2 000稀释的羊抗OSF-1一抗 (ab10849,Abcam公司),室温孵育1 h,TBST洗膜3次,每次10 min,加入1:2 000稀释的辣根酶标记的兔抗山羊二抗 (ZB-2306,北京中杉金桥公司),室温孵育1.5 h,TBST液洗膜3次,每次10 min,加DAB/Nicl2液,暗室显影。Western blotting 方法参见《分子克隆指南》[10]。
1.2.7 CCK-8和PNPP方法检测重组人OSF-1蛋白的生物活性
制备三代鼠成骨细胞MC3T3-E1单细胞悬液,每孔5×103/mL接种于两个96孔板上,放置于37 ℃的CO2培养箱中培养24 h,将其分为阴性对照组、阳性对照组和处理组。吸去原有细胞培养液,根据分组加入相应的细胞培养液100 μL。阴性对照组为常规培养液 (90%平衡盐培养基+10%胎牛血清+双抗1 mL)。OSF-1处理组为常规细胞培养液内分别加入纯化的重组蛋白OSF-1,浓度分别为0.1、1.0、10.0 μg/mL。阳性对照组培养液为常规培养液加甲状旁腺激素,浓度为0.041 178 μg/mL。置于37 ℃的CO2培养箱中,每24 h换一次培养液,连续4 d,观察MC3T3-E1的生长。
培养4 d,观察纯化蛋白对细胞增殖和分化的作用,取细胞培养板,每孔加入10 μL的CCK-8,培养3 h,酶标仪450 nm测定OD值。取另一个培养板,吸取培养液,PBS洗2遍,每孔加入200 μL的TritoX-100裂解液,50 min后细胞完全裂解,向其中加入缓冲液及基质液,水浴15 min,加入显色剂,酶标仪492 nm测定ALP 活性。
2 结果与分析
2.1 pPIC9K/osf-1构建与鉴定
EcoR/ⅠNotⅠ酶切pMD19/osf-1克隆载体及pPIC9K质粒,如图1所示在500 bp附近获得清晰的目的基因条带,在9 200 bp处获得表达载体pPIC9K条带。将连接后的重组质粒pPIC9K/osf-1热转化至E. coli JM109,提取质粒,测序结果表明 (图2),重组人osf-1基因的碱基序列与NCBI数据库NM_002825的目的基因的碱基序列一致,表达片断以正确的阅读框架插入到pPIC9K的多克隆位点EcoRⅠ和NotⅠ之间。
2.2 酵母电击转化与表达菌株的筛选
将线性化的pPIC9K/osf-1和空载体pPIC9K分别电击转化导入毕赤酵母菌GS115后,分别涂布于MD平板上。用含不同浓度G418抗生素的YPD平板筛选后,在4 mg/mL浓度的G418平板上获得生长良好的阳性转化子。提取重组酵母菌基因组作为DNA模板,以酵母表达载体的通用引物AOX为引物,进行PCR鉴定,以GS115菌体为模板的扩增产物作为对照。图3显示,泳道1-4在500 bp处出现扩增条带,为GS115的AOX1基因,无外源基因的插入。泳道5-8在1 000 bp处获得清晰的目标条带,提示pPIC9K/osf-1正确插入酵母菌染色体。PCR结果表明osf-1基因片段成功整合到毕赤酵母组DNA中,重组酵母命名为P. pastoris GS115/ pPIC9K/osf-1。

图1 pMD19/osf-1和pPIC9K的酶切结果Fig. 1 Enzyme digestion result of recombinant vector pMD19/osf-1 and expression vector pPIC9K. M1: λ-Hind Ⅲ digest DNA marker; 1: pPIC9K; 2: osf-1gene; M2: DL2000 DNA marker.

图2 pPIC9K/osf-1表达载体测序鉴定Fig. 2 Sequence analysis of expression vector pPIC9K/osf-1.
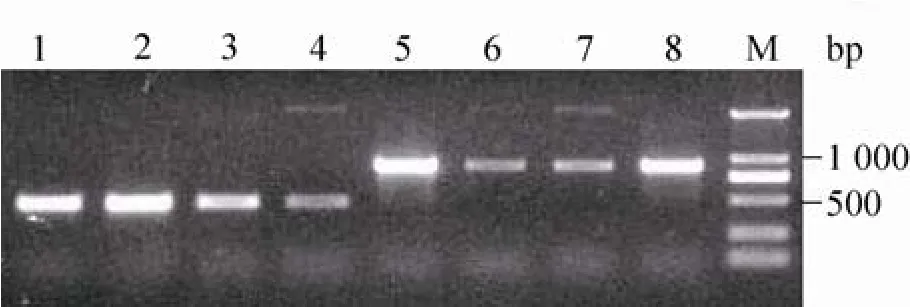
图3 重组表达菌株及空白对照PCR的1%琼脂糖凝胶电泳图Fig. 3 PCR result of P. pastoris GS115/ pPIC9K/osf-1 and GS115. M: DL2000 DNA marker; 1-4: PCR of P. pastoris GS115; 5-8: PCR of P. pastoris GS115/ pPIC9K/osf-1.

图4 毕赤酵母GS115/ pPIC9K/osf-1表达上清SDS-PAGE分析Fig. 4 SDS-PAGE analysis of expressed OSF-1 from cultural supernatant of P. pastoris. GS115/pPIC9K/osf-1. 1–8: P. pastoris GS115/ pPIC9K/osf-1 (0, 12, 24, 36, 48, 72, 96, 120 h); M: protein marker.
2.3 重组酵母表达产物的SDS-PAGE分析
选取表达菌株接种在10 mL BMGY培养液中,25 ℃振荡培养至 OD600= 4,离心收集菌体,再用BMMY培养基重悬菌体,在25 ℃诱导OSF-1蛋白表达。诱导表达间隔12-24 h连续取样,共120 h,进行SDS-PAGE分析。表达上清液经SDS-PAGE检测,诱导表达72 h,在约18 kDa 处有一条清晰的蛋白条带,此条带与预测的OSF-1蛋白的分子量大小相符合,用同样条件诱导培养的对照无此条带 (图4)。以上结果表明,毕赤酵母工程菌所表达的重组蛋白为OSF-1蛋白,且其在96 h时表达量最大为82.3 μg/mL。
2.4 重组酵母表达蛋白OSF-1的纯化
将OSF-1阳性表达菌株接种300 mL诱导表达培养基 (pH 6.0),在25 ℃、1%甲醇条件下诱导表达96 h。13 000 r/min离心除去菌体。上清液经20 mmol/L PBS缓冲液 (pH 7.6) 透析后经SP-Sephadex C-50树脂纯化,用洗脱液(20 mmol/L PBS缓冲液,pH 7.6,2 mol/L NaCl)洗脱蛋白。洗脱液经过超滤除盐浓缩后,SDS-PAGE检测在18 kDa附近可见清晰蛋白条带 (图5),Western blotting检测纯化的目的蛋白能与OSF-1抗体结合 (图6)。通过该纯化工艺,可以从每升发酵上清中获得22.3 mg且纯度大于98%的OSF-1蛋白,纯化收得率为27.1%。纯化后的OSF-1蛋白于-20 ℃保存。
2.5 重组酵母表达蛋白诱导细胞增殖和分化
倒置显微镜下,接种的各组成骨细胞,最初多为圆形,植入后2 h细胞开始贴壁变形,24 h后细胞开始分化增殖,呈梭形外观,48 h可见贴壁细胞形成团簇。随着培养时间延长,细胞突起增多、延长,3 d后可见成骨细胞突起伸展 (图7)。

图5 SDS-PAGE鉴定纯化的OSF-1Fig. 5 Identification of the purified OSF-1 by SDS-PAGE. 1: negative control; 2–3: purified OSF-1; M: protein marker.

图6 Western blotting鉴定纯化的OSF-1Fig. 6 Identification of the purified OSF-1 by Western blotting.

表1 酵母表达蛋白诱导MC3T3-E1增殖和分化Table 1 Proliferation and differentiation of osteoblasts MC3T3-E1 by recombinant protein OSF-1
CKK-8法观察细胞增殖,结果显示OSF-1组处理的细胞增殖OD值高于阴性对照组(P<0.05)。分别用浓度为0.1、1.0、10.0 μg/mL OSF-1处理细胞,呈浓度时效依赖性,细胞增殖OD值以1.0 μg/mL浓度的增殖作用最大,且较甲状旁腺激素处理组高 (表1)。
碱性磷酸酶活性测定来观察细胞分化,结果显示OSF-1处理组成骨细胞碱性磷酸酶活性显著高于阴性对照组,但低于甲状旁腺激素组,OSF-1处理组诱导细胞分化呈浓度依赖性,随着浓度增加,碱性磷酸酶活性增高,1.0 μg/mL增高较显著,虽然10.0 μg/mL处理后碱性磷酸酶活性继续增高,但较缓慢 (表1)。

图7 细胞种板3 d后的成骨细胞(×40)Fig. 7 Osteoblast of negative, OSF-1 and PTH groups after three days.
3 讨论
巴斯德毕赤酵母表达系统起始于上世纪80年代[11]。它具有原核表达系统优点,如产量高,可大规模生产,又具有分泌表达、使外源基因遗传稳定性好的优势[12],在蛋白折叠和糖基化修饰方面优于原核表达系统,更适合真核基因的生物学功能研究[13-14]。本实验将人工合成的osf-1基因插入酵母分泌型表达载体pPIC9K中,构建重组质粒pPIC9K/osf-1,电转化感受态的毕赤酵母GS115,构建P. pastoris GS115/pPIC9K/osf-1表达菌株。
诱导P. pastoris GS115/pPIC9K/osf-1表达蛋白发酵实验流程中,甲醇含量[15-16]、诱导时间和温度都比较重要。甲醇浓度过高对酵母有害,过低则限制菌体生长,本实验甲醇的诱导浓度为1%。一般情况下诱导72 h外源蛋白表达量接近最高值,诱导时间设定120 h。酵母的最佳生长温度为28-30 ℃[17]。超过32 ℃,外源蛋白很难表达,甚至会导致细胞死亡。Jahic等认为低温发酵可以提高蛋白的表达量。因此将发酵过程分为两个阶段,设定一个较高温度使菌体长到一定密度后,再调低一个温度至蛋白表达,25 ℃及30 ℃作为诱导温度。本实验挑取G418抗性高的His+Mut+型克隆进行甲醇诱导表达。连续培养120 h,每日补充甲醇,维持浓度在1%,每12 h取样,SDS-PAGE鉴定。24 h时,18 kDa附近目标蛋白条带出现,随着培养时间增加,外源蛋白表达量随之增加,蛋白电泳提示72 h蛋白表达量明显增多,以96 h表达量最多。
本实验采用离子交换层析方法进行OSF-1纯化,与其他纯化蛋白的方法比较,离子交换层析是根据蛋白质的电荷不同分离蛋白质,是所有蛋白纯化与浓缩方法中最有效的方法[18-19]。离子层析的分离效率高,纯化后的蛋白活性高,纯度高、产量大,且操作简便,易于自动化,成本低廉,实用性广。该蛋白在pH为7.6的磷酸缓冲液及蛋白洗脱液分离,保证了蛋白的活性,大多数细胞适宜在pH 7.2-7.4条件下生长,因此,纯化的蛋白不影响细胞的生长环境。通过该纯化工艺,可以从每升发酵上清中获得22.3 mg且纯度大于98%的OSF-1蛋白。
目前用于研究成骨细胞增殖和分化的方法主要有CCK8法[20]和ALP活性的测定。以甲状旁腺激素作为阳性对照,0.1、1.0和10 μg/mL OSF-1三个浓度处理鼠成骨细胞,结果显示OSF-1具有诱导细胞增殖和分化的生物学作用,呈剂量依赖性,由0.1 μg/mL至1.0 μg/mL作用增加的幅度最大,10 μg/mL时尽管作用增加,但幅度较小。与甲状旁腺激素比较,其增殖作用强度接近,诱导作用较弱。
本实验构建了成骨细胞刺激因子P. pastoris GS115/ pPIC9K/osf-1,通过甲醇诱导获得了分泌表达的OSF-1,得到了甲醇利用性的转化子,简化了发酵工艺。离子层析方法获得了高纯度的OSF-1蛋白。生物活性研究显示,纯化的OSF-1蛋白能诱导鼠成骨细胞的增殖和分化,作为动力敏感基因的蛋白,有可能成为新型抗骨质疏松药物,为进一步研究奠定了基础。
REFERENCES
[1] Liedert A, Kaspar D, Claes L, et al. Signal transduction pathways involved in mechanical regulation of HB-GAM expression in osteoblastic cells. Biochem Biophys Res Commun, 2006, 342(4): 1070–1076.
[2] Albi E, Curcio F, Spelat R, et al. Loss of parafollicular cells during gravitational changes (microgravity, hypergravity) and the secret effect of Pleiotrophin. PLoS ONE, 2012, 7(12): e48518.
[3] Liedert A, Kassem M, Claes L, et al. Mechanosensitive promoter region in the human HB-GAM gene. Biochem Biophys Res Commun, 2009, 387(2): 289–293.
[4] Xing W, Baylink D, Kesavan C, et al. Global gene expression analysis in the bones reveals involvement of several novel genes and pathways in mediating an anabolic response of mechanical loading in mice. J Cell Biochem, 2005, 96(5): 1049–1060.
[5] Liedert A, Kassem M, Claes L, et al. Mechanosensitive promoter region in the human HB-GAM gene. Biochem Biophys Res Commun, 2009, 387(2): 289–293.
[6] Imai S, Heino TJ, Hienola A, et al. Osteocyte-derived HB-GAM (pleiotrophin) is associated with bone formation and mechanical loading. Bone, 2009, 44(5): 785–794.
[7] Tare RS, Oreffo RO, Clarke NM, et al. Pleiotrophin/Osteoblast-stimulating factor 1: dissecting its diverse functions in bone formation. J Bone Miner Res, 2002, 17(11): 2009–2020.
[8] Merenmies J, Rauvala H. Molecular cloning of 18 kDa growth-associated protein of developing brain. J Biol Chem, 1990, 265(28): 16721–16724.
[9] Meng K, Ma XH, Zhang N. Pleiotrophin interact with it’s receptors and signal transduction pathway. Life Sci Res, 2007, 11(1): 1–9 (in Chinese).孟坤, 马晓海, 张南. 多功能生长因子PTN与受体互相作用及跨膜信号转导. 生命科学研究, 2007, 11(1): 1–9.
[10] Sambrook J,Russell DW. Molecular Cloning. Beijing: Science Press, 2002: 359–361 (in Chinese). Sambrook J, Russell DW. 分子克隆实验指南. 北京: 科学出版社, 2002: 359–361.
[11] Hitzeman RA, Hagie FE, Levine HL, et al. Expression of human gene for interferon in yeast. Nature, 1981, 293(5835): 717–722.
[12] Lin Cereghino GP, Sunga AJ, Lin Cereghino J, et al. Expression of foreign genes in the yeast Pichia pastoris. Genet Eng, 2001, 23: 157–169.
[13] Cregg JM, Vedvick TS, Raschke WC. Recent advances in the expression of foreign in Pichia pastoris. Biotechnology, 1993, 11(8): 905–910.
[14] Nohr J, Kristiansen K, Krogsdam A. Protein expression in yeast. Methods Mol Biol, 2003, 232:111–125.
[15] Wu D, Chu J, Wang YH, et al. Influence of methanol concentration on purification recovery of consensus interferon-I produced by Pichia pastoris. Chin J Biotech, 2011, 27(12): 1789–1796 (in Chinese).吴丹, 储炬, 王永红, 等. 甲醇浓度对毕赤酵母表达重组人复合干扰素分离纯化得率的影响. 生物工程学报, 2011, 27(12): 1789–1796.
[16] Schenk J, Marison IW, von Stockar U. A simple method to monitor and control methanol feeding of Pichia pastoris fermentations using mid-IR spectroscopy. J Biotechnol, 2007, 128(2): 344–353. [17] Jahic M, Wallberg F, Bollok M, et al. Temperature limited fed-batch technique for control of proteolysis in Pichia pastoris bioreactor cultures. Microb Cell Fact, 2003, 2(1): 6.
[18] Sun YF, Zhao YP, Liu H, et al. Purification and regeneration of rhBMP-2. Chin J Cons Dentis, 2001, 11(2): 73 (in Chinese).孙叶芳, 赵艳萍, 刘晗, 等. 重组人骨形成蛋白2的纯化和复性. 牙体牙髓牙周病学杂志, 2001, 11(2): 73.
[19] Jiang Y, Wen YJ, Liu JY, et al. Expression and purification of mouse B lymphocyte chemoattractant. J Biomed Eng, 2004, 21(2): 251–254 (in Chinese).姜愚, 文艳君, 刘继彦, 等. 小鼠B细胞趋化因子原核表达与纯化. 生物医学工程学杂志, 2004, 21(2): 251–254.
[20] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods, 1983, 65(1/2): 55–63.
(本文责编 陈宏宇)
Expression and bioactivity of OSF-1 in Pichia pastoris
Donghong Kang, Yan Wang, Hongmei Zhang, Xiaoyu Feng, Wei Cao, and Ping Wang
Department of Endocrinology, Qianfoshan Hospital, Shandong University, Jinan 250014, Shandong, China
In order to research the biologic activity of osteoblast-stimulating factor 1 (OSF-1), the pPIC9K/osf-1 yeast expression vector was constructed to express and purify OSF-1. Firstly, the osf-1 gene sequence was obtained by artificial synthesis and cloned into Pichia pastoris expression vector pPIC9K to generate pPIC9K/osf-1. The recombinant plasmidwas linearized by SacⅠand transformed into P. pastoris GS115 by electroporation. Recombinant P. pastoris GS115/ pPIC9K/osf-1 was screened by MD and G418-YPD plates and further identified by PCR. The positive P. pastoris was induced with 1% methanol at 25 ℃ for 96 h.The target protein was analyzed by SDS-PAGE showing a special band about 18 kDa. The target protein was successfully purified from the supernatant of the broth using ion exchange chromatography of SP-Sephadex C-50. The purity of target protein was above 98%. Western blotting appeared a good antigenicity of the purified protein. Bioassay results show that the recombinant protein OSF-1 can promote the differentiation and proliferation of osteoblasts MC3T3-E1. We successfully expressed OSF-1 by recombinant P. pastoris for further development of anti-osteoporosis of research and industrial production of OSF-1.
OSF-1, Pichia pastoris, protein expression, purification, biological activity
April 23, 2013; Accepted: June 26, 2013
Donghong Kang. Tel/Fax: +86-531-88563805; E-mail: kdh_2010@163.com
康东红, 王燕, 张洪美, 等. OSF 1在毕赤酵母菌中的分泌表达及其生物活性. 生物工程学报, 2014, 30(2): 274-283.
Kang DH, Wang Y, Zhang HM, et al. Expression and bioactivity of OSF-1 in Pichia pastoris. Chin J Biotech, 2014, 30(2): 274-283.
Supported by: Shandong Young Scientists Foundation (No. 2004BS02020).
山东省优秀中青年科学家奖励基金 (No. 2004BS02020) 资助。
时间:2014-01-03 网络出版地址:http://www.cnki.net/kcms/detail/11.1998.Q.20140103.0810.001.html

