生物法合成戊二胺研究进展
李东霞,黎 明,王洪鑫,王舒雅,路福平天津科技大学生物工程学院 工业发酵微生物教育部重点实验室 国家工业酶工程实验室 天津市工业微生物重点实验室,天津 300457
综述
生物法合成戊二胺研究进展
李东霞,黎 明,王洪鑫,王舒雅,路福平
天津科技大学生物工程学院 工业发酵微生物教育部重点实验室 国家工业酶工程实验室 天津市工业微生物重点实验室,天津 300457
随着经济快速发展,大气污染和全球变暖的趋势日益恶化。世界上每年消耗大量石化资源来源的聚酰胺,戊二胺作为聚酰胺的重要组成单体,生物法合成戊二胺具有经济学和生态学双重意义。目前, 生物法合成戊二胺的工程菌主要有谷氨酸棒状杆菌和大肠杆菌,文中从微生物中戊二胺的代谢、戊二胺合成途径的关键酶和转运蛋白、戊二胺生产最佳代谢途径和戊二胺产量的预测、代谢工程研究进展等方面综述了生物法合成戊二胺的最新研究现状和进展,并对其前景进行了展望。
戊二胺,谷氨酸棒状杆菌,大肠杆菌,赖氨酸脱羧酶,尸胺转运蛋白
戊二胺(Diaminopentane),又名尸胺(Cadaverine)、1,5-二氨基戊烷、五亚甲基二胺或尸毒素,是生物胺类 (包括腐胺、精胺、亚精胺和尸胺等) 中的一种[1]。1885年,德国柏林的医师Ludwig Brieger 在腐败的尸体中首次发现该胺类,并以此得名尸胺[2]。在细胞内,戊二胺是赖氨酸合成途径的延伸反应产物,是赖氨酸脱羧酶(E.C.4.1.1.18)催化赖氨酸脱羧产生的 (图1)。戊二胺具有许多重要的生理功能,如戊二胺是微生物细胞内调节铁离子浓度的“铁亲和系统”和一些严格厌氧的革兰氏阴性菌肽聚糖的主要组成成分[3-5];戊二胺在关闭孔蛋白通道和保护大肠杆菌免受氧的毒害方面也起着重要的作用[6-8];内源性戊二胺的分泌以及胞内高浓度戊二胺积累可导致外膜渗透性降低,抑制某些抗生素如头孢霉素类抗生素的作用[9-11]。
戊二胺在农业、医学和工业上具有广泛的应用。在农业上,外源施加戊二胺可以改善坐果和促进果实发育,提高果实的产量[12-13];在医学上,它也可作为一种有效治疗痢疾的药物[14];在工业上,戊二胺与二元酸进行聚合反应可合成优质高分子材料——新型尼龙[15]。
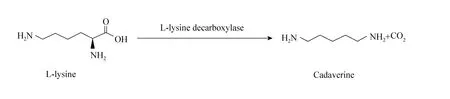
图1 赖氨酸脱羧反应Fig. 1 Reaction of lysine decarboxylate.
每年全球约生产600万t聚酰胺,其中尼龙6.6 (即聚酰胺6.6, Polyamide 6.6, PA 6.6) 是聚酰胺类产品中开发最早、产量最大、应用最广的产品之一,被广泛应用于航空航天、汽车部件、机械零部件、电子电器和包装材料领域中,在胶粘剂及化妆品领域也得到了广泛应用[16]。尼龙6.6是由己二酸和己二胺按摩尔比1:1聚合的产物。目前,己二酸可利用生物催化技术合成,但己二胺的合成仍然依赖于石油化工产品[17]。随着国际油价的飙升和石油资源的枯竭以及石油资源的大量消耗导致大气CO2含量的迅速升高和环境污染,人们试图寻找一种能利用生物方法生产己二胺的替代物,从而用一种可再生资源替代石油来生产尼龙[18]。戊二胺是赖氨酸脱羧的产物,与己二胺互为同系物,可代替己二胺用来合成新型尼龙 (图2)。在工业上,戊二胺可以分别与己二酸、琥珀酸和癸二酸等二元酸聚合形成新型材料聚酰胺5.6(Polyamide 5.6,PA 5.6)、聚酰胺5.4[19-21]和聚酰胺5.10[22]。PA 5.6具有重要的工业用途,与PA 6.6一样具有良好的机械强度、较高的熔点和耐各种有机溶剂的特性,可以替代PA 6.6使用[23]。聚酰胺5.10材料性能极佳,具有高熔点(215 ℃)、低吸水率(1.8%)、低密度(1.07 g/cm3)等优点。由于己二酸、琥珀酸已经可以通过微生物合成,癸二酸也可以从蓖麻油来制取。因此,戊二胺的生物合成成为合成新型材料聚酰胺的一个关键问题,下文将阐述生物法合成戊二胺的最新研究进展。
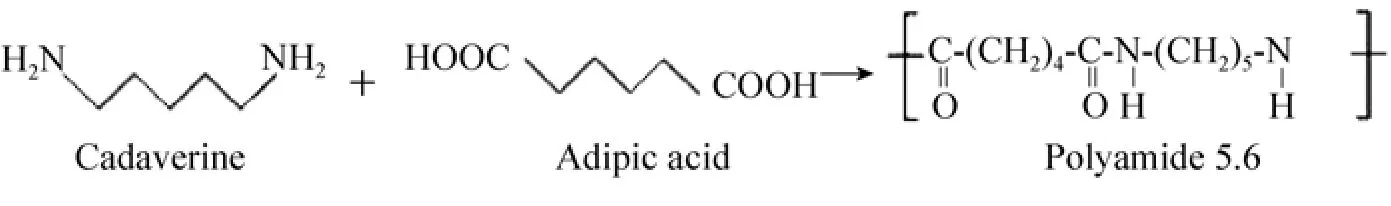
图2 PA 5.6反应方程式Fig. 2 Chemical structure and production of polyamide 5.6 using cadaverine and adipic acid from renewable resources.
1 微生物中戊二胺的代谢
微生物中戊二胺的代谢包括戊二胺的合成、降解、吸收和分泌。微生物中存在两种完全不同的赖氨酸合成途径:一种是始于α-酮戊二酸和乙酰-CoA的α-氨基己二酸途径 (AAA),另一种是始于天冬氨酸的二氨基庚二酸途径 (DAP)。第一种途径主要存在于高等真菌和古生菌中,某些细菌如嗜热栖热菌属中也存在该途径;第二种途径主要存在于细菌和植物中,而且这两个途径没有直接的进化关系[24]。
1.1 大肠杆菌和谷氨酸棒状杆菌中戊二胺的代谢途径
戊二胺是通过赖氨酸脱羧酶催化赖氨酸脱羧形成的。大肠杆菌能够直接合成戊二胺,谷氨酸棒状杆菌虽然不能直接合成戊二胺,但它能高效合成戊二胺的前体,即赖氨酸脱羧酶的底物赖氨酸,并且二者合成赖氨酸的途径类似 (图3)[25]。如果在谷氨酸棒状杆菌中表达赖氨酸脱羧酶,谷氨酸棒杆菌也能像大肠杆菌一样直接合成戊二胺[26]。大肠杆菌中赖氨酸的合成途径从TCA循环的中间代谢物草酰乙酸(Oxaloacetate)开始,需要连续十步的酶反应。前3步生成代谢的节点中间物天冬氨酸半醛(Aspartic acid semialdehyde),由它进一步合成L-甲硫氨酸、L-苏氨酸、L-异亮氨酸和L-赖氨酸。L-赖氨酸经赖氨酸脱羧酶的催化脱羧生成戊二胺。在大肠杆菌中,存在3种天冬氨酸激酶(EC 2.7.2.4):LysC、ThrA和MetL,它们是催化天冬氨酸磷酸化成天冬氨酰磷酸的同工酶。
民办本科院校学生主动学习的态度不是很积极,对于深奥的数学推导往往有畏难情绪.数学建模课程中采取案例式教学方法,课堂上首先对一些生动的实际问题进行分析,在分析的基础上自然而然地建立数学模型,然后再使用数学方法分析求解.这种教学方法符合学生的认知理论,学生很容易接受.如微分方程内容的案例有出土文物年代的推断,陈光标代言天杞园减肥是真是假案例;从手机导航这一问题来讲解图论中的最短路径问题,从洒水车洒水问题来讲解邮递员路径问题;从大学生手上的零花钱如何分配最佳来讲解运筹学中的最优化问题等.
其中天冬氨酸激酶Ⅰ(ThrA)[27]、天冬氨酸激酶Ⅱ(MetL)[28]是双功能酶,它们同时也具有高丝氨酸脱氢酶活性,能催化分支中间产物天冬氨酸半醛生成高丝氨酸,从而使碳流流向合成苏氨酸、甲硫氨酸、异亮氨酸的分支途径。天冬氨酸激酶Ⅲ(LysC) 是赖氨酸合成途径中的特异关键酶[29]。而在谷氨酸棒状杆菌中,只有一种天冬氨酸激酶(LysC)。此外,谷氨酸棒状杆菌中既可以通过二氨基庚二酸脱氢酶 (Ddh, EC 1.4.1.16) 直接催化四氢二吡啶二羧酸转化为二氨基庚二酸,也可以通过DapDCEF四步催化完成转化,而在大肠杆菌中该过程要经历DapDCEF四步催化才能完成。大肠杆菌中赖氨酸合成的各个步骤都受赖氨酸调控,既包括对天冬氨酸激酶Ⅲ基因 (lysC)、天冬氨酸半醛脱氢酶基因 (asd)、二氢吡啶二羧酸还原酶基因(dapB)、四氢二吡啶琥珀酸酶基因 (dapD) 和二氨基庚二酸脱羧酶基因 (lysA) 的转录阻遏,又包含对天冬氨酸激酶Ⅲ (LysC) 和二氢甲基吡啶酸合成酶 (DapA) 催化的反馈抑制作用[30]。
21世纪是信息化高速发展时代,多媒体的广泛应用已经成为大趋势。随着高校信息化的发展,也必然使多媒体教室的使用朝着信息化、智能化方向深入发展[6]。不同高校应该从学校的实际情况出发,坚持发展的理念,运用科学的管理方法、先进的管理技术、完善的管理制度,认真做好多媒体的管理使用工作,同时还要做好多媒体管理人员和任课教师等的培训工作,为高校的正常教学运行提供可靠的软件支持和硬件支撑,更好地服务于全校的教学工作。
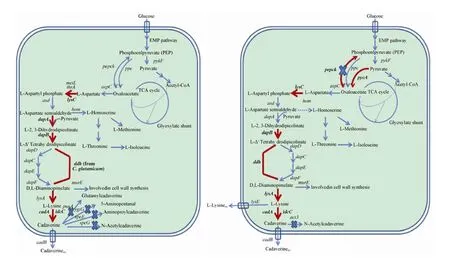
图3 大肠杆菌和谷氨酸棒状杆菌中尸胺的代谢途径 (左图为大肠杆菌中,右图为谷氨酸棒状杆菌中。粗体箭头表示基因过表达活性增强,箭头上带有X表示该基因被删除,虚线表示该途径被弱化)Fig. 3 Metabolic pathway of cadaverine in E. coli and C. glutamicum. The left is in E. coli and the right is in C. glutamicum. Thick arrows indicate increased activity by overexpression, arrows with blue X’s indicate genes that are knocked out, dashed line indicates attenuation.
除了戊二胺合成途径,戊二胺的代谢还受其降解和转运的调控[31]。尸胺-赖氨酸反向转运蛋白CadB既可以依靠离子动力势摄取戊二胺,又可以分泌戊二胺。大肠杆菌中戊二胺的利用和降解途径,除了编码腐胺/尸胺氨基转移酶的SpeE催化戊二胺为氨丙基戊二胺之外,精胺乙酰转移酶SpeG催化戊二胺为N-乙酰戊二胺,戊二胺转氨酶YgjG催化戊二胺为氨基戊醛,腺嘌呤脱氨酶PuuA催化戊二胺的谷氨酰基化[32]。在假单胞菌中,戊二胺通过氨基转换作用代谢为α-哌啶,进一步氧化为δ-氨基戊酸 (AMV)[25]。在谷氨酸棒状杆菌中,戊二胺也可以和乙酰-CoA作用生成乙酰戊二胺。在一些物种中,戊二胺也是氨基丙酸化和乙酰化的底物[33]。
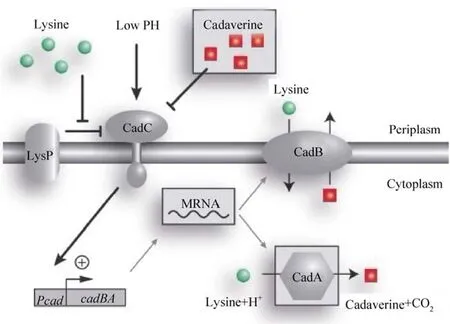
图4 大肠杆菌中Cad系统的调控模型[38]Fig. 4 Regulation Model of the Cad System in E. coli (simplified)[38].
1.2 大肠杆菌中戊二胺诱导合成的调控机制
来自于反刍动物月形单胞菌的ldc基因的ORF长1 182 bp,编码393个氨基酸,形成的赖氨酸脱羧酶由两个相同的单体构成[46]。该基因编码的赖氨酸脱羧酶能够同时催化赖氨酸和鸟氨酸脱羧,而且对这两个底物具有相似的Km和Vmax值。但是在该酶的催化结构域里,催化赖氨酸脱羧和催化鸟氨酸脱羧的比率是0.83。该酶和其他已经报道的细菌来源的赖氨酸脱羧酶和鸟氨酸脱羧酶几乎没有氨基酸序列的相似性,但与真核生物的鸟氨酸脱羧酶的氨基酸序列大约有60%的相似性[4]。
2 戊二胺合成途径的关键酶和转运蛋白
[47] Kashiwagi K, Miyamoto S, Suzuki F, et al. Excretion of putrescine by the putrescine-ornithine antiporter encoded by the potE gene of Escherichia coli. Proc Natl Acad Sci USA, 1992, 89: 4529–4533.
赖氨酸脱羧酶催化赖氨酸脱羧形成戊二胺,是戊二胺合成途径中最关键的酶。赖氨酸脱羧酶存在于大肠杆菌Escherichia coli、蜂房哈夫尼菌Hafnia alvei、耐碱芽胞杆菌Bacillus halodurans、蜡样芽胞杆菌Bacillus cereus、尸杆菌Bacterium cadaveris、伯克霍尔德氏菌Burkholderia vietnamensia、青紫色素杆菌Chromobacterium violaceum、霍乱弧菌Vibrio cholerae、毛链霉菌Streptomyces polosus等[36,39-43]大多数微生物中。赖氨酸脱羧酶也存在于高等植物中,例如黄瓜、家山黧豆等[43]。目前,已经分别从大肠杆菌、蜂房哈夫尼菌、反刍动物月形单胞菌Selenomonas ruminantium、鼠伤寒沙门氏菌Salmonella typhimurium和鮰爱德华氏菌Edwardsiella ictaluri等细菌中克隆出赖氨酸脱羧酶基因[44]。其中对来自于大肠杆菌中的两种脱羧酶的特性研究较为清楚。
大肠杆菌中有两种赖氨酸脱羧酶:诱导型酶CadA[34-35]和组成型酶LdcC[36-37],它们都需要磷酸吡哆醛作为辅助因子。CadA的最适pH是5.5,在pH 8.0时完全失活;LdcC的最适pH是7.6,在广泛的pH范围内均有活性[36-37]。在它们各自的最适pH条件下,LdcC的酶活性高于CadA,尽管LdcC和CadA的最适温度都是52 ℃,但是,CadA在高温下比较稳定,在70 ℃时仍能保持稳定,而LdcC从37 ℃开始,随着温度升高而逐步失活[37]。厌氧环境下cadA在赖氨酸存在的情况下通过低pH (5.5) 诱导,表达达到最高水平,尸胺的分泌中和了胞外培养基的pH[34-35]。多数文献认为,ldcC是组成型表达,且在菌体中其表达水平很低[36];但也有文献认为,ldcC不是组成型表达,而是被某种因子抑制,正常条件下转录很弱,mRNA不稳定[37]。蜂房哈夫尼菌的赖氨酸脱羧酶基因ldc为组成型表达,虽然文献中没有直接来自于蜂房哈夫尼菌的赖氨酸脱羧酶的最适温度和最适pH值,但是,固定化法产该酶的细胞制备1, 5-戊二胺时使用的温度为37 ℃, pH为5.0[45]。不同来源的赖氨酸脱羧酶的氨基酸序列一致性比较高,大肠杆菌的ldcC与cadA以及来自于蜂房哈夫尼菌和鼠伤寒沙门氏菌的ldc基因编码的氨基酸序列相比,相似性分别为69.4%、68.6%和68.9%。大肠杆菌的CadA和蜂房哈夫尼菌的Ldc氨基酸序列相似性为80%,然而只有41%序列具有相同的密码子。而且它们都表现出特定的底物专一性,只能对赖氨酸进行脱羧反应[44]。
少尿:为了预防脱水和休克,及时补液,预防和治疗休克:应及时补充液体和血液,但应避免使用限制肾血管的药物(如去甲肾上腺素);治疗高钾血症:葡萄糖和碳酸氢钠混合静脉注射法,钾离子向细胞转移,纠正高钾血症,也可采用血液透析和腹膜透析。如果有严重的高钾血症或高分解代谢状态,血液透析是最合适的;纠正代谢性酸中毒:代谢性酸中毒在少尿期并不严重,只需补充足够的卡路里,减少身体组织的分解;控制感染:及时控制继发感染,选择无毒的肾脏抗生素如头孢菌素、红霉素、氨苄西林等。
两组患者治疗后,Lund-Mackay鼻窦CT扫描评分均下降,与治疗前相比具有显著性差异(P<0.05)。在治疗前,观察组与对照组的Lund-Mackay鼻窦CT扫描评分之间差异无统计学意义(P>0.05),在治疗20天后,观察组的该项评分低于对照组,且比较差异具有统计学意义(P<0.05),见表3。
大肠杆菌中有两种赖氨酸脱羧酶:诱导型酶CadA[34-35]和组成型酶LdcC[36-37],它们都需要磷酸吡哆醛作为辅助因子。Fritz等建立了大肠杆菌中戊二胺诱导合成的戊二胺操纵子调控机制 (图4)[38]。戊二胺操纵子包括诱导型启动子Pcad、赖氨酸脱羧酶基因cadA和赖氨酸-尸胺反向转运蛋白基因cadB,戊二胺操纵子上游是其调节基因cadC[34]。戊二胺的合成受pH值和赖氨酸浓度调节。在低pH值、高赖氨酸浓度条件下,cadC基因被激活,其产物作用于Pcad,启动cadA、cadB基因表达合成赖氨酸脱羧酶CadA和赖氨酸-尸胺反向转运蛋白CadB[31]。CadA利用细胞内的质子和赖氨酸合成戊二胺和CO2,同时将合成的戊二胺转运至细胞外。cadC基因上游有编码赖氨酸渗透酶的基因lysP,赖氨酸渗透酶基因lysP并不是戊二胺操纵子的组成成分,但它编码的蛋白LysP能抑制CadC的活性。高浓度的赖氨酸可以抑制LysP蛋白对CadC活性的抑制作用[37]。高浓度戊二胺对cadC基因表达具有抑制作用,还可导致细胞膜孔蛋白的关闭[9],影响细菌的正常生长。
[3] Francisco J, Flores J, Rincn JF. Characterization of the iron regulated desA promoter of Streptomyces pilosusasa system for controlled gene express ion in actinomycetes. Microb Cell Fact, 2003, 71: 339–349.
2.2 赖氨酸-尸胺反向转运蛋白
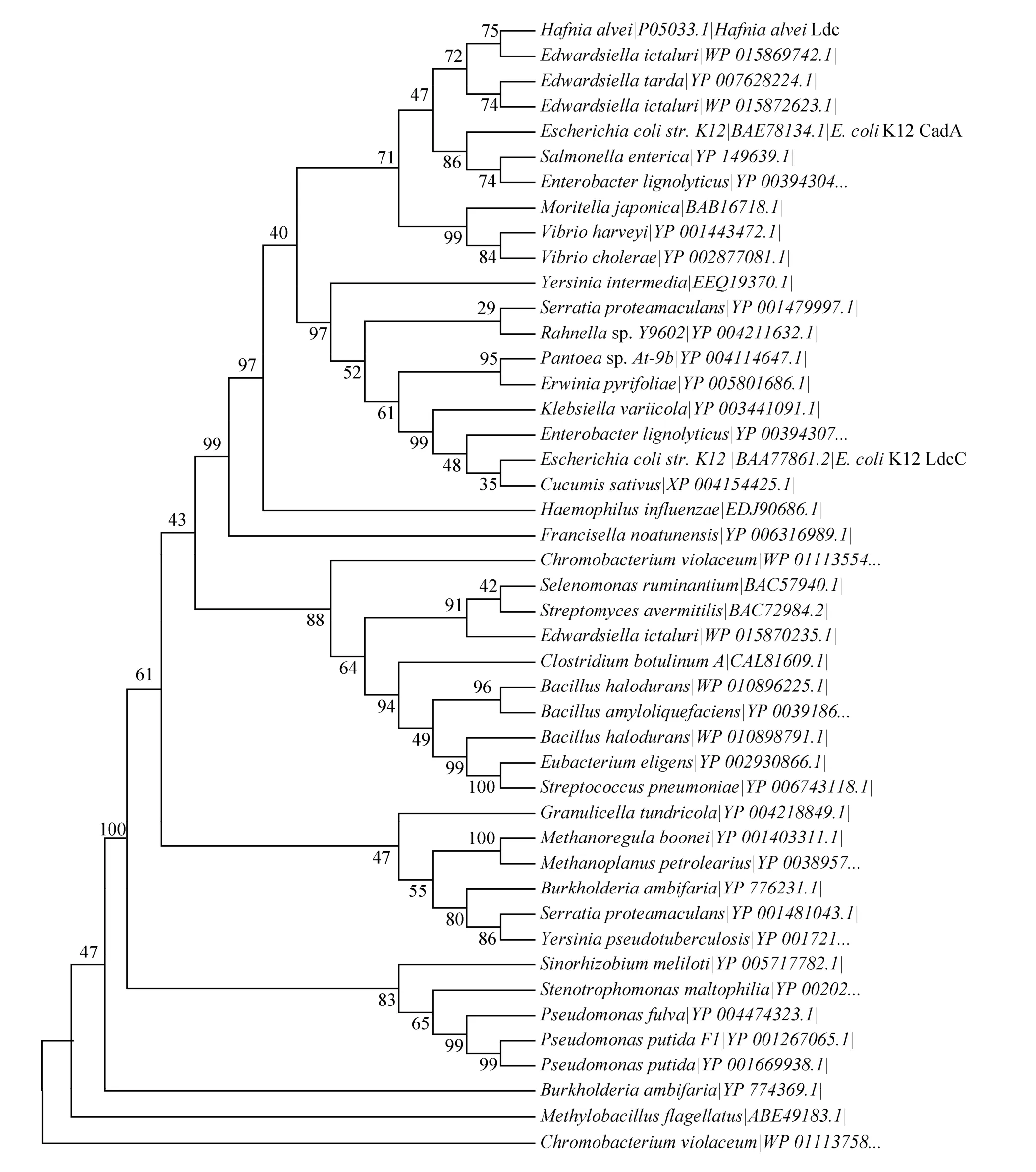
图5 赖氨酸脱羧酶系统进化树Fig. 5 Phylogenetic tree of lysine decarboxylase.
赖氨酸-尸胺反向转运蛋白CadB (Cadaverinelysine antiporter)是一种转运戊二胺和赖氨酸的跨膜蛋白,与PotE(腐胺-鸟氨酸反向转运蛋白)[47-50]和AdiC(胍丁胺-精氨酸反向转运蛋白)[51-52]一样,都属于APC超家族转运蛋白 (Amino acid/polyamine/ organocation superfamily of transporters)[53],对菌体生长具有重要影响。cadB基因长1 335 bp,与cadA组成cad操纵子,编码444个氨基酸[34]。大肠杆菌中戊二胺的浓度不只是通过生物合成来维持,也可以通过摄取、分泌、降解进行调节[31]。由于赖氨酸脱羧酶是胞内酶,合成的戊二胺若在细胞内积累,对细胞具有毒性[54]。Soksawatmaekhin等[31]对CadB的功能进行了详细研究,表明CadB在细胞中同时具有分泌和吸收功能,既可以经过质子动力摄取戊二胺,也可以进行赖氨酸-戊二胺的逆向转运,从而分泌戊二胺。尸胺吸收和分泌的Km值分别为20.8、303 µmol/L。在中性pH值下,如果细胞内多胺不足,细胞可以通过CadB少量摄入戊二胺;在酸性pH值下,CadA催化赖氨酸形成戊二胺,CadB将合成的戊二胺转运到细胞外,维持细胞内外戊二胺的平衡。CadB和CadA对于细胞在酸性pH值下的生长和对酸性的耐受方面具有重要作用。
阿东这才想到,阿里已经很久没有拍着手掌欢唱“阿里的弟弟回来了”。他一下警觉起来,心道自己是不是对阿里关心少了?当晚便带着阿里去逛街,给他买了许多吃的,还陪他打了游戏机。阿里跟着阿东倒是开心,玩游戏时也乐得呵呵笑。但一到家,转瞬便又神情忧郁。
Soksawatmaekhin等[54]还进一步鉴定出CadB上与戊二胺吸收和分泌相关的氨基酸残基:Tyr73、Tyr89、Tyr90、Glu204、Tyr235、Asp303和Tyr423强烈影响戊二胺的吸收和分泌;Trp43、Tyr57、Tyr107、Tyr366和Tyr368主要影响戊二胺的吸收;Arg299主要影响戊二胺的分泌,说明Arg299涉及赖氨酸羧基的识别;Cys370的巯基不仅对戊二胺的氨基识别是必需的,可能还涉及H+的识别。而且,同时涉及戊二胺吸收和分泌、或者仅涉及戊二胺分泌的氨基酸残基都位于细胞膜的细胞质一侧,而仅涉及尸胺吸收的氨基酸残基位于细胞膜的周质空间一侧。Tomitori等[55]还利用已知的AdiC晶体模型模拟了CadB与PotE的结构,三者结构极其相似,只是与底物结合位点的宽度因底物大小而不同。这些研究为CadB的功能改造奠定了基础。
谷氨酸棒状杆菌不能合成戊二胺,因此不存在专一的戊二胺转运蛋白,转运赖氨酸的转运蛋白LysE也不能转运戊二胺。Kind等[56]研究表明,当在谷氨酸棒杆菌中合成戊二胺时,有35种候选基因的表达量上升,其中编码一种渗透酶的cg2893基因的表达量增加了2.6倍。当该基因被删除时,戊二胺的分泌降低了90%,而过表达该基因时,戊二胺的产量可提高20%。因此,渗透酶Cg2893可能具有转运戊二胺的功能。cg2893基因长1 485 bp,编码494个氨基酸,其核苷酸序列和cadB的相似性为69.42%,其氨基酸序列与CadB的相似性为67%。该基因的发现为在谷氨酸棒杆菌中研究戊二胺的合成和转运提供了理论依据。
3 戊二胺生产最佳代谢途径和产量的预测
计量网络模型可以通过模拟预测谷氨酸棒状杆菌和大肠杆菌生产戊二胺的潜力,该模型以两种微生物的基因组序列为基础进行评估[57]。使用基础通量模型分析可以推导出生产戊二胺的最大理论产量、最佳途径、最有前途的目的基因[58]。谷氨酸棒状杆菌和大肠杆菌利用不同的代谢途径优化戊二胺的生产[57]。谷氨酸棒杆菌大量利用戊糖磷酸途径,而此途径在大肠杆菌中几乎未参与戊二胺的合成。合成赖氨酸时,谷氨酸棒杆菌利用特异性的脱氢酶分支途径,而流向三羧酸循环的通量为零,相反,大肠杆菌中只使用需要大量通量流向三羧酸循环的琥珀酰途径。预测的谷氨酸棒状杆菌生产戊二胺最高产量是0.43 g/g (0.75 mol/mol),大肠杆菌则是0.49 g/g (0.84 mol/mol)。这些数值远远超过了目前所达到的生产水平,说明我们仍有很大的优化空间去生产戊二胺。大肠杆菌中,转氢酶 (EC 1.6.1.1-2) 催化NAD+和NADPH与NADH和NADP+之间相互转化的线粒体酶,在网络模型上删除转氢酶时预测产量降低至0.40 g/g。反之,在网络模型中添加转氢酶时,预测的谷氨酸棒杆菌最高产量则增加为0.49 g/g。因此,转氢酶在两种微生物戊二胺合成途径中扮演重要的角色。
4 戊二胺代谢工程研究进展
大肠杆菌的遗传背景清楚,戊二胺的合成机制明确,是研究戊二胺合成的理想宿主之一。研究者或者利用大肠杆菌的静息细胞合成戊二胺,或者根据大肠杆菌中戊二胺的代谢途径,对大肠杆菌进行代谢工程改造,利用糖类发酵直接合成戊二胺。Nishi等利用强启动子Plac构建过表达cadA的大肠杆菌工程菌,工程菌发酵后投入底物赖氨酸,戊二胺产量达到69 g/L发酵液[59]。为了直接利用糖类合成戊二胺,Qian等[32]利用大肠杆菌K12 W3110作为宿主,对戊二胺代谢途径进行了改造:1) 删除编码降解戊二胺的speE、speG、ygjG、puuA和puuP基因,使戊二胺降解和利用途径失活;2) 利用强启动子Plac过表达cadA;3) 通过强启动子Ptrc替换原启动子过表达lysC、dapA、dapB和lysA来增加底物赖氨酸的合成;4)把ddh整合到染色体的iclR(异柠檬酸裂合酶)调节基因位点增加草酰乙酸的供给。结果表明:对赖氨酸合成途径的修饰以及野生型lysC的过表达没有使戊二胺产量提高,而草酰乙酸的供给是个潜在的瓶颈。最终,大肠杆菌工程菌XQ56合成戊二胺的产量为 0.13 g/g葡萄糖。
谷氨酸棒状杆菌是生产赖氨酸的高产菌株,赖氨酸是合成戊二胺的前体物质。因此,研究者也选择谷氨酸棒状杆菌作为宿主菌株进行代谢工程改造,从而利用糖类发酵来合成戊二胺。Mimitsuka等[26]首次利用谷氨酸棒杆菌工程菌发酵葡萄糖来生产戊二胺,将cadA插入谷氨酸棒杆菌的高丝氨酸脱氢酶基因(hom)位点,cadA在卡那霉素抗性基因启动子调控下表达,发酵液上清中积累了2.6 g/L戊二胺;研究还表明,由于谷氨酸棒杆菌缺乏戊二胺转运蛋白,导致戊二胺在细胞内积累,抑制了赖氨酸脱羧酶的活性和戊二胺的合成。Tateno等[60]将淀粉酶基因amyA和cadA同时克隆到谷氨酸棒状杆菌中共表达,构建成可直接利用可溶性淀粉生产戊二胺的谷氨酸棒状杆菌工程菌,尸胺产量达到23.4 mmol/L。本实验室利用蜂房哈夫尼菌中赖氨酸脱羧酶基因ldc,以大肠杆菌/谷氨酸棒杆菌穿梭质粒pXMJ19为载体,构建工程菌株C. glutamicum TK260512/pXMJl9-ldc。工程菌C. glutamicum TK260512/pXMJ19-ldc合成的戊二胺产量为0. 96 g/L[61]。
构建戊二胺高产菌株需要对代谢途径的不同节点进行改造或修饰,包括中心碳代谢中前体和辅因子优化、产物的转运以及与戊二胺合成代谢流无关的分支代谢途径的解除或弱化[62]。Kind等[63]对谷氨酸棒状杆菌中戊二胺代谢途径进行了改造:1) 在天冬氨酸激酶和丙酮酸羧化酶引入点突变 lysC311和pycA458,解除了该酶受到的反馈调节;2) 过表达回补酶 (Anaplerotic enzyme) 丙酮酸羧化酶基因(pyc),删除催化草酰乙酸消耗的磷酸烯醇式丙酮酸羧化酶基因(pepck),保证重要前体草酰乙酸的供给;3) 过表达天冬氨酸激酶基因(aspC)、二氢吡啶二羧酸还原酶基因(dapA)、二氨基庚酸脱氢酶基因(ddh)和二氨基庚酸羧化酶基因(lysA),保证生物合成流流向赖氨酸;4) 高丝氨酸脱氢酶在59位点(hom59)渗漏突变,实现对分支丝氨酸途径的弱化。5) 利用强启动子Ptuf调控和密码子优化过表达ldcC,最终戊二胺产量达到200 mmol(0.11 g/g葡萄糖),该菌株命名为DAP-3c。若加入赖氨酸脱羧酶的辅酶磷酸吡哆醛,戊二胺产量达到300 mmol(0.17 g/g葡萄糖)。此外,该过程中检测到副产物N-乙酰戊二胺,约占总产物的25%。N-乙酰尸胺是以乙酰-CoA作为乙酰基供体,经NCgl1469催化戊二胺合成的产物[63]。敲除该基因戊二胺产量增加了11%,葡萄糖向戊二胺的摩尔转换率达到30%。然而,副产物的代谢流没有全部流向戊二胺,这可能是受到戊二胺转运的限制造成的。通过全局转录分析 (Global transcription profiling),从35种候选基因中鉴定出cg2893编码的渗透酶可能具有转运戊二胺的功能[64]。敲除该基因戊二胺的分泌降低了90%,而过表达该基因时,戊二胺的产量可提高20%,副产物减少75%。说明增强戊二胺的分泌可以降低戊二胺对赖氨酸脱羧酶的竞争抑制作用,从而提高戊二胺的产量。本实验将cadB克隆至谷氨酸棒杆菌中,与蜂房哈夫尼菌的ldc基因共表达,在谷氨酸棒杆菌合成戊二胺的同时,帮助戊二胺转运至细胞外,解除戊二胺的反馈抑制作用。工程菌合成戊二胺的分泌率较C. glutamicum TK260512/pXMJl9-ldc提高了27%[65],戊二胺的产量也提高了30%。说明CadB可以在谷氨酸棒状杆菌中表达,且可以将戊二胺转运至胞外,进而提高戊二胺的产量。
4)利用非对称孔隙压力场可以提高煤体定向压裂效果,控制水压与水平应力比需要控制在合理的范围内。研究结果表明:鹤壁矿区内,煤岩体水平地应力比在1.0~1.8,控制水压6~12 MPa时定向压裂效果明显。
[18] Sanders J, Scott E, Weusthuis R, et al. Bio-refinery as the bio-inspired process to bulk chemicals. Macromol Biosci, 2007, 7(2): 105–117.
其二,突出各部门各乡镇街道的积极协同配合。由于“五水共治”不单单是水利和环保等部门的工作,而是涉及到乡镇街道等基层组织的工作,所以就需要通过宣传报道营造一种各单位、各部门、各乡镇街道齐心协力、共同为“五水共治”献计出力的氛围。
Buschke等利用谷氨酸棒状杆菌共表达木糖异构酶基因xylA和木酮糖激酶基因xylB并在HCE (High constitutive expression) 启动子调控下过表达cadA,工程菌利用木糖发酵合成戊二胺,戊二胺产量为13.9 mmol/L发酵液,转化率为每mol木糖转化(164.5±6.9) mmol戊二胺,对应每mol碳转化(32.9±1.4) mmol戊二胺[67]。碳源转化为戊二胺的转化率比较低,可能是碳源转化成二氧化碳损失过多,以及木糖的转运机制还不太清楚。为了提高木糖的转化效率和提高戊二胺产量,Buschke等将木糖合成途径中的tkt操纵子过表达并删除戊二胺分解代谢中的lysE和act基因,构建高产戊二胺的谷氨酸棒状杆菌工程菌C. glutamicum DAP-Xyl1 icdGTGPeftufbp Psodtkt Δact ΔlysE,戊二胺产量达到103 g/L[33]。
5 戊二胺研究前景展望
市场上的完全生物基尼龙产品包括聚酰胺11、聚酰胺1010和聚酰胺46。其中聚酰胺11和聚酰胺1010来源于蓖麻油[68],聚酰胺46由糖类发酵得到的产物腐胺和己二酸聚隶属于荷兰DSM公司旗下Stanyl品牌[25]。市场上的部分生物基尼龙产品包括聚酰胺610、聚酰胺1012、聚酰胺410和聚酰胺10T,其他的生物基尼龙还处于研发阶段[68]。2012年,日本味之素公司和东丽实业公司宣布合作开发生物基尼龙原料1,5-戊二胺。由于谷氨酸棒状杆菌和大肠杆菌的遗传背景清楚、生长周期短,为戊二胺的合成研究及工业生产提供了有利依据。然而,无论是大肠杆菌还是谷氨酸棒状杆菌,虽然中心代谢途径的改造在一定程度上提高了戊二胺的产量,但戊二胺的合成量远达不到实际生产要求,还需要大量的基础研究。赖氨酸脱羧酶是胞内酶,戊二胺滞留在胞内造成对赖氨酸脱羧酶的反馈抑制。已知的戊二胺转运蛋白只有大肠杆菌中的赖氨酸-尸胺反向转运蛋白CadB,能够在谷氨酸棒状杆菌中表达,但转化效率还有待提高。而谷氨酸棒状杆菌中cg2893编码的渗透酶也可能具有转运戊二胺的功能,但是谷氨酸棒状杆菌中不止这一种潜在的戊二胺转运蛋白,还可能存在未知的转运蛋白。如果能找到所有的戊二胺转运蛋白,比较其利弊,筛选出表达量最高的蛋白,这对戊二胺的生产具有重大意义。然而,戊二胺的转运量增加了,胞外的戊二胺量会明显增加,这会对细菌的生长造成影响。大肠杆菌在0.2 mol/L戊二胺存在时生长率下降35%,在0.5 mol/L戊二胺存在时仍有菌体生存,但戊二胺浓度在0.3–0.5 mol/L时部分细胞已裂解。大肠杆菌对戊二胺的耐受性低于其对腐胺的耐受性[69]。谷氨酸棒状杆菌在1 mol/L戊二胺浓度时仍能对数生长,生长率下降约67%[27]。因此,明确戊二胺抑制细菌生长的机制,提高谷氨酸棒状杆菌和大肠杆菌对戊二胺的耐受性是亟需解决的问题。
REFERENCES
[1] Tabor CW, Tabor H. Polyamines in microorganisms. Microbiol Rev, 1985, 49: 81–99.
[2] Brieger L. Weitere Untersuchungen über Ptomaine A. Berlin: Hirschwald, 1885.
目前已经克隆的赖氨酸脱羧酶序列很多,尽管缺乏与它们的酶学性质有关的报道,但从构建的系统进化树来看,赖氨酸脱羧酶分属于两个大的类群,其中来源于蜂房哈夫尼菌和大肠杆菌K12的赖氨酸脱羧酶属于一个大的类群,其余来源的赖氨酸脱羧酶来源于另一个大的类群 (图5)。
[4] Hirao T, Sato M, Shirahata A. Covalent link age of polyamines to peptidoglycan in Anaerovibrio lipolytica. Bacteriol, 2000, 182(4): 1154–1157.
[5] Kamio Y, Nakamura K. Putrescine and cadaverine are constituents of peptidoglycan in Veillonella alcalescens and Veillonella parvula. Bacteriol, 1987, 169(6): 2881–2884.
[6] Delavega AL, DelcourAH. Cadaverine induces closing of E. coli porins. EMBO, 1995, 14(23): 6058–6065.
[7] Igarashi K, Kashiwagi K. Modulation of cellular function by polyamines. Int J Biochem Cell Biol, 2010, 42(1): 39–51.
[8] Chattopadhyay MK, Tabor CW, Tabor H. Polyamines protect Escherichia coli cells from the toxic effect of oxygen. Proc Natl Acad Sci USA, 2003, 100(5): 2261–2265.
[9] Samartzidou H, Delour AH. Excretion of endogenous cadaverine leads to a decrease in porin-mediated outer membrane permeability. J Bacteriol, 1999, 18(3): 791–798.
[10] Tkachenko AG, Shumkov AV, Akhova AV. Adaptive functions of Escherichia coli polyamines in response to sublethal concentrations of antibiotics. Microbiol, 2009, 78(1): 25–32.
[11] Manuel J, Zhanel GG, Kievit T. Cadaverine suppresses persistence to carboxypenicillins in Pseudomonas aeruginosa PAO1. Antimicrob Agents Chemother, 2010, 54(12): 5173–5179.
[12] Chen XH, Yu J, Li LL. Advances in study on polyamines during flowering and fruit setting and development in higher plants. Chin Bull Bot, 2003, 20(1): 36–42 (in Chinese).陈学好, 于杰, 李伶利. 高等植物开花结实的多胺研究进展. 植物学通报, 2003, 20(1): 36–42.
[13] Wang XY, Zou Q. Advances in study on polyamines during flowering and fruit setting and development in higher plants. Chin Bull Bot, 2002, 19(1): 11–20 (in Chinese).王晓云, 邹琦. 多胺与植物衰老关系研究进展. 植物学通报, 2002, 19(1) : 11–20.
推荐理由:党的十九大报告明确指出:“中国特色社会主义最本质的特征是中国共产党领导,中国特色社会主义制度的最大优势是中国共产党领导,党是最高政治领导力量。”但不乏有人质疑中国共产党的执政地位。本书对这些怀疑进行了概括,汇总为十个疑问,以通俗易懂的语言、丰富生动的事例,通过分析中国共产党的历史发展与当代建设,以及在新时代的执政理念与施政方略,给予有力的回答。
[14] Casalino M, Latella MC, Prosseda G, et al. Molecular evolution of the lysine decarboxylase defective phenotype in Shigellasonnei. Int J Med Microbiol, 2005, 294: 503–512.
[15] Kiyohiko N, Shuichi E, Yukiko M. Enzymatic method for producing cadaverine dicarboxylate and its use for the production of nylon: Japan, 147688. 2003-05-26.
[16] Deng RS, Wei YF, Chen BN. Polyamide Resin and Its Application. Beijing: Chemical Industry Press, 2002: 124–130 (in Chinese).邓如生, 魏运房, 陈步宁. 聚酰胺树脂及其应用.北京: 化学工业出版社, 2002: 124–130.
[22] Ogunniyi DS. Castor oil: a vital industrial raw material. Bioresource Technol, 2006, 97(9): 1086–1091.
Volkert等通过对代谢途径进行改造,构建了能利用葡萄糖发酵生产戊二胺谷氨酸棒状杆菌工程菌DAP,戊二胺产量达到72 g/L,并从发酵液中分离纯化戊二胺,纯度达到99%以上[66]。
[19] Okino S, Noburyu R, Suda M, et al. An efficient succinic acid production process in a metabolically engineered Corynebacterium glutamicum strain. Appl Microbiol Biot, 2008, 81(3): 459–464.
水利工程管理工作中可能会遇到很多问题,如果这些问题发生了,那么我们能做的就是大胆变通,在原来的管理方法基础上进行创新,创建起和谐的管理模式,不断适应当前的市场经济需求。与此同时,为了更好的提升管理水平,提高竞争力,水利单位应形成自己独有的单位文化,建立属于自己的管理队伍,充分发挥出职工们的工作热情,从整体上提升管理水平。
[20] Oh IJ, Kim DH, Oh EK, et al. Optimization and scale-up of succinic acid production by Mannheimia succiniciproducens LPK7. J Microbiol Biotechnol, 2009, 19(2): 167–171.
[21] Stellmacher R, Hangebrauk J, Wittmann C, et al. Fermentative manufacture of succinic acid with Basfia succiniciproducens DD1 in serum flasks. Chem Lett, 2010, 82(8): 1223–1229.
[17] Lin SS, Weng HS. Liquid-phase oxidation of cyclohexane over CoAPO-5: synergism effect of coreactant and solvent effect. Appl Catal A-Gen, 1994, 118(1): 21–31.
[23] Jiang LL, Wu XY, Liu Y, et al. Fermentation and properties of lysine decarboxylase. Fine Chem, 2006, 23(11): 1060–1067 (in Chinese).蒋丽丽, 吴晓燕, 刘毅, 等. 赖氨酸脱羧酶发酵工艺及酶学性质. 精细化工, 2006, 23(11): 1060–1067.
[24] Velasco AM, Leguina JI, Lazcano A. Molecular evolution of the lysine biosynthetic pathways. Mol Evol , 2002, 55: 445–459.
[25] Schneider J, Wendisch VF. Biotechnological production of polyamines by Bacteria: recent achievements and future perspectives. Appl Microbiol Biotechnol, 2011, 91: 17–30.
[26] Mimitsuka T, Sawai H, Hatsu M, et al. Metabolic engineering of Corynebacterium glutamicum for cadaverine fermentation. Biosci Biotechnol Biochem. 2007, 71(9): 2130–2135.
夹嘴夹持导线提供摩擦力时要求夹持稳定性能可靠,同时还要保证导线不受损伤,因此卡线器夹嘴不应过短。但是,夹嘴过长容易导致卡线器整体尺寸、质量过大,造成搬运和移动不便。导线的夹紧状态如图3所示。
[27] Katinka M, Cossart P, Sibilli L, et al. Nucleotide sequence of the thrA gene of Escherichia coli. Proc Natl Acad Sci USA, 1980, 77(10): 5730–5733.
[28] Zakin MM, Duchange N, Ferrara P, et al. Nucleotide sequence of the metL gene of Escherichia coli. Its product, the bifunctional aspartokinase ii-homoserine dehydrogenase II, and the bifunctional product of the thrA gene, aspartokinase I-homoserine dehydrogenase I, derive from a common ancestor. J Biol Chem, 1983, 258(5): 3028–3031.
[29] Cassan M, Parsot C, Cohen GN, et al. Nucleotide sequence of lysC gene encoding the lysine-sensitive aspartokinase III of Escherichia coli K12. Evolutionary pathway leading to three isofunctional enzymes. J Biol Chem, 1986, 261(3): 1052–1057.
[30] Park JH, Lee KH, Kim TY, et al. Metabolic engineering of Escherichia coli for the production of L-valine based on transcriptome analysis and in silico gene knockout simulation. Proc Natl Acad Sci USA, 2007, 104(19): 7797–7802.
[31] Soksawatmaekhin W, Kuraishi A, Sakata K, et al. Excretion and uptake of cadaverine by CadB and its physiological functions in Escherichia coli. Mol Microbiol, 2004, 51 (5): 1401–1412.
[32] Qian Z, Xia X, Lee SY. Metabolic engineering of Escherichia coli for the production of cadaverine: a five carbon diamine. Biotechnol Bioeng, 2011, 108: 93–103.
青皮药材的HPLC指纹图谱建立及聚类分析和主成分分析…………………………………………………… 靳贝贝等(24):3336
[33] Buschke N, Becker J, Schäfer R, et al. Systems metabolic engineering of xylose-utilizing Corynebacterium glutamicum for production of 1,5-diaminopentane. Biotechnol J, 2013, 8: 557–570.
[34] Meng SY, Bennett GN. Nucleotide sequence of the Escherichia coli cad operon: a system for neutralization of low extracellular pH. J Bacteriol, 1992, 174(8): 2659–2669.
[35] Watson N, Dunyak DS, Rosey EL, et al. Identification of elements involved in transcriptional regulation of the Escherichia coli cad operon by external pH. J Bacteriol, 1992, 174(2): 530–540.
[36] Yamamoto Y, Miwa Y, Miyoshi K, et al. The Escherichia coli ldcC gene encodes another lysine decarboxylase, probably a constitutive enzyme. Genes Genet Syst, 1997, 72 (3): 167–172.
[37] Lemonnier M, Lane D. Expression of the second lysine decarboxylase gene of Escherichia coli. Microbiol, 1998, 144(3): 751–760.
1.搭建学习新平台,增强学习趣味性。公司打破传统的集中学习模式,充分利用宝胜文化杂志、网站、办公OA系统等媒介,建立党员微信群、党建工作交流群,实现党员全覆盖的沟通、交流和学习。公司OA办公系统开设“党建在线”、“党务公开”、“两学一做”等专栏,将党的最新理论、中航最新要求、党员发展等内容及时传达,让新思想新动态在指尖滑动中深入脑海。
[38] Fritz G, Koller C, Burdack K, et al. Induction kinetics of a conditional pH stress response system in Escherichia coli. J Mol Biol, 2009, 393(2): 272–286.
[39] Neely MN, Olson ER. Kinetics of expression of the Escherichia coli cad operon as a function of pH andlysine. J Bacteriol, 1996, 178(18): 5522–5528.
[40] Sabo DL, Boeker EA, Byers B. Purification and physical properties of inducible Escherichia coli lysine decarboxylase. Biochem, 1974, 13(4): 662–670.
[41] Stefan V, Harald H, Andreas K, et al. Process for production of cadaverine by fermentation: German, 2008100053323. 2008-02-01.
从企业管理的激励实践上看,一些企业在处理物质和精神的关系问题上确实存在二者失衡的现象。有的企业义利失衡、金钱崇拜、诚信迷失、潜规则盛行;有的企业员工精神生活沉沦,没有工作热情,对工作、对环境采用冷漠、忽视的态度;有的企业业余生活单调、人际交流贫乏;有的企业“拿着令箭当鸡毛,在执行上级指示的时候打折扣、搞变通”,“内心浮躁,自卑自弃”;有的单位只讲规则、不讲感情,干群关系冷漠,团队凝聚力缺失……如此等等,腐蚀着企业应有的敬业、奉献、拼搏以及创新等良好精神风貌。
[42] Fecker LF, Beier H, Berlin J. Cloning and characterization a lysine decarboxylase gene form Hafnia alvei.Mol Gen Genet, 1986, 203: 177–184.
[43] Lu MH, Li XM, Chen JF, et al. Study on chilling tolerance of cucumber during germination and expression of lysine decarboxylase gene. Sci Agri Sin, 2005, 38(12): 2492–2495 (in Chinese).逯明辉, 李晓明, 陈劲枫, 等.黄瓜发芽期耐冷性与赖氨酸脱羧酶基因表达. 中国农业科学, 2005, 38(12): 2492–2495.
[44] Sakazaki R. The genus Hafnia//Starr MP, Stolp H, Trfiper HG, et al eds. The Prokaryotes. New York: Springer, Berlin Heidelberg, 1981: 1181–1186.
[45] Jiang LL, Liu JZ, Shen YL, et al. Producing cadaverine by cell immobilization of lysine decarboxylase. Fine Chem, 2007, 24(11): 1080–1084 (in Chinese).蒋丽丽, 刘均忠, 沈俞, 等. 用固定化L-赖氨酸脱羧酶细胞制备1,5-戊二胺. 精细化工, 2007, 24(11): 1080–1084.
[46] Takatsuka Y, Yamaguchi Y, Ono M, et al. Gene cloning and molecular characterization of lysine decarboxylase from Selenomonas ruminantium delineate its evolutionary relationship to ornithine decarboxylases from eukaryotes. J Bacteriol, 2000, 6732–6741.
2.1 赖氨酸脱羧酶
[48] Kashiwagi K, Shibuya S, Tomitori H, et al. Excretion and uptake of putrescine by the PotE protein in Escherichia coli. Biol Chem, 1997, 272: 6318–6323.
[49] Kashiwagi K, Kuraishi A, Tomitori H, et al. Identification of the putrescine recognition site on polyamine transport protein PotE. Biol Chem, 2000, 275: 36007–36012.
[50] Qian ZG, Xia XX, Lee SY, et al. Metabolic engineering of Escherichia coli for the production of putrescine: a four carbon diamine. Biotechnol Bioeng, 2009, 104(4): 651–662.
[51] Gong S, Richard H, Foster JW. YjdE (AdiC) is the arginine: agmatine antiporter essential for arginine-dependent acid resistance in Escherichia coli. Bacteriol, 2003, 185: 4402–4409.
[52] Iyer R, Williams C, Miller C. Arginine-agmatine antiporter in extreme acid resistance in Escherichia coli. Bacteriol, 2003, 185: 6556–6561.
[53] Jack DL, Paulsen IT, Saier MH. The amino acid/polyamine/organocation (APC) superfamily of transporters specific for amino acids, polyamines and organocations. Microbiol, 2000, 146: 1797–1814.
[54] Soksawatmaekhin W, Uemura T, Fukiwake N, et al. Identification of the cadaverine recognition site on the cadaverine-lysine antiporter cadB. J Biol Chem, 2006. 281(39): 29213–29220.
[55] Tomitori H, Kashiwagi K, Igarash K. Structure and function of polyamine-amino acid antiporters CadB and PotE in Escherichia coli. Amino Acids, 2012, 42: 733–740.
[56] Kind S, Kreye S, Wittmann C. Metabolic engineering of cellular transport for overproduction of the platform chemical 1,5-diaminopentane in Corynebacterium glutamicum. Metab Eng, 2011, 13: 617–627.
[57] Kind S, Wittman C. Bio-based production of the platform chemical 1,5-diaminopentane. Appl Microbiol Biotechnol, 2011, 91: 1287–1296.
[58] Melzer G, Esfandabadi ME, Franco LE, et al. Flux design: in silico design of cell factories based on correlation of pathway fluxes to desired properties. BMC Syst Biol, 2009, 3: 120.
[59] Nishi K, Endo S, Mori Y, et al. Method for producing cadaverine dicarboxylate: US 7189543 B2. 2007-3-13.
[60] Tateno T, Okada Y, Tsuchidate T, et al. Direct production of cadaverine from soluble starch usingCorynebacterium glutamicum coexpressing alpha-amylase and lysine decarboxylase. Appl Microbiol Biotechnol, 2009, 82: 115–121.
[61] Niu T, Li M, Zhang JH, et al. Construction of recombinant Corynebacterium glutamicum producing 1,5-pentanediamine by one step method. China Biotechnol, 2010, 30(8): 93–99 (in Chinese).牛涛, 黎明, 张俊环, 等. 一步法生产1,5-戊二胺谷氨酸棒杆菌基因工程菌的构建. 中国生物工程杂志, 2010, 30(8): 93–99.
[62] Park JH, Lee SY. Towards systems metabolic engineering of microorganisms for amino acid production. Curr Opin Biotechnol, 2008, 19: 454–460.
[63] Kind S, Jeong WK, Schröder H, et al. Systems-wide metabolic pathway engineering in Corynebacterium glutamicum for bio-based production of diaminopentane. Metab Eng, 2010, 12(4): 341–351.
[64] Kind S, Jeong WK, Schröder H, et al. Identification and elimination of the competing N-acetyldiaminopentane pathway for improved production of diaminopentane by Corynebacterium glutamicum. Appl Environ Microbiol, 2010b, 76(15): 5175–5180.
[65] Huang YY, Li M, Liu M, et al. Construction and transformation of Corynebacterium glutamicum expression vector of cadaverine-lysine antiporter cadB gene. Biotechnol Bull, 2012(8): 94–100 (in Chinese).黄云雁, 黎明, 刘萌, 等. 赖氨酸-尸胺反向转运蛋白cadB基因谷氨酸棒杆菌表达载体的构建及转化.生物技术通报, 2012(8): 94–100.
[66] Volkert M, Zelder O, Ernst B, et al. Method for fermentively producing 1,5-diaminopentane: US, 20100292429, 2010-11-18.
[67] Buschke N,Schroder H,Wittmann C. Metabolic engineering of Corynebacterium glutamicum for production of 1,5-diaminopentane from hemicelluloses. Biotechnol J, 2011, 6: 306–317.
[68] Ji D, Fang Z, Ouyang PK, et al. Progress in bio-based polyamides. Chin J Biopro Eng, 2011, 6: 306–317 (in Chinese).季栋, 方正, 欧阳平凯, 等. 生物基聚酰胺研究进展. 生物加工过程, 2013, 11(2): 73–80.
[69] Limsuwun K, Jones PG. Spermidine acetyltransferase is required to prevent spermidine toxicity at low temperatures in Escherichia coli. Bacteriol, 2000, 182(19): 5373–5380.
(本文责编 郝丽芳)
Progress in biosythesis of diaminopentane
Dongxia Li, Ming Li, Hongxin Wang, Shuya Wang, and Fuping Lu
Key Laboratory of Industrial Fermentation Microbiology, Ministry of Education, National Engineering Laboratory for Industrial Enzymes, Tianjin Key Laboratory of Industrial Microbiology, College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China
Air pollution and global warming are increasingly deteriorating. Large amounts of polyamides derived from fossil fuel sources are consumed around the world. Cadaverine is an important building monomer block of bio-based polyamides, thus biotechnological processes for these polymers possess enormous ecological and economical potential. Currently, the engineered strains for biological production of cadaverine are Corynebacterium glutamicum and Escherichia coli. We review here the latest research progress of biosynthesis of cadaverine including metabolism of cadaverine in microorganisms, key enzymes and transport proteins in cadaverine synthesis pathway, optimum pathways and cadaverine yields.
cadaverine, Corynebacterium glutamicum, Escherichia coli, lysine decarboxylase (LDC), cadaverine-lysine antiporter (CadB)
May 18, 2013; Accepted: August 20, 2013
Ming Li. Tel: +86-22-60601958; Fax: +86-22-60602298; E-mail: liming09@tust.edu.cn
李东霞, 黎明, 王洪鑫, 等. 生物法合成戊二胺研究进展. 生物工程学报, 2014, 30(2): 161-174.
Li DX, Li M, Wang HX, et al. Progress in biosythesis of diaminopentane. Chin J Biotech, 2014, 30(2): 161-174.
Supported by: National Natural Science Foundation of China (No. 21176190), Key Technology Research and Development Program of Tianjin, China (No. 11ZCKFSY00900), Tianjin Research Program of Application Foundation and Advanced Technology (No. 11JCYBJC09600), Changjiang Scholars and Innovative Research Team (No. IRT1166).
国家自然科学基金(No. 21176910), 天津市科技支撑计划 (No. 11ZCKFSY00900), 天津市应用基础及前沿技术研究计划(No. 11JCYBJC 09600), 长江学者与创新团队项目(No. IRT1166) 资助。

