螺旋藻对阿霉素肾硬化大鼠肾脏的保护作用*
孙 晓 王兆华 王 蕾
(泰山医学院附属泰山医院,山东 泰安 271000)
螺旋藻作为一种天然的海洋中药,近年研究发现螺旋藻具有多种医疗价值。国外有研究证实螺旋藻可防治药物和重金属对肾脏的毒性。国内研究证实螺旋藻对大鼠实验性肝纤维化有预防作用。由于人类的器官纤维化具有共同的病理基础,而人类的慢性肾衰竭的病理基础主要是肾纤维化。螺旋藻的详细的作用机理不清楚,我们通过建立阿霉素肾硬化模型,观察螺旋藻对实验性肾硬化的影响,探讨螺旋藻防治肾小球硬化可能的机理。
1 材料与方法
1.1材料 试剂:螺旋藻由山东天顺药业股份有限公司赠送,贝那普利购自北京诺华制药有限公司。SABC免疫组化染色试剂盒、DAB显色试剂盒购自武汉博士德公司。阿霉素(ADR)系意大利法玛西亚普强公司生产。实验动物:成年SD雄性大鼠32只,体重250~280 g,购自山东大学实验动物中心。
1.2实验动物模型制作 参照参考文献[1]制作动物模型,实验动物随机分为4组,每组8只大鼠。分为假手术组(S组),阿霉素肾硬化大鼠模型分为模型对照组(M组):首次尾静脉注射阿霉素后,每天等量生理盐水灌胃,贝那普利治疗组(B组):首次尾静脉注射阿霉素后,每天用贝那普利4 mg·kg-1灌胃,螺旋藻组(SP组):首次尾静脉注射阿霉素后,每天用螺旋藻1.5 g·kg-1灌胃。8周后处死所有实验动物。取部分肾组织置于10%福尔马林中,制作石蜡切片,其余肾组织直接置于液氮中冷冻后再转入-70℃冰箱中保存备用。
1.3血尿指标检测 动物处死前置于代谢笼中留取24 h尿液,常规实验室方法检测24 h尿蛋白定量,肝功,肾功,血糖,血脂等生化指标。
1.4肾组织病理检查 标本甲醛固定,石蜡包埋,3 μm厚度切片做HE、PAS染色,采用JD801形态学图像分析系统分析,每张切片20倍物镜下至少取20个肾小球,计算肾小球基质与肾小球面积之比,即为肾小球基质相对面积。肾组织病变程度采用半定量积分法评估肾小球硬化程度。计算肾小球硬化指数(GSI)。
1.5肾组织免疫组化 采用SABC法检测肾组织中FN、Col IV、TGF-β1。采用JD801形态学图像分析系统进行分析。
1.6RT-PCR测定肾组织TGF-βmRNA表达Trizol法提取总RNA(Gibco公司),逆转录成cDNA(Invitrogen逆转录试剂盒)。β-actin为内参照。引物由上海博亚生物技术有限公司设计合成。TGFβ1(扩增长度294 bp)引物序列:上游引物5’-CGCAACAACGCAATCTAT-3’;下游引物5’-ATTCCGTCTCCTTGGTTCAG-3’。 β-actin(扩增长度429 bp)引物序列:上游引物5’-AGAGGGAAATCGTGCGTGAC-3’;下游引物5’-CTAGGAGCCAGGGCAGTAATC-3’。扩增调节为94℃ 5 min,94℃ 1 min,55℃ 1 min,72℃ 1 min,共35个循环,最后72℃延伸7 min。PCR产物经2%琼脂糖凝胶电泳,再用BIORAD凝胶成像分析系统分析,以待测指标与β-actin吸光度的比值表示其相对含量。

2 结 果
2.1血尿生化指标的变化 见表1。表中可以看出,SP组、B组分别与M组、S组比较,24小时尿蛋白定量、BUN、Scr明显下降,差异有统计学意义。SP和B组之间差异无统计学意义。SP组、B组、M组与S组比较,TP、A明显减少,差异有统计学意义,而SP组、B组与M组间比较差异无统计学意义。SP组、B组、M组与S组比较,CH、TG明显增加,差异有统计学意义,而SP组、B组与M组间比较差异无统计学意义。
2.2肾组织病理的变化 见图1。光镜下,假手术组结构基本正常。M组和S组明显不同,M组肾小球有明显的节段性和球性硬化,肾小管和间质纤维化。SP组和B组表现基本相同。

表1 各组间生化指标的比较
注:*P<0.01 vs S组;#P<0.01 vs M组。

图1 各组大鼠肾组织HE染色(×200)
2.3GSI与细胞外基质的检查和定量分析 见表2。PAS染色中基质与肾小球面积之比及GSI显示,SP组、B组明显低于M组,但大于S组,差异有统计学意义。SP与B组差异无统计学意义。
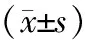
表2 各组大鼠之间基质相对面积及肾小球硬化指数
注:*P<0.01 vs S组;#P<0.01 vs M组。
2.4肾组织免疫组化 见表3。SP组、B、M组FN、Col IV、TGF-β1的表达明显高于S组,SP组、B组FN、Col -IV、TGF-β1表达明显低于M组。

表3 各组大鼠免疫组化指标
注:*P<0.01 vs S组;#P<0.01 vs M组。
2.5肾组织TGF-β1mRNA的表达 见表4。SP组、B、M组TGF-β1mRNA的表达明显高于S组,SP组、B组TGF-β1mRNA表达明显低于M组。

表4 各组大鼠TGF-β1mRNA的表达
注:*P<0.01 vs S组;#P<0.01 vs M组。
3 讨 论
肾小球硬化是终末期肾小球病变的常见表现,其病理特征为肾小球固有细胞数目减少及细胞外基质积聚。肾小球细胞增殖在肾小球硬化进程中发挥着重要作用。基质增生是肾小球硬化早期形态学改变之一,包括FN、Col-Ⅳ等。基质联系最密切的是TGF-β,它已被公认是器官纤维化的治疗靶标。其中TGF-β1在细胞增殖及纤维化中具有重要作用,在促进基质沉积和组织硬化中是关键的细胞因子之一[1-2]。积极探讨药物对肾保护功能的机制,延缓肾功能进展是目前临床肾脏病研究的热点。蓝色海洋是人类生命的摇篮,从海洋中寻找肾功能保护的活性成分已被大多数专家认可。近年螺旋藻的肾保护作用备受关注。螺旋藻富含藻多糖、藻蓝蛋白、γ-亚油酸等多种活性成分,目前已发现螺旋藻具有降低血压,降低血脂,抗氧化等,对庆大霉素、顺铂、环孢素的肾毒性具有保护作用[3-5]。
我们已经成功的制备阿霉素肾硬化大鼠模型[6],造模成功后,模型组肾小球出现节段性球性硬化,肾小管肾间质纤维化,临床指标上,假手术组和造模组比较,24小时尿蛋白明显增加,肾功能减退,说明造模成功。本实验应用螺旋藻后,能明显降低24小时尿蛋白定量,降低BUN、Scr水平,能减轻肾脏病理损害,说明螺旋藻对阿霉素肾硬化大鼠模型具有保护作用。
本实验表明,与阿霉素肾硬化模型比较,螺旋藻能能明显减少肾脏基质的产生,减少肾皮质中FN、Col-IV、TGF-β1的产生,与贝那普利组比较差异无统计学意义,说明螺旋藻在延缓肾小球硬化方面有一定的保护作用。螺旋藻通过抑制系膜基质及细胞因子的产生起到保护阿霉素肾硬化大鼠的作用,其具体作用机制不清楚。复习文献,关于螺旋藻对器官的保护作用有[7-12]:免疫调节,抗氧化,调节血糖,调节血脂,抗炎,抗肿瘤,对血液系统具有保护作用,另外对放射性引起的机体损伤也有保护作用。
综合实验结果,认为螺旋藻可减少阿霉素肾硬化大鼠的尿蛋白,降低BUN和Scr,减轻肾小球系膜基质增生,减轻病理损害,减轻肾脏FN、Col-IV,TGF-β1的表达,减少肾脏TGF-β1mRNA的表达,延缓肾小球硬化,对肾脏具有保护作用。
[1] Lee S, Sharma K.The pathogenesis of fibrosis and renal disease in scleronderma: recent insights from glomerulosclerosis[J].Curr Rheumatol Rep, 2004, 6(2): 141-148.
[2] Zhang S, Fei T, Zhang L, et al.Smad antagonizes transforming growth factor beta signaling in the nucleus by interfering with functional Smad-DNA complex formation[J].Mol Cell Biol, 2007, 27(12): 4488-4499.
[3] Kuhad A, Tirkey N, Pilkhwal S, et al.Effect of Spirulina, a blue green algae, on gentamicin-induced oxidative stress and renal dysfunction in rats [J].Fundam Clin Pharmacol, 2006, 20(2): 121-128.
[4] Karadeniz A, Yildirim A, Simsek N, et al.Nejdet Simsek, et al.Spirulina platens is protects against gentamicin-induced nephrotoxicity in rats [J].Phytotherapy Research, 2008, 22 (11): 1506-1510.
[5] Kuhad A, Tirkey N, Pilkhwal S, et al.Renoprotective effect of Spirulin a fusiform is on cisplatin-induced oxidative stress and renal dysfunction in rats[J].Renal Failure, 2006, 28 (3): 247-254.
[6] 王兆华,胡昭,甄军晖,等.褐藻多糖硫酸酯对阿霉素肾病肾硬化大鼠肾脏的保护作用[J].中国中西医结合肾病杂志,2006,7(8):421-423.
[7] Belay A.The potential application of Spirulina (Arthrospora) as a nutritional and therapeutic supplement in health management[J].JANA, 2002, 5: 27-48.
[8] Reddya CM, Bhatb VB, Kiranmaia G,et al.Selective Inhibition of Cyclooxygenase-by C-Phycocyanin, a Biliprotein from Spirulina platensis[J].Biochem Biophys Res Commun, 2000, 277: 599-603.
[9] Mittal A, Suresh KP, Banerjee S, et al.Modulatory potential of Spirulina fusiformis on carcinogen metabolizing enzymes in swiss albino mice[J].Phytother Res, 1999,13: 111-114.
[10] Sharma MK, Sharma A, Kumar A, et al.Spirulina fusiformis provides protection against mercuric chloride induced oxidative stress in Swiss albino mice[J].Food Chem Toxicol, 2007, 45(12): 2412-2419.
[11] Sharma MK, Patni R, Kumar M, et al.Modification of mercury-induced biochemical alterations in blood of Swiss albino mice by Spirulina fusiformis[J].Environ Toxicol Pharmacol, 2005, 20(2):289-296.
[12] Qureshi MA, Kidd MT, Ali RA.Spirulina platensis extract enhances chicken macrophage functions after in vitro exposure[J].J Nutritional Immunol, 1995, 3(4): 35-45.

