鸡毒支原体F弱毒疫苗株细胞免疫特性研究
林伯全,徐 磊,杨 慧,林秋敏
(福建农业职业技术学院动物科学系,福州350119)
鸡毒支原体(Mycoplasma gallisepticum, MG)感染,也称鸡败血霉形体感染或慢性呼吸道病(chronic respiratory disease, CRD)[1,2]。MG流行于全世界鸡场中,在中国各省市鸡群中也有很高的感染率,并造成了重大经济损失[3-5]。MG F株是一个良好的弱毒制苗菌株,已有很多相关的研究报道[6-8]。本试验应用流式细胞技术及T淋巴细胞增殖试验,研究了MG F株免疫后鸡淋巴细胞亚类及T淋巴细胞增殖率的动态变化规律,为MG F株免疫机理的研究及更有效预防MG提供依据。
1 材料和方法
1.1 疫苗株 MG弱毒F株由本实验室保存,活菌数达到109ccu/mL。
1.2 主要试剂及仪器 PE标记的鼠抗鸡CD3、CD4和CD8单克隆抗体(mAb)购自SoutherBiotech公司;链酶亲和素标记的磁球(MagCellect Streptavidin Ferrofluid)购自R&D Systems公司;红细胞裂解液购于美国BD公司;PHA-P及MTT购自Sigma公司;淋巴细胞分离液购自天津灏洋生物工程公司;流式细胞仪为美国BD公司FASCalibur。
1.3 实验动物 SPF种蛋于动物饲养隔离器内孵化,雏鸡4日龄时,颈静脉采血,选取MG抗体阴性的雏鸡120羽。3 d后,随机分为3组,每组40只,隔离饲养。
1.4 实验设计 将MG F株的新鲜培养物(109ccu/mL)分别以原倍和10-3稀释(106ccu/mL)的2个不同活菌浓度的菌液,各用0.033 mL/只点眼接种7日龄SPF鸡,分别为A、B组;使用生理盐水点眼的SPF鸡为C组。点眼前3 d及点眼后1、3、5、7、14、21、28 d,各组依次抽取不重复的5羽SPF鸡,经颈静脉采集抗凝血,进行淋巴细胞亚类比值及T淋巴细胞增值率测定。所得数据用单因素方差分析和最小显著性差法(LSD)分析,P<0.05为差异具有显著统计学意义。
1.5 淋巴细胞亚类比例的测定 经预试验确定检测方案,将肝素抗凝血150 μL与10倍稀释的红细胞裂解液1.5 mL,充分混匀,室温放置5 min。用PBS洗涤除去红细胞裂解液,然后用1.5 mL PBS重悬细胞,加入预先与MagCellect Streptavidin Ferrofluid结合的PE标记的鼠抗鸡CD3、CD4和CD8 mAb各10、3、5 μL,避光冰浴孵育30 min,经流式细胞仪检测,每个样品检测10 000个淋巴细胞。
1.6 T淋巴细胞增值率测定 经预试验确定检测方案,将抗凝血经淋巴细胞分离液分离,所得淋巴细胞用含100 mL/L犊牛血清的完全1640培养液配制成原始浓度为8×106个/mL的细胞悬液。96孔细胞培养板上,每组设试验孔(淋巴细胞悬液150 μL、50 μg/mL PHA-P 50 μL)、对照孔(淋巴细胞悬液150 μL、完全RPMI-1640培养基50 μL)、空白孔(完全培养基200 μL)各3孔。将培养板置于40℃的CO2培养箱中培养68 h后,每孔加入5 mg/mL的MTT 15 μL,再培养4 h,然后每孔加入100 μL二甲基亚矾,10 min后用酶标仪以490 nm为测量波长,以630 nm为参考波长,测得OD值。T淋巴细胞增值率用刺激指数(SI)表示,SI =(试验组OD值-空白组OD值)/(对照组OD值-空白组OD值)。
2 结果与讨论
2.1 淋巴细胞亚类比例的测定 CD3+CD4+CD8-/CD3+比例,C组维持在31%左右;A组于免疫3 d后开始明显增加,于d5、d7达到峰值(分别为46%、47%),并显著高于其他组(P<0.05);B组于免疫5 d后开始明显增加,于d7 达到峰值(39%),并显著高于C组(图1A)。
CD3+CD4-CD8+/CD3+比例,C组维持在17%左右;免疫7 d后,A组及B组开始明显增加,都于d14达到峰值(分别为35%、26%)。其中,免疫后d7、d14,A组显著高于B组(P<0.05),B组显著高于C组(P<0.05)(图1B)。
CD3+CD4+CD8-/ CD3+CD4-CD8+比例,A、B、C组均维持在1.7~1.8左右;各组差异不具有显著统计学意义(P>0.05)(图1C)。
淋巴细胞亚类比例测定试验中,CD3+为T淋巴细胞,CD3+CD4+CD8-为Th细胞,CD3+CD4-CD8+为Tc细胞[9]。A组免疫3 d后,B组免疫5 d后,Th/T明显增高,免疫7 d后A、B组均Tc/T明显增高,表示Th和Tc在T细胞中的比例显著增加,机体的抗感染免疫增强。Th/T、Tc/T由高至低依次为A、B、C组,免疫后d7,各组Th/T差异具有显著统计学意义(P<0.05),免疫后d7、d14各组Tc/T差异具有显著统计学意义(P<0.05)。Th/Tc是评估机体免疫状态的依据之一,是机体免疫内环境稳定最重要的指标[10],免疫后A、B、C组Th/Tc维持稳定验证了MG F株免疫安全性。淋巴细胞亚类比例测定结果显示MG F株可通过提高Th/T及Tc/T来提高鸡的细胞免疫作用,且MG F 株活菌浓度与接种鸡外周血Th/T、Tc/T呈正相关。
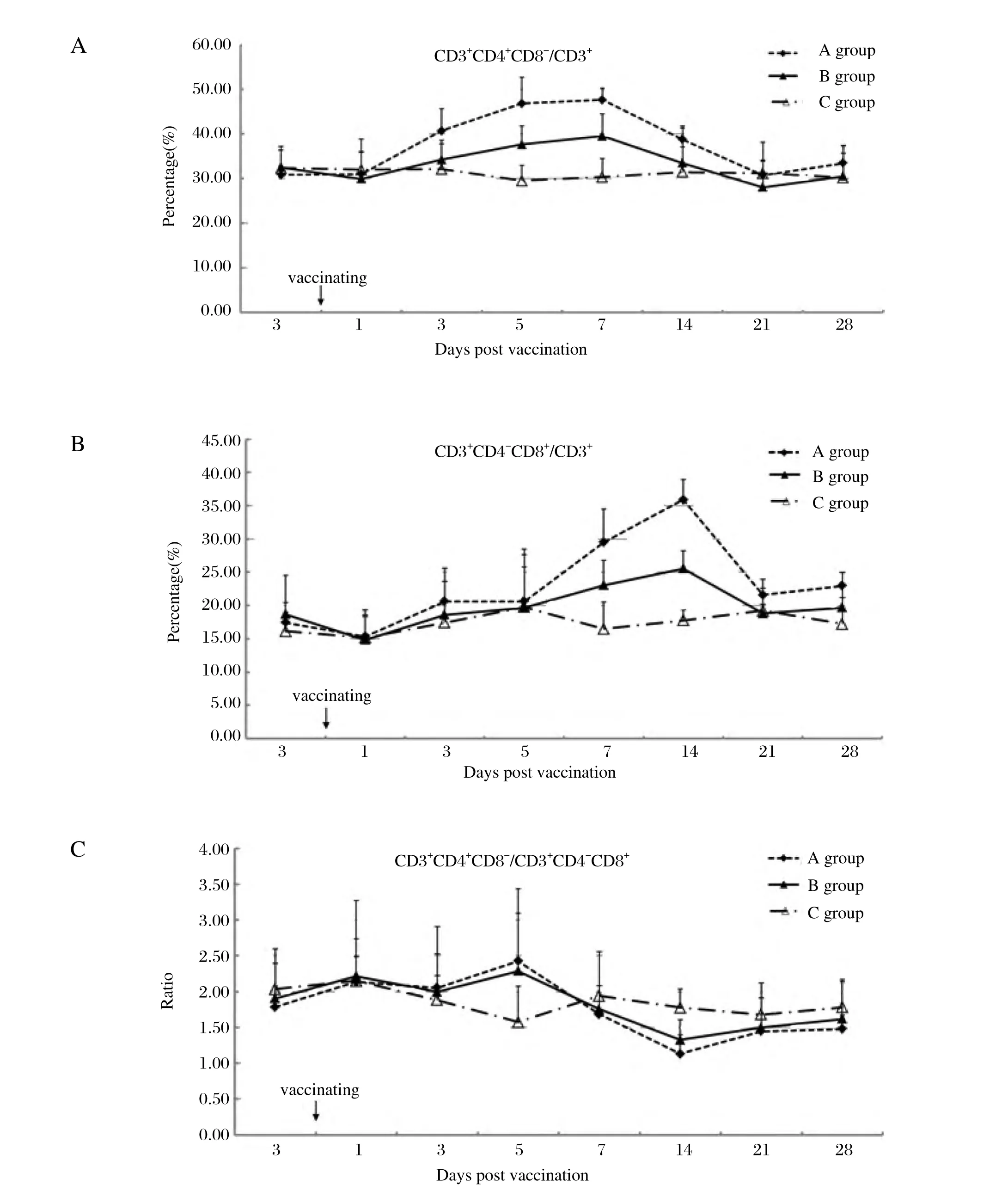
图1 免疫后各组实验鸡外周血淋巴细胞亚类的变化Fig. 1 Levels of lymphocyte subpopulations in PBMCs after vaccination
2.2 T淋巴细胞增值率测定 SI值,C组维持在1.3左右;A组于免疫d5开始明显增加,于d 7、14达到峰值(都为1.9),并显著高于其他组(P<0.05);B组于免疫7 d后开始明显增加,于d14 达到峰值(1.6),并显著高于C组(图2)。
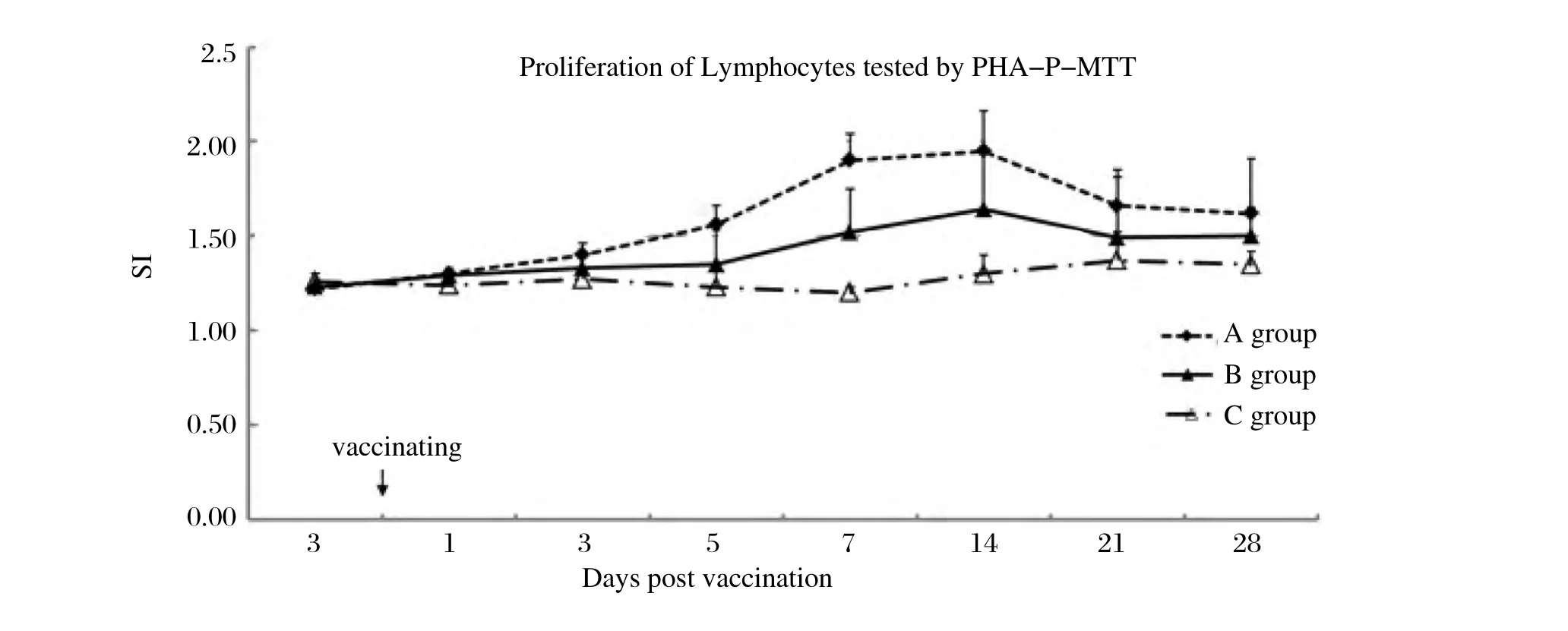
图2 免疫后各组实验鸡外周血T淋巴细胞增值率的变化Fig. 2 Levels of proliferation of lymphocytes in PBMCs after vaccination
SI反映机体细胞免疫功能的水平[11],A、B组分别于免疫后d5、d7 后SI明显增加,SI由高至低依次为A、B、C组,免疫后d14各组差异具有显著统计学意义(P<0.05)。T淋巴细胞增殖试验结果显示MG F株可通过提高SI来提高鸡的细胞免疫作用,且MG F 株活菌浓度与接种鸡外周血Th/T、Tc/T呈正相关。
本研究从淋巴细胞亚类比值及T淋巴细胞增殖率2个方面综合评价,免疫MG F株可较好的提高鸡的细胞免疫作用,且MG F 株活菌浓度与接种鸡外周血Th/T、Tc/T呈正相关。
[1]Nicolet J. Animal mycoplasmoses: a general introduction[J]. Rev Sic Tech, 1996,15(4): 1233-1240.
[2]Bradbury J M, Abdul-Wahab O M, Yavari C A, et al.Mycoplasma imitans sp. nov. is related to Mycoplasma gallisepticum and found in birds[J].Int J Syst Bacteriol,1993, 43(4): 721-728.
[3]徐磊, 林伯全, 林平, 等. 鸡毒支原体病的预防技术[J]. 福建畜牧兽医, 2013, 35(3): 36-38.
[4]冀锡霖, 宁宜宝. 鸡感染鸡毒霉形体和滑液霉形体情况的调查[J]. 中国兽医科技, 1986(2): 21-23.
[5]王承宇, 宣华. 鸡毒支原体病研究进展[J]. 中国预防兽医学报, 2000, 22(增刊): 208-211.
[6]宁宜宝. 鸡败血霉形体弱毒F株对鸡的致病性和免疫效力测定[J]. 中国兽医学报, 1999, (3): 264-266.
[7]宁宜宝. 鸡败血霉形体F-36株的稳定性测定[J]. 中国兽医学报, 1999, (5): 462-463.
[8]丁亮. 鸡毒支原体F弱毒疫苗对肉鸡生长及免疫性能影响的研究[D]. 合肥: 安徽农业大学, 2011.
[9]徐磊, 陈晟生, 张如梅, 等. 短肽佐剂对猪繁殖与呼吸综合征病毒弱毒疫苗CH-1R株的免疫增强作用研究[J]. 中国预防兽医学报, 2013, 35(6): 495-499.
[10]徐磊. 猪瘟兔化弱毒细胞苗和脾淋苗细胞免疫效果的比较[D]. 福州: 福建农林大学, 2009.
[11]高云航猪瘟超前免疫效果综合评价[D]. 长春: 吉林农业大学, 2007.

