利用PiggyBac转座系统构建稳定表达鹅RIG-I的DF-1细胞系
胡 跃,孙英杰,王晓旭,仇旭升,宋翠萍,谭 磊,胡桂学,丁 铲
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所,上海 200241;3.安徽农业大学动物科技学院,合肥 223006)
利用PiggyBac转座系统构建稳定表达鹅RIG-I的DF-1细胞系
胡 跃1,孙英杰2,王晓旭3,仇旭升2,宋翠萍2,谭 磊2,胡桂学1,丁 铲2
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院上海兽医研究所,上海 200241;3.安徽农业大学动物科技学院,合肥 223006)
维甲酸诱导基因-I(retinoic acid inducible gene-I,RIG-I)是最近几年发现的一种细胞内模式识别受体,能够特异性的识别并结合病毒RNA,进而发挥抗病毒效应。RIG-I在进化中相对保守,但已有报道和我们的前期研究显示:家禽中鸭和鹅体内均有RIG-I受体,但鸡却缺乏RIG-I受体。为了研究这种天然缺失对鸡是否有不利影响,本研究利用PiggyBac转座系统将鹅源RIG-I转染入鸡胚成纤维细胞系DF-1,两次亚克隆后获得单个克隆,以荧光、RT-PCR及Western blot进行鉴定,最终获得稳定表达鹅RIG-I的DF-1细胞系,为进一步研究鸡的先天性免疫机制和鹅RIG-I的功能打下基础。
鹅维甲酸诱导基因-I;鸡胚成纤维细胞系DF-1;PiggyBac转座系统
先天性免疫是机体对抗外来病原微生物侵害的第一道屏障,而在感染初期模式识别受体(pattern recognition receptors,PRRs)识别病原微生物入侵机体后复制过程中产生的一些保守组分,即病原体相关分子模式(pathogen associated molecular patterns,PAMPs),是有效发挥先天性免疫反应的第一步[1]。机体内的PRRs目前主要分为四大家族:Toll样受体家族(Toll-like receptors,TLRs),RIG-I样受体家族(RIG-I like receptors,RLRs),NOD样受体家族(NOD-like receptors,NLRs)和C型外源凝集素受体(C-typed lectin receptors,CLRs)[2]。
维甲酸诱导基因I(retinoic acid inducible gene-I,RIG-I),又称为视黄酸诱导基因I,2004年由日本科学家Takahashi首先发现。RIG-I是细胞质内蛋白,N端是两个串联的半胱天冬酶活化募集结构域(caspase activation and recruitment domain,CARD),中间部分为具有DExD/H盒的RNA解旋酶结构域,包含与ATP结合的关键位点,C端是与RNA结合的结构域(RNA-binding domain)和抑制结构域(repressor domain,RD),其中具有RNA识别、信号抑制功能的区域,又称为C末端结构域(C-terminal domain,CTD)。虽然RIG-I基因在进化中相对保守,但在鸡的基因组中并不存在RIG-I的核苷酸序列,这意味着鸡先天性缺失这一模式识别受体[3,4]。鸡是我国各地普遍饲养的一种重要的经济动物,与鸡相比,鸭和鹅对许多病毒都有较强的抵抗力,如新城疫病毒(Newcastle disease virus,NDV)、禽流感病毒(Avian influenza virus,AIV),目前已有研究表明NDV、AIV侵入机体后,病毒复制时所产生的RNA主要由RIG-I负责识别、结合[5,6],激活先天性免疫反应,发挥抗病毒作用。
PiggyBac(PB)转座子属于DNA转座子,能够针对基因组TTAA位点进行基因插入,具有较高的转座效率。PB转座系统是一种比较理想的非病毒载体,与病毒载体相比,其安全性高、成本低、载体容量大,且操作相对简单,转座效率高、转座后可切离、转座后不引起染色体重排等现象,是目前较理想的转基因载体。为了便于研究鸡对于RIG-I的先天性缺失是否使鸡对于NDV、AIV以及其他病毒更易感,本研究利用PiggyBac转座系统构建了稳定表达鹅源RIG-I基因的鸡传代细胞系,为后续研究打下基础。
1 材料和方法
1.1 细胞DF-1细胞由扬州大学秦爱建教授馈赠,用含10%胎牛血清(fetal bovine serum, FBS)的DMEM培养基培养;原代鸡胚成纤维细胞(chicken embryo fibroblast,CEF)用含10%FBS的DMEM培养基培养;本研究中所用的鸡胚为北京梅里亚维通实验动物技术有限公司产品。
1.2 载体和试剂PiggyBac转座系统由西北农林科技大学周恩明教授馈赠;嘌呤霉素、氨苄青霉素、人β-actin抗体为Sigma公司产品;质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒为天根生化科技有限公司产品;内切酶为TaKaRa公司产品;KOD酶为TOYOBO公司产品;转染试剂lipofectamine 2000为life Technologies公司产品;蛋白酶抑制剂PMSF、叠氮钠、Western及IP细胞裂解液、增强型BCA蛋白浓度检测试剂盒、一抗二抗去除液、显影液定影试剂盒为中国碧云天生物技术研究所产品;鹅RIG-I多克隆抗体为本实验室制备。
1.3 引物设计参照GenBank中鹅源RIG-I的CDS(GenBank登录号:HQ829831.1),设计了包含酶切位点Xba I和EcoR I的扩增引物,以及用于RT-PCR鉴定的特异性鉴定引物。同时针对PiggyBac载体序列设计了一对特异性鉴定引物,以及包含RIG-I及部分载体的鉴定引物。上述3对鉴定引物均通过BLAST特异性验证,引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1。
1.4 细胞敏感性实验分别配制嘌呤霉素终浓度为1~10 μg/mL的含5%FBS的DMEM培养基。在24孔板内饲养DF-1细胞,待细胞长至80%左右时更换为含药物的培养基,每个浓度设4个重复,每块6孔板设1组正常培养基为对照组。每24 h观察细胞形态并记录,每3 d更换培养基,持续8 d。
1.5 PiggyBac-RIG-I质粒的构建和鉴定鹅源RIG-I扩增的PCR体系按照KOD-Plus-Neo DNA Polymeraes使用说明配置:10×PCR Buffer for KOD-Plus-Neo 5 μL、2 mmol/L dNTPs 5 μL、25 mmol/L MgSO43 μL、上下游引物各1 μL、模板(Flag-RIG-I[7])1 μL、灭菌蒸馏水33 μL。反应程序为94℃预变性2 min;98℃变性10 s,55℃退火30 s,68℃延伸2 min,30个循环;72℃延伸10 min。产物通过琼脂糖凝胶电泳分离回收大小为2.8 kb左右条带,并进行纯化。将得到的RIG-I片段经Xba I/EcoR I酶切后,连入PiggyBac513B-1载体,转化TOP10感受态细胞。取200 μL细胞转化菌液涂布于含100 mg/L 氨苄青霉素的LB平板上,37℃孵育过夜,挑取单菌落扩大培养。采用菌液PCR,琼脂糖凝胶电泳筛选阳性克隆,命名为PR-RIG-I,送生工生物工程(上海)股份有限公司测序。
1.6 CEF的制备取10日龄SPF鸡胚,用碘酒和酒精棉球消毒蛋壳,无菌操作下打开气室,去壳后掀开壳膜,取出胚体放入平皿中,用无血清DMEM培养基清洗1遍,去除头、尾、四肢、骨头、内脏。将胚体放于小烧杯中,用剪刀剪碎,1000×g离心3~5 min,弃上清;用3~5倍细胞体积的浓度为0.25%的胰酶悬浮,放置15 mL离心管中,颠倒数次,至形成云雾状;用含10%血清的DMEM培养基终止消化,1000×g离心3~5 min,弃上清,下层细胞加入一定量的含10%血清的DMEM培养基,用力吹打后待其沉淀,吸取上清加到漏斗中进行过滤;将滤液分装在75 cm2细胞瓶中(根据细胞数量而定),置37℃培养。
表1 本研究所用引物Table 1 Primers used in this study
1.7 表达RIG-I的DF-1的构建将长满单层的DF-1细胞1.5×105个/mL接种于6孔板中,用含10% FBS的DMEM培养基在细胞培养箱中培养,待细胞长满至约80%时共转染PR-RIG-I及PiggyBac系统辅助质粒PB200PA-1,转染24 h后更换药物培养基压力筛选,每3 d更换培养基,持续筛选7 d。7 d后以CEF为饲养细胞进行亚克隆,以PiggyBac系统自带的绿色荧光作为鉴定依据,挑取阳性株进行第二次亚克隆。第二次亚克隆后的阳性株扩大培养,持续传代,收集第1、5、10、15、20、30代细胞,进行后续鉴定。两次亚克隆后,以相同转染方法转染空载体,药物筛选后扩大培养,收集细胞,作为后续鉴定的对照组。
1.8 RT-PCR鉴定加1 mL Trizol到细胞样品中,重悬细胞,室温放置10 min;加入200 μL氯仿,震荡混匀,室温静置15 min;4℃、12 000×g离心10 min,将上清转移至无RNase的离心管中;加入等体积的异丙醇沉淀RNA,-20℃放置20 min,4℃、12 000×g离心10 min,弃去上清;加1 mL70%乙醇洗涤沉淀,4℃、12 000×g离心5 min,去除上清;吹干后加入无RNase水溶解RNA,并测定浓度。反转录参照Promega公司Reverse Transcription System方法进行,最终获得cDNA。以获得的cDNA为模板,利用3对特异性引物进行PCR鉴定。
1.9 Western blot鉴定加200 μL含PMSF的细胞裂解液到细胞样品中,用枪头反复吹打细胞数次,冰上静置10 min后超声破碎,4℃、12 000×g离心5 min,取上清,按比例加入5×上样缓冲液,沸水中煮沸10 min,室温12 000×g离心5 min,进行SDS-PAGE电泳,80V恒压电泳,样品进入分离胶时将电压调至120V,电泳后将凝胶取出,65V恒压电转印2 h。转印好的纤维素膜置于TBST(含0.05% Tween-20的TBS)中漂洗3次,每次3~5 min,然后置于含10%脱脂乳的TBST中4℃封闭过夜,TBST漂洗3次,每次6~8 min。加入适量稀释的多抗血清,37℃作用2 h,TBST漂洗3次。加入辣根过氧化物酶标羊抗鼠二抗(1: 8000稀释),作用2 h,以TBST漂洗3次,每次6~8 min,以ECL增强显色试剂盒显色。完成后,将NC膜浸入Stripping Buffer中,55℃温育30 min,期间缓慢振荡几次,PBST漂洗3次,每次3~5 min。置于10%脱脂乳的PBST中4℃封闭过夜,以鼠源β-actin抗体为一抗(1:1000稀释)和HRP标记羊抗鼠二抗(1:8000稀释),Western blot分析actin蛋白,ECL增强试剂盒显色。
1.10 免疫荧光鉴定将5×105个细胞接种至已事先放置好灭菌飞片的35 mm细胞培养皿中,用含10% FBS的DMEM培养基在37℃、5% CO2细胞培养箱中培养至细胞浓度约70%。去掉培养基,PBS洗涤2次,加入4%中性甲醛室温固定20 min,再用PBS洗涤细胞3次。在湿润的滤纸上覆盖保鲜膜,保鲜膜上滴加100 μL以TBS稀释1000倍的RIG-I多克隆抗体,将含有细胞的飞片扣上,使飞片上的细胞与多抗完全接触,37℃孵育1 h。取出飞片,TBS洗涤3次,取出飞片,TBS洗涤3次,避光,在保鲜膜上滴加100 μL以TBS稀释200倍的羊抗鼠荧光二抗,再将含有细胞的飞片扣上,使飞片上的细胞与多抗完全接触,37℃避光孵育1 h。避光,在保鲜膜上滴加100 μL的以TBS稀释成1: 500的DAPI,再将含有细胞的飞片扣上,使飞片上的细胞与DAPI完全接触,37℃避光孵育1 h。取出飞片,TBS洗涤3次,在载玻片上滴加封片剂,将含有细胞的飞片扣上,用荧光显微镜观察、拍摄。
2 结果
2.1 DF-1细胞对嘌呤霉素敏感性实验根据已报道的文章,选取嘌呤霉素浓度1~10 μg/mL做DF-1细胞敏感性实验。当药物浓度为3 μg/mL时,一直有零星细胞存活,而药物浓度为4 μg/mL,d 4时细胞已全部死亡(图1),因此选取4 μg/mL作为筛选浓度。

图1 不同浓度嘌呤霉素对DF-1细胞致死率曲线图Fig.1 Survival rate of DF-1 cells treated with different doses of puromycin
2.2 PiggyBac-RIG-I质粒的构建及鉴定以本实验室构建、保存的质粒Flag-RIG-I模板对鹅源RIG-I进行PCR扩增(图2),所得目的基因经双酶切后与PiggyBac载体连接,转化后挑取菌斑进行PCR鉴定,PCR鉴定的正确结果送生工生物工程(上海)股份有限公司测序,测序结果正确,可用于后续试验。

图2 PB-RIG-I质粒的PCR鉴定Fig.2 Identifi cation of PB-RIG-I by PCR
2.3 细胞系荧光鉴定PiggyBac载体自带绿色荧光蛋白GFP,转染细胞后在荧光显微镜下观察转染效果(图3B)。由于PiggyBac系统为双启动子系统,因此插入外源片段不会影响GFP蛋白的定位,转染PBRIG-I的DF-1荧光形态与转染空载体的一致(图3C),转染后的细胞进行药物筛选、扩大培养和亚克隆,每次亚克隆以免疫荧光作为鉴定依据,进行后续试验(图3D)。
2.4 细胞系RT-PCR鉴定为了检验鹅RIG-I的细胞系的稳定性,我们将二次亚克隆获得的阳性细胞株进行连续传代,利用RT-PCR对传代细胞进行阳性鉴定。PiggyBac系统为双启动子,目的基因和下游的GFP、抗性基因分属不同启动子,为防止所得单细胞株为空载体细胞株,设计了3对RT-PCR鉴定引物,第1对和第2对分别为针对RIG-I基因(图4A)、GFP基因(图4B)进行鉴定,第3对上游为RIG-I序列,下游为GFP引物,鉴定区间包含RIG-I及GFP(图4C)。结果显示:第1、5、10、15、20、30代细胞株均有RIG-I和GFP的稳定表达,说明RIG-I已在DF-1细胞中稳定表达,而空载体转染组仅有GFP的表达。
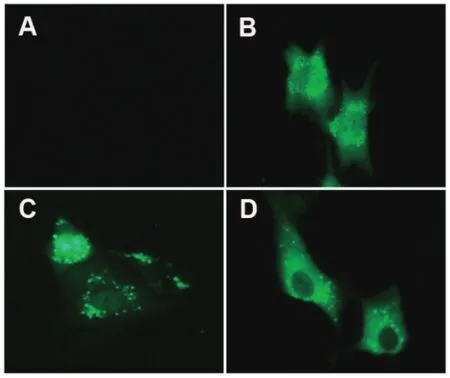
图3 PB-RIG-I转染DF-1细胞荧光鉴定Fig.3 Fluorescence of DF-1 cells transfected with PB-RIG-I
2.5 细胞系Western Blot鉴定为了鉴定细胞系中RIG-I蛋白水平的表达情况,我们用本实验室制备的鹅RIG-I多克隆抗体进行Western blot鉴定(图5)。结果显示:第1、5、10、15、20、30代细胞均有RIG-I的稳定表达。
2.6 细胞系免疫荧光鉴定分别将细胞系的第1、5、10、15、20、30代置于含有飞片的35 mm培养皿中,待细胞长满至约70%时取出细胞,中性甲醛固定,一抗二抗孵育后,DAPI染色细胞核,使用封片剂封片后,在荧光显微镜下观察、拍摄。结果如图6所示,每组图片分别为细胞核DAPI染色、红色二抗以及合并结果,其中A组为第1代,B组为第5代,C组为第10代、D组为第15代、E组为第20代、F组为第30代。从结果可以看出,每组中每个细胞都可见红色荧光,证明了细胞系能稳定表达RIG-I。

图4 RT-PCR鉴定表达鹅RIG-I的DF-1细胞系的稳定性Fig.4 Stability identifi cation of DF-1 cells eqpressing goose RIG-I by RT-PCR
3 讨论
虽然发现较晚,但RIG-I作为先天性免疫中的重要组成成分,越来越受到研究人员的重视,对其进行的研究也在不断深入[7,8]。Megan等[9]用禽流感病毒感染雏鸭,发现RIG-I的表达水平显著提高,这也证实主要由RIG-I负责识别流感病毒。将鸭源RIG-I基因瞬时转染到鸡胚成纤维细胞系DF-1中,发现其可以诱导干扰素的表达。分别用禽流感强(H5N1)弱(H5N2)毒株感染转染RIG-I后的细胞,可引起干扰素下游基因表达的上调,病毒滴度也明显降低[3]。孙英杰等[10]鉴定出鹅源RIG-I基因,用RIG-I转染DF-1细胞后感染NDV,发现可引起强烈的抗病毒反应,病毒滴度也明显下降。用NDV感染鹅胚成纤维细胞,也会引起RIG-I表达量的上调。

图5 Western blot鉴定表达鹅RIG-I的DF-1细胞系的稳定性Fig.5 Western blot identifi cation of DF-1 cells with stable expressed goose RIG-I
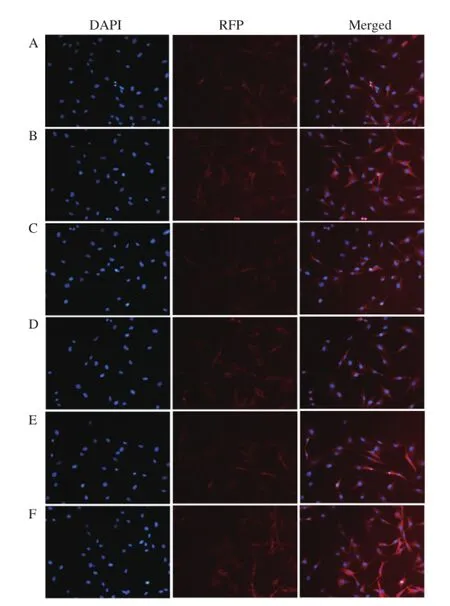
图6 免疫荧光鉴定表达鹅RIG-I的PF-1系的稳定性Fig.6 Stability identifi cation of DF-1 cells expressing goose RIG-I by immunofl uorescence
RIG-I的天然缺失是否对鸡造成了不利影响,鸡对某些病毒的易感与RIG-I的缺失有没有关系,是目前研究人员的兴趣点,也是争论点。一方面有研究人员认为RIG-I基因的缺失导致鸡易感禽流感,而另一方面研究人员认为同是RIG-I样受体家族的黑色素瘤分化相关基因5(melanoma differentiation associated gene 5,MDA5)会弥补RIG-I的作用,两种观点都有实验依据[11,12],目前仍无法达成共识,需要进一步的研究。
目前关于禽类RIG-I的研究较少,一方面集中在病毒感染鸭或鹅后,检测组织器官中RIG-I的表达量及病毒滴度,另一方面是病毒感染鸭或鹅原代细胞,或者是将鸭或鹅的RIG-I基因瞬时转染入鸡传代细胞后感染病毒,检测干扰素表达量和病毒滴度。但病毒感染动物,仅能说明RIG-I在鸭和鹅中是否有抗病毒作用,而瞬时转染存在诸多限制:例如转染步骤的繁琐、转染量不一致或转染本身对实验结果的影响等[13,14]。本试验利用PiggyBac转座系统构建的稳定表达鹅源RIG-I的细胞系,将RIG-I基因整合到基因组中,一定程度上缩小了与自然情况的差异,同时也省去了每次试验时的转染步骤,为后续的研究奠定了基础。
[1] 丁娜, 孙英杰, 丁铲. 禽Toll样受体研究进展[J]. 中国动物传染病学报, 2011, 19(6): 77-83.
[2] 丁娜, 孙英杰, 丁铲, 等. 鹅模式受体MDA5基因克隆及功能分析[J]. 中国动物传染病学报, 2012, 20(3): 1-6.
[3] Barber M R, Aldridge J R Jr, Webster R G,et al. Association of RIG-I with innate immunity of ducks to influenza[J]. Proc Natl Acad Sci U S A, 2010, 107 (13): 5913-5918.
[4] Zou J, Chang M,Nie P,et al. Origin and evolution of the RIG-I like RNA helicase gene family[J]. BMC Evol Biol, 2009, 9: 85.
[5] Fournier P, Arnold A, Wilden H,et al. Newcastle disease virus induces pro-inflammatory conditions and type I interferon for counter-acting Treg activity[J]. Int J Oncol, 2012, 40 (3): 840-850.
[6] Ireton R C, Gale M Jr. RIG-I like receptors in antiviral immunity and therapeutic applications[J]. Viruses, 2011, 3 (6): 906-919.
[7] Kolakofsky X D, Kowalinski X E, Cusack X S. A structure-based model of RIG-I activation[J]. RNA, 2012, 18(2): 2118-2127.
[8] Luo D, Ding S C , Vela A,et al. Structural insights into RNA recognition by RIG-I[J]. Cell, 2011, 147(2): 409-422.
[9] Barber M R, Aldridge J R Jr, Fleming-Canepa X,et al. Identification of avian RIG-I responsive genes during influenza infection[J]. Mol Immunol, 2013, 54(1): 89-97.
[10] Sun Y, Ding N, Ding S S,et al. Goose RIG-I functions in innate immunity against Newcastle disease virus infections[J]. Mol Immunol, 2013, 53(4): 321-327.
[11] Liniger M,Summerfield A, Zimmer G,et al. Chicken cells sense influenza A virus infection through MDA5 and CARDIF signaling involving LGP2[J]. J Virol, 2012, 86 (2): 705-717.
[12] Karpala A J, Stewart C, McKay J,et al. Characterization of chicken Mda5 activity: regulation of IFN-beta in the absence of RIG-I functionality[J]. J Immunol, 2011, 186 (9): 5397-5405.
[13] 刘云海, 钟英丽, 任凯群, 等. 细胞转染条件的优化[J]. 湖南师范大学自然科学学报, 2004, 27(2): 84-88.
[14] 卓长华, 应敏刚, 龚福生. 脂质体介导质粒DNA体外细胞转染的优化研究[J]. 肿瘤学杂志, 2010, 16(6): 453-455.
CONSTRUCTION OF CHICKEN EMBRYO FIBROBLAST CELL LINE DF-1 STABLY EXPRESSING GOOSE RIG-I THROUGH PIGGYBAC TRANSPOSON SYSTEM
HU Yue1, SUN Ying-jie2, WANG Xiao-xu3, QIU Xu-sheng2, SONG Cui-ping2, TAN-Lei2, HU Gui-xue1, DING Chan2
(1. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3. College of Animal Science and Technology, Anhui Agricultural University, Hefei 223006, China)
Retinoic acid inducible gene-I (RIG-I) is a family member of cytoplasmic pattern recognition receptors (PRRs), which acts as a sensor for RNA virus and plays an important role in antiviral innate immunity. RIG-I is evolutionally conserved among most species. However, several reports and our previous studies have identifi ed that receptors for RIG-I exist in both ducks and geese, but not in chickens. To investigate whether this natural loss of RIG-I plays a negative role in chicken, goose RIG-I was transfected into chicken embryo fi broblast cell line DF-1 through PiggyBac transposon system. Monoclonal cells were obtained from twice sub-cloned cultures. DF-1 cells stably expressing goose RIG-I were identifi ed by detection of fl uorescence, RT-PCR and Western blot. The present study has laid the foundation for future research on mechanism of chicken innate immunity and function of goose RIG-I.
Goose retinoic acid inducible gene-I(RIG-I); chicken embryo fi broblast cell line DF-1; Piggy-Bac transposon system
S852.42
A
1674-6422(2014)03-0053-08
2014-02-14
863计划(2011AA10A209);国家自然科学基金项目(31101822);中央级公益性科研院所基本科研业务费(2014JB08)
胡跃,男,硕士研究生,预防兽医学专业
丁铲,E-mail:shoveldeen@shvri.ac.cn;胡桂学,E-mail:huguixue901103@163.com

