兔出血症病毒RT-PCR检测方法的建立与应用
肖跃强,刘吉山,杨 慧,沈志强,,丁 壮
(1. 吉林大学动物医学院,长春130062;2. 山东省滨州畜牧兽医研究院,滨州 256600;3.山东绿都生物科技有限公司,滨州 256600)
兔出血症(rabbit haemorrhagic disease, RHD)是一种严重威胁兔产业健康发展及野生兔群生态平衡的烈性传染病,其典型特征为发病快且病死率高,高达40%~90%[1]。该病首先在中国暴发,并迅速流行至其他亚洲周边与欧美国家,墨西哥、韩国等国由于和我国存在相关产业贸易导致该病的发生流行[2,3]。由于国际贸易日益增多与临床防控难度加重,开展该病的早期快速诊断至关重要。
兔出血症病原兔出血症病毒(Rabbit haemorrhagic disease virus, RHDV)是单股正链RNA病毒,虽然还不能对其进行体外培养,但国内外学者在病原学、免疫学、临床诊断与防治等方面已开展了深入研究。诊断是防控该病的根本,目前世界动物卫生组织(OIE)官方推荐的实验室诊断法方法包括血凝(hemagglutinin,HA)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、Western blot、免疫染色、电镜负染观察、动物回归实验等。同样,血凝抑制(hemoagglutination inhibition,HI)、免疫琼脂扩散试验(immune agar diffusion test,ID)[4]、对流免疫电泳[5]、SPA菌体免疫扫描电镜法[6]、免疫电镜捕获双装饰法[7]、TaqMan探针或SYBR Green Ⅰ实时荧光定量检测方法[8-10]等也被广泛应用。但是,这些方法均存在一定的缺陷,有些需要繁琐的样品处理过程,耗时费力,如SPA菌体免疫扫描电镜法、免疫电镜捕获双装饰法等;有些简单实用但敏感性不高,如HA、HI、ID等;有些虽然特异性强、敏感性高,但成本较高,如TaqMan探针实时荧光定量方法等。因此,本研究通过设计筛选引物组合,建立了一种快速、敏感、特异的RHDV RT-PCR分子生物学检测方法,并开展了临床应用,为RHDV的早期诊断、流行病学调查等提供一种有效的技术手段。
1 材料和方法
1.1 主要试剂 2×Power Taq PCR Master Mix、rTaq DNA聚合酶、2.5 mmol/L dNTP、RNA酶抑制剂、rTaq DNA聚合酶、MgCl2(25 mmol/L)等购自TaKaRa公司;TRIzol试剂购自上海生工;M-MuLV反转录酶等购自北京百泰克生物技术有限公司。
1.2 病毒株 兔出血症病毒(RHDV)、兔轮状病毒(Rabbit Rotavirus,RRV)、兔水泡性口炎病毒(Rabbit Vesicular stomatitis virus,RVSV)均由山东省滨州畜牧兽医研究院预防兽医学与动物生物技术重点实验室保存。
1.3 引物设计及合成 应用Primer Premier 5.0生物软件,根据GenBank中公布的RHDV全基因组序列,设计了上游引物F与下游引物R1、R2。F:5'-ACCCATCATGTTCGCGTCTG-3',R1:5'-TCCTGCATAAAARTACCCGTCC-3',R2:5'-CAGGTTGAACACGAGTGTGCT-3',引物组合理论上可分别扩增出235 bp与331 bp目的基因,引物合成与纯化委托上海生工完成。
1.4 病毒cDNA合成 使用TRIzol试剂提取病毒基因组RNA,具体操作按说明书进行,干燥后加入DEPC水溶解提取的RNA,M-MuLV反转录酶合成cDNA,具体操作按说明书进行。
1.5 下游引物的筛选 PCR体系为:2×Power Taq PCR Master Mix 5 μL、引物组合F+R1/R2各 0.5 μL、并加入对应的cDNA 1 μL、灭菌ddH2O 10 μL,设空白对照。反应程序:94℃预变性5 min;94℃变性40 s,57.5℃退火40 s,72℃延伸30 s,扩增30个循环;最后72℃延伸10min。琼脂糖凝胶电泳检测扩增,确定下游引物。
1.6 PCR扩增优化
1.6.1 PCR扩增Mg2+浓度 以确定的上下游引物组合优化离子浓度,反应体系为:10×PCR缓冲液(Mg2+free)2.5 μL,MgC12(25 mmol/L)0.5、1.0、1.5、2.0、2.5、3.0 μL,dNTPs(2.5 mmol/L)0.5 μL,上下游引物各0.5 μL,rTaq DNA聚合酶0.5 μL(5 U/μL),合成的cDNA 1 μL,补灭菌ddH2O至25 μL。反应程序:94℃预变性5 min;94℃变性40 s,57.5℃退火40 s,72℃延伸30 s,扩增30个循环;最后72℃延伸10 min。琼脂糖凝胶电泳检测扩增。
1.6.2 退火温度优化 确定Mg2+最佳工作浓度后,通过50℃~60℃温度区间梯度PCR,继续优化PCR反应体系及反应程序。
1.7 敏感性试验 由微量核酸测定仪测定回收PCR产物浓度,并根据拷贝数=(6.02×1023)×(ng/μL×10-9)/(DNA length×660)计算,等比稀释模板拷贝数为106~101拷贝/5 μL,进行PCR,评定敏感性。
1.8 特异性试验 利用TRIzol试剂提取兔轮状病毒、兔水泡型口炎病毒基因组样品,并进行反转录合成cDNA,之后进行PCR特异性检测。
1.9 临床应用比较性试验 应用本研究建立的RHDV RT-PCR检测方法与血凝试验(HA)同时检测临床疑似RHDV感染的临床组织病料27份,比较2种检测方法的敏感性与特异性。对检测结果不一致的临床组织病料进行动物回归试验,每份样品攻毒4只未免疫家兔,通过观察攻毒兔的临床症状与病理变化确定是否为RHDV感染所致,同时设阴性对照攻毒组。
2 结果与讨论
2.1 下游引物筛选 不同引物扩增组合扩增结果电泳检测见图1。可见,F+R2引物组合可特异性的扩增出大小为331 bp的单一目的基因,而F+R1组合虽然能扩增出235 bp的目的片段,但存在非特异性扩增,经后期PCR条件优化后也不能够完全消除,因此,选取F+R2组合用于本实验RHDV检测方法的建立与应用。经Blast分析,所设计引物序列与目前已经公布的所有病毒株序列对应区域完全一致,利用该方法可以检测所有的RHDV毒株。

图1 不同引物组合PCR扩增结果Fig.1 PCR results from different combination of primers
2.2 Mg2+浓度的优化 在0.5~3.0 mmol/L区间Mg2+浓度扩增结果见图2。当Mg2+浓度为0.5 mmol/L时,无任何产物与特异性扩增;当浓度在2.0 mmol/L及以上时,随着浓度增高,特异性产物浓度越来越低,非特异性产物浓度越来越高;在浓度为1.0 mmol/L和1.5 mmol/L时,扩增产物特异单一,而且也无引物二聚体。可见,当Mg2+浓度为1.0~1.5 mmol/L,均能获得高效特异的扩增,因此选择1.5 mmol/L Mg2+浓度进行其他反应条件的优化。
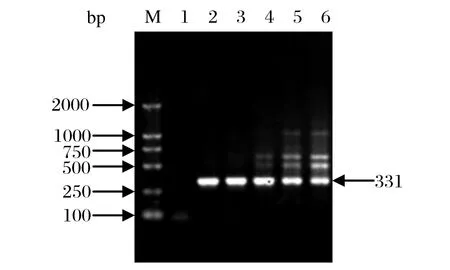
图2 Mg2+对PCR扩增的影响Fig.2 PCR results at different concentration of Mg2+
2.3 温度梯度PCR 在Mg2+浓度为1.5 mmol/L条件下,退火温度为50℃~60℃,均可高效扩增目的DNA片段,无非特异性扩增、无引物二聚体,且不同退火温度的扩增效率无明显差异。证明在此温度区间内,目的片段可以得到很好的扩增,而且无差异性,电泳结果见图3。该方法具有良好的退火温度区间,引物特异性强。同时,由于所建立方法退火温度范围较广,适于建立与其他病原的多重检测方法。
2.4 PCR敏感性 利用微量核酸测定仪测定回收PCR产物的浓度并稀释作为模板,最终模板浓度为106/5 μL到101/5 μL共计6个梯度,并进行敏感性扩增,结果见图4。当模板拷贝数≥102时有目的条带,清晰可见,但101拷贝不能通过电泳检测到扩增产物。兔出血症病毒RT-PCR诊断方法已有很多报道[11-15],但多是以提取的病毒RNA或者病毒稀释倍数来判定其敏感性。本研究建立的RT-PCR检测方法以扩增产物等比稀释后为模板,得出理论上可以肉眼观察到的最低扩增拷贝数,在精确其敏感性的同时增加了其临床检测适用性,即可以检测出较低含量的病毒样本。

图3 退火温度对PCR扩增的影响Fig.3 PCR results at different annealing temperature
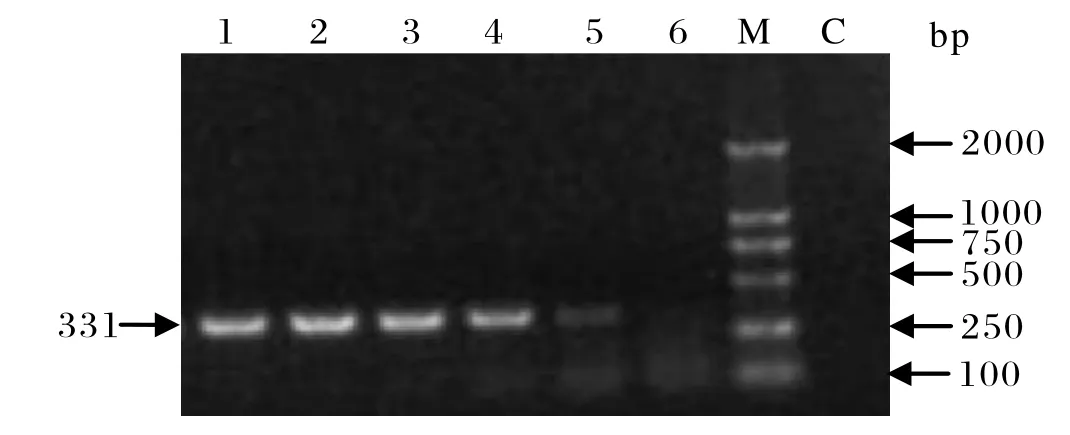
图4 不同拷贝数稀释PCR产物电泳检测结果Fig.4 Results of PCR at different copy numbers
2.5 特异性检测 该方法特异性测定结果如图5所示,针对RHDV所设计合成引物只对RHDV能够获得特异性扩增,而检测兔水泡型口炎病毒与兔轮状病毒时并无特异性扩增,说明所建立的方法特异性强。
2.6 临床应用比较试验 应用本研究建立的RHDV RT-PCR检测方法与血凝试验(HA)同时检测临床疑似RHDV感染的临床组织病料27份,HA检测出阳性样品18份,而本研究建立的RT-PCR方法检测出阳性样品21份。3份HA未检出的阳性病料攻毒的家兔均在24~72 h内死亡,且临床发病症状与剖检组织病理学变均为典型RHD所致,阴性对照组全部健活。以上结果表明,所建立的RT-PCR方法较HA检测方法具有更高的敏感性,阳性检出率由66.7%提升至77.8%,具有较强的临床适用性。由于该病具有潜伏期短、传播快、病死率高等特点,因此,快速、敏感、准确的RT-PCR诊断方法的建立对于该病的临床防控极为重要。RHDV常规检测最为常用的方法是血凝(血凝抑制)实验、ELISA等,但血凝(血凝抑制)实验需要人“O”型红细胞,不仅受来源限制,而且对操作人员存在潜在的生物安全性问题,同时其敏感性较低,影响其结果判定的因素也较多。因此,本研究建立的RT-PCR检测方法具有敏感、特异、准确等特点,可用于RHDV的快速诊断,也可用于潜伏携带RHDV的大规模排查与净化,对于防控该病提供了技术保障。
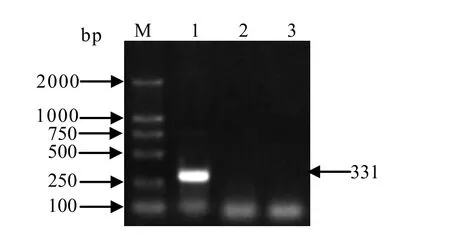
图5 PCR特异性检测结果Fig.5 Specificity test of PCR
[1]Abrantes J, van der Loo W, Le Pendu J,et al. Rabbit haemorrhagic disease (RHD)and rabbit haemorrhagic disease virus (RHDV): a review [J]. Vet Res, 2012, 43:12.
[2]Park N Y, Chong C Y, Kim J H,et al. An outbreak of viral haemorrhagic pneumonia (tentative name)of rabbits in Korea [J]. J Korean Vet Med Assoc, 1987, 23(9): 603-610.
[3]Gregg D A, House C, Meyer R,et al. Viral haemorrhagic disease of rabbits in Mexico: epidemiology and viral characterization [J]. Rev Sci Tech,1991, 10(2): 435-451.
[4]戴康, 徐为燕, 杜念兴. 应用免疫扩散试验检测兔病毒性出血症抗体[J]. 畜牧与兽医, 1987, 19(2): 70.
[5]张洪英, 刘晓颖, 陈立志, 等. 对流免疫电泳试验诊断兔瘟病[J]. 特产研究, 2000, 22(3): 44-45.
[6]赵英哲, 王志钧, 张福仁, 等. 应用SPA菌体免疫扫描电镜法检测兔瘟病毒[J]. 内蒙古农牧学院学报, 1987, 8(2):215-218.
[7]秦海斌, 刘怀然, 刘家森, 等. 兔出血症病毒抗原捕获ELISA检测方法[J]. 中国比较医学杂志, 2007, 17(8):20-24.
[8]张秀娥, 田夫林, 李希友. TaqMan MGB探针实时检测兔病毒性出血症病毒[J]. 中国兽医学报, 2007, 27(6): 814-817.
[9]Niedźwiedzka-Rystwej P, Hukowska-Szematowicz B, Działo J, et al. Real time PCR detection of rabbit haemorrhagic disease virus in rabbits infected with different European strains of RHDV [J]. Pol J Vet Sci,2013, 16(1): 39-43.
[10]肖跃强, 谢金文, 徐二丹, 等. 兔出血症病毒实时荧光定量RT-PCR检测方法的建立[J]. 动物医学进展, 2013,34(12): 69-73.
[11]胡波, 魏后军, 王芳, 等. 兔出血症病毒RT-PCR检测方法的建立及其临床应用[J]. 畜牧兽医学报, 2010, 41(11):1442-1446.
[12]王芳, 李超美, 杨龙圣, 等. 兔出血症病毒RT-PCR检测方法的建立及应用[J]. 农业生物技术学报, 2007, 15(3):409-413.
[13]巩薇, 付瑞, 贺争鸣, 等. 兔出血症病毒RT-PCR方法的研究[J]. 中国比较医学杂志, 2006, 16(8): 466-468.
[14]胡迎东, 刘怀然, 司昌德, 等. 兔出血病病毒RT-PCR检测方法的建立及初步应用[J]. 动物医学进展, 2006, 27(5):87-90.
[15]王印, 杨泽晓, 韩雪清, 等. 兔出血症病毒与欧洲野兔综合征病毒复合RT-PCR检测方法的建立[J]. 中国兽医科学, 2011, 41(11): 1165-1170.

