基于兔出血症病毒衣壳蛋白优势抗原区的间接ELISA方法建立
李 宁,孟春春,梁瑞英,李传峰,陈宗艳,缪秋红,毕庄莉,朱英奇,郭慧敏,刘光清,王桂军
(1.安徽农业大学动物科技学院,合肥230016;2.中国农业科学院上海兽医研究所,上海2002411)
兔病毒性出血症,又称兔瘟,是由兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV)引起的一种以急性、高度传染性、大面积坏死为特征的兔传染病。据报道,兔病毒性出血症于1984年首先在中国江苏省爆发[1],如今在美洲、欧洲和东南亚等世界范围内均有流行。该病潜伏期短、发病急、病程短、传播快,多呈爆发性流行,给养兔业造成极大的威胁,世界卫生组织局(OIE)将该病列为必须呈报疫病,我国将其列为二类疫病[2]。目前,国内兔病毒性出血症的临床诊断普遍采用人的“O”型红细胞进行的红细胞凝集试验和血凝抑制试验,血凝检测方法虽然有一定的优点,但仍然存在敏感性、生物安全性及准确率较低等问题。而以兔出血症病毒作为包被抗原的ELISA检测方法,虽然特异性和敏感性较强,但其技术仍未达到成熟阶段。
近年研究表明,RHDV主要结构蛋白VP60为病毒的唯一结构蛋白[3],可作为ELISA检测RHDV优良的诊断抗原,陆续有报道通过VP60建立了兔瘟的ELISA检测方法[4,5]。但RHDV完整的衣壳蛋白分子量偏大,同时在原核表达系统和真核表达系统得到的VP60蛋白表达量均偏低,而且表达效果不稳定。有学者发现VP60的优势抗原决定簇主要分布于两端[6,7],因此本研究选取RHDV衣壳蛋白VP60两端的优势抗原区域A(31~250 aa)和B(472~579 aa),采用融合PCR的方法将两个片段扩增拼接融合,利用原核表达系统表达了RHDV重组多肽片段AB 蛋白,并以纯化的蛋白为包被抗原建立RHDV抗体间接ELISA检测方法。另外利用完整VP60蛋白作为对比抗原[8],比较两种蛋白ELISA方法之间的差异,结果证明该融合蛋白保留了绝大部分VP60蛋白的抗原性,与完整的VP60蛋白相比可更好地与兔RHDV阳性血清特异结合。本试验结果为进一步研发出敏感、特异、安全、成本低廉、使用方便的RHDV诊断检测试剂盒,对家兔免疫水平进行实时监控和建立科学、灵活的家兔RHDV免疫程序奠定了基础。
1 材料和方法
1.1 菌株与质粒 重组质粒PBL-RHDV (含有RHDV全长基因组cDNA序列)由中国农业科学院上海兽医研究所刘光清课题组构建并保存[9];pET-30a(+)载体购自Novagen公司;E. coliJM109感受态细胞、BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;
1.2 酶标抗体与血清 抗His标签鼠单克隆抗体(MAb)、HRP标记的山羊抗兔IgG二抗购自Invitrogen公司;兔源阴性血清、阳性血清均由上海兽医研究所刘光清课题组保存并提供。
1.3 酶与主要试剂 rTaqDNA 聚合酶、T4 DNA连接酶、Hind Ⅲ、KpnI等限制性内切酶购自TaKaRa公司;细菌质粒抽提试剂购自Omega公司;TMB显色液、蛋白浓度检测试剂盒购自Beyotime公司;IPTG、尿素、包涵体蛋白纯化试剂等均购自上海生工生物工程有限公司。
1.4 AB基因融合片段扩增 根据GenBank中收录的RHDV JX/97株基因序列(登录号:DQ205345)设计两对引物,且在引物5'端引入相应酶切位点(下划线),各引物片段序列如下表1(黑体部分为P2/P3的互补区,引物由上海捷瑞生物工程公司合成)。
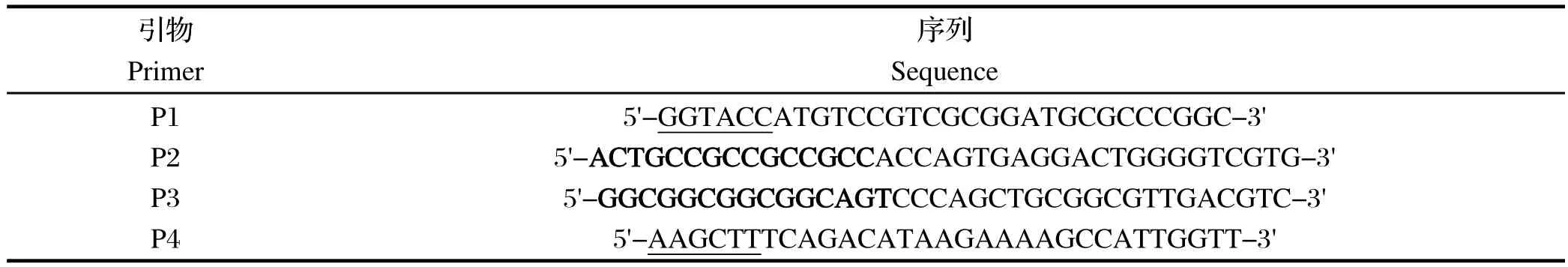
表1 构建pET-30a(+)/AB重组质粒所用引物Table 1 Primers used for constructions of pET-30a(+)/AB
以pBL-RHDV质粒为模板,引物P1、P2扩增A片段,引物P3、P4 扩增B片段;分别将A、B片段回收后再用引物P1和P4进行融合PCR 扩增,扩增产物命名为AB。融合PCR扩增产物进行1%的琼脂糖凝胶电泳检测,扩增产物送生物公司测序鉴定,切胶后用纯化回收试剂盒回收备用。
1.5 AB片段原核表达重组质粒构建 将纯化的AB基因扩增产物和pET-30a(+)载体分别用Kpn I和Hind Ⅲ 进行双酶切,并用T4 DNA连接酶连接后转化大肠杆菌JM109感受态细胞,使用卡那抗性平板筛选阳性克隆,用质粒小量抽提试剂盒提取重组质粒,Kpn I、Hind Ⅲ 进行双酶切鉴定,并由上海美吉生物技术有限公司测序,将鉴定符合标准的阳性质粒命名为:pET-30a(+)/AB。
1.6 AB融合蛋白的诱导表达及纯化 将重组质粒pET-30a(+)/AB转化入E.coli BL21(DE3)感受态细胞中,经卡那抗生素筛选后,挑取单菌落至含有卡那霉素的LB培养基中,37℃振荡培养至 OD600为0.4~0.6,加入IPTG(终浓度1 mmol/L)进行诱导,优化诱导条件,选择表达量最高的诱导条件并设置空pET-30a(+)载体对照,4℃、8341×g 离心菌液5 min,收集菌体。取2 mL菌液的菌体重悬后与5倍浓度上样缓冲液混匀,100℃水浴10 min,进行SDSPAGE电泳和Western blot检测。扩大培养阳性的AB重组菌并诱导表达,收集菌体后超声破碎并冻融,12 511×g 离心10 min分别取上清和沉淀进行SDSPAGE电泳,分析蛋白的可溶性。之后大量表达AB融合蛋白,参照分子克隆第三版使用包涵体蛋白的分离纯化方法纯化AB重组蛋白,利用兔源阳性血清以及His标签鼠单克隆抗体为一抗,HRP标记的山羊抗兔IgG为二抗,对纯化产物进行Western blot检测,同时用蛋白浓度检测试剂盒测定纯化后AB蛋白浓度。
1.7 间接ELISA检测方法的建立 利用不同浓度AB融合蛋白和不同稀释倍数血清的试验方阵,确定最佳抗原包被浓度和血清稀释倍数。首先用抗原包被液(0.05 mol/mL碳酸盐缓冲液)将蛋白分别稀释到0.1、0.2、0.5、1、2、3、4、5 μg/mL,100 μL/孔包被酶标板,4℃过夜;用1%明胶溶液37℃封闭2 h,PBST洗涤2次;PBST将阳性血清和阴性血清分别按1:5、1:10、1:50、1:100、1:500、1:1000、1:2000稀释,100 μL/孔加入酶标板,37℃孵育1 h,PBST洗涤3次;按100 μL/孔加入1:10 000稀释的酶标二抗,37℃孵育1 h,PBST洗涤3次;100 μL/孔加入TMB显色液,37℃孵育15 min,最后50 μL/孔加入2 mol/L H2SO4溶液终止反应。测定酶标板在OD450下数值,选取P/N数值最大且阳性血清OD450值接近1.0所在孔为最佳抗原包被浓度和最佳血清稀释倍数[10]。之后摸索优化封闭液封闭时间和温度、血清反应时间和浓度等实验条件,利用25份阴性血清OD450数值,经统计学分析计算血清阴阳性判断临界值。
1.8 特异性阻断实验 阴性血清和阳性血清各1份,1:200到1:6400倍比稀释,加入等量5 μg/mL的抗原液置于37℃作用2 h,同时设稀释度相同但不加抗原的阳性血清作为对照,然后用实验建立的间接ELISA方法检测。
1.9 重复性实验 抽取阴阳性血清各5份检测并记录OD450数值,之后每周在相同实验条件下重复检测6次,计算变异系数(CV),比较结果差异。
1.10 敏感性实验 将4份阳性血清经1:20、1:80、1:3200、1:12 800、1:51 200、1: 204 800倍数稀释,以优化后的间接ELISA方法测定对血清的检出极限。
1.11 AB融合蛋白与VP60蛋白作为不同包被抗原检测临床样品实验 取免疫保护等实验获得的待检血清80份,分别以AB融合蛋白与完整VP60蛋白作为包被抗原进行间接ELISA方法检测,对比两者效果异同。
2 结果
2.1 AB片段的扩增及重组质粒构建 以pBL-RHDV为模板,通过融合PCR扩增出AB基因,其长度为936 bp(图1),与预期结果相符。将AB片段使用Kpn I 和Hind III 双酶切后与经同样酶切的pET-30a(+)连接,获得pET-30a(+)/AB重组质粒;将重组质粒进行双酶切鉴定,电泳显示936 bp处有目的条带,且载体位置与空载体对照相符合(图2)。阳性质粒通过序列验证,表明成功构建了含有AB抗原片段的重组表达质粒。
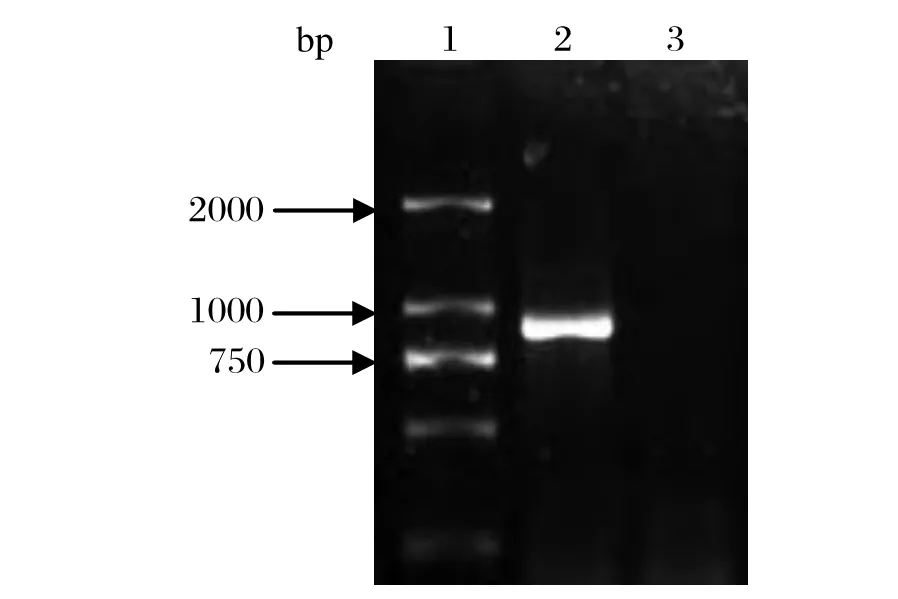
图1 AB基因的融合PCR产物Fig.1 Overlapping PCR products of AB gene
2.2 诱导表达及纯化产物的SDS-PAGE检测和Western blot分析 SDS-PAGE电泳结果表明,AB融合蛋白加上pET-30a(+)上的His标签,表达产物的分子质量约为36 kDa,与预期结果相符。同时,AB融合蛋白主要在重组菌体沉淀中,表明AB融合蛋白是以包涵体形式表达,使用包涵体蛋白的分离纯化方法获得纯化的AB融合蛋白(图3A)。用实验室前期制备的VP60多抗,以1:500倍稀释为一抗对纯化的AB融合蛋白进行Western blot分析,可见纯化后蛋白样品在约36 kDa处出现反应带,表明融合蛋白具有良好的抗原性(图3B)。
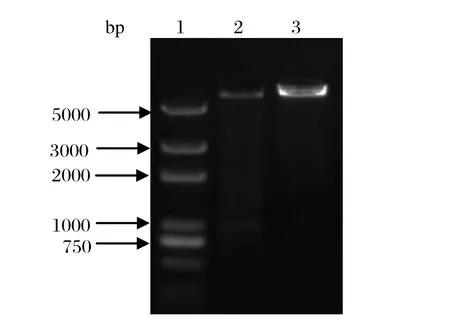
图2 pET-30a(+)/AB重组质粒的双酶切产物Fig.2 Identification of pET-30a(+)/AB by double digestion

图3 SDS-PAGE(A)和Western-blot(B)分析结果Fig.3 SDS-PAGE(A)and Western-blot (B)analysis of AB protein
2.3 确立间接ELISA最优反应条件 如表2所示,选取最佳抗原包被浓度为1 μg/mL,最佳血清稀释倍数为1:500。之后优化封闭液封闭时间和温度、血清作用时间和温度等实验条件,确定效果最佳的ELISA工作条件为1%明胶溶液37℃封闭2 h,待检血清37℃孵育45 min,酶标抗体1:15 000稀释并在37℃作用45 min,底物在37℃作用15 min后终止反应。根据25份阴性血清OD450值,计算临界值: (平均值)+3×s(标准方差)=0.350,即当待检血清P/N>2.1且OD450值>0.350,即可初步判定检测血清为阳性。
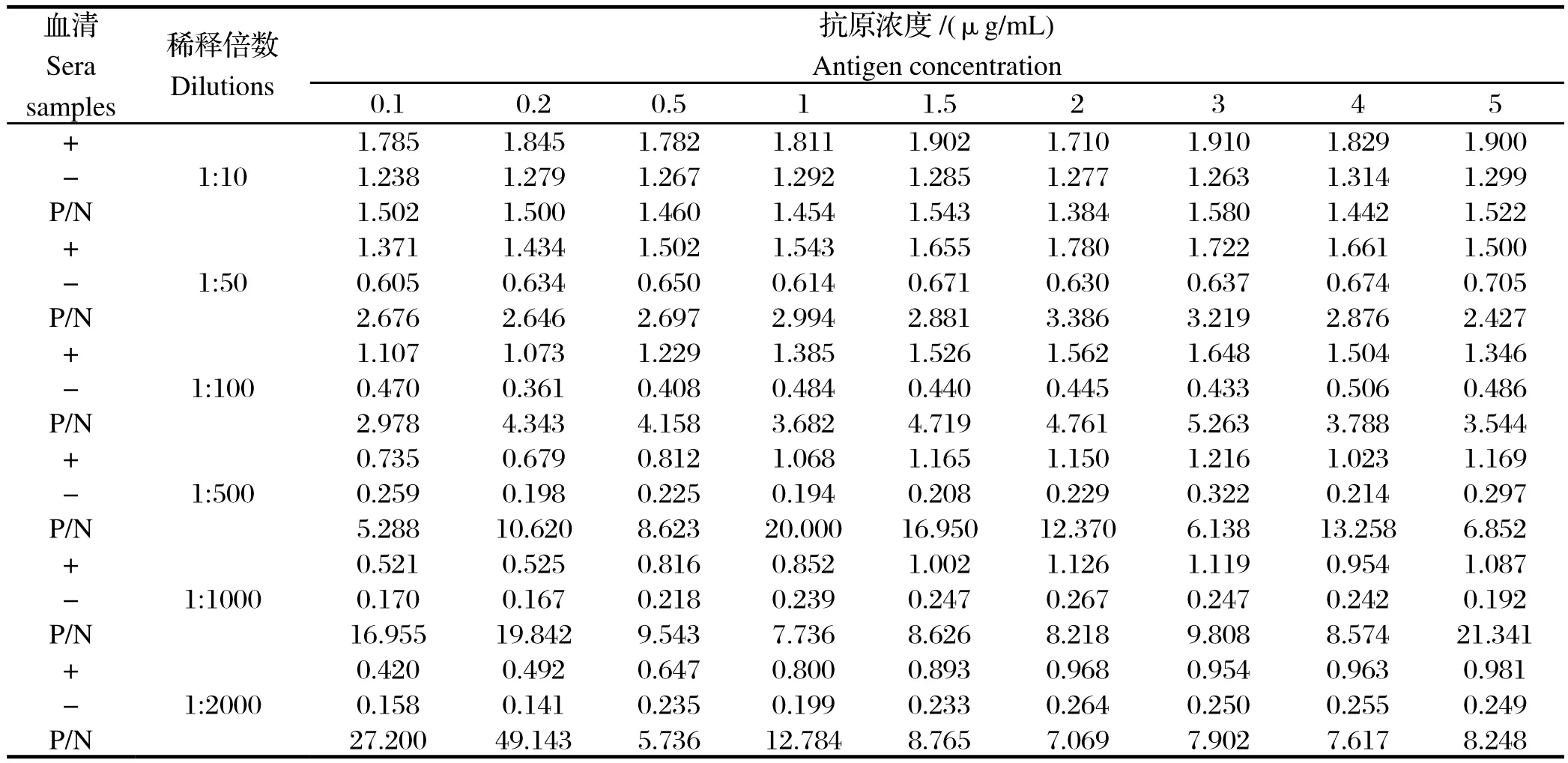
表2 最佳抗原包被浓度和血清稀释倍数方阵分析Table 2 Analysis of the best antigen concentration and sera samples optimal dilutions
2.4 阻断实验 结果显示,用抗原处理过的阴性血清和阳性血清的P/N值均小于2.1,同时对照组阳性血清P/N值均大于2.1,证明表达的AB融合蛋白与血清中抗体的结合是特异的,该方法具有较好的特异性。
2.5 重复性实验 重复检测结果显示(表3),10份血清各次的OD450值差异很小,计算平均值和方差,结果表明变异系数均在5%以内,证明该方法重复性良好。

表3 间接ELISA重复性实验结果Table 3 Repeatability results of indirect ELISA
2.6 敏感性实验 将阳性血清按1:20到1:204 800倍数稀释,当阳性血清1:12 800稀释时,检测结果仍为阳性,显示本研究建立的间接ELISA方法具有良好的敏感性。
2.7 AB融合蛋白与VP60完整蛋白分别作为包被抗原检测临床样品 分别使用AB融合蛋白与VP60完整蛋白作为包被抗原,对80份待检血清的阳性检出率分别为72.5%和70.0%,只有两份血清结果不符,且两份血清P/N值均接近2.1,属于弱阳性血清,表明两种蛋白均可作为ELISA检测方法的候选包被抗原。但在同样的阴性血清和阳性血清对照中,完整VP60蛋白包被组检测到的OD450数值偏高,且在检测样品中其检出的P/N值普遍较小,说明VP60蛋白的AB优势抗原区有更优越的特异性,更适合用于建立ELISA检测方法。
3 讨论
目前国内主要通过血凝抑制试验来进行RHDV抗体检测,但是该方法中人血红细胞获取不易,血清需要吸附处理[11],血凝抑制实验本身亦存在主观性强、检测效率低、重复性差等缺点。而以兔出血症病毒作为包被抗原的ELISA检测方法,仍存在大量技术和工艺上的问题,例如没有合适的可传代细胞系,病毒培养和纯化成本高,病毒纯化不良导致非特异性反应,存在生物安全问题等[12];另外,由于使用肝组织制备RHDV全病毒灭活苗的原因,若基于全病毒建立ELISA检测方法势必会检测到非中和性抗体,从而导致背景值偏高。这些因素在很大程度上限制了全病毒ELISA检测方法的标准化与工业化。
研究结果证明RHDV的衣壳蛋白VP60是RHDV的主要结构蛋白,也是最主要的免疫保护性抗原[13]。1994年Laurent 等[14]通过杆状病毒表达系统表达了VP60蛋白,经Western blot和ELISA实验证实了表达产物的抗原性,紧接着Nagesh等[15]观察到表达的VP60蛋白可以形成类病毒颗粒VLPs。中国秦海斌等[4]利用真核表达系统表达VP60蛋白并建立了抗原捕获ELISA检测方法。近年来还有报道利用昆虫细胞中蛋白成分与哺乳动物血清中抗体成分交叉反应性小的特点,使昆虫细胞系以可溶的形式表达VP60蛋白,可以不经纯化直接作为ELISA包被抗原,从而省却抗原纯化的成本[5]。但由于RHDV完整的衣壳蛋白分子量偏大,无论用原核表达系统还是真核表达系统都存在表达不稳定和表达量偏低的缺陷,这些因素都增加了使用衣壳蛋白建立ELISA检测方法的难度。
1998年,Torrecuadradan等[7]发现VP60有两个主要抗原优势区域,分别位于VP60蛋白N端的第31位到第250位氨基酸之间和C端的第477位到第579位氨基酸之间,而且N端的抗原性显著强于C端。Viaplana等[6]也从另一角度证实了此结论的正确性,他们将RHDV的衣壳蛋白VP60分成5个相互重叠的片段,分别在大肠杆菌中进行表达,将重组蛋白分别与自然感染和人工免疫兔的RHDV抗血清进行反应,结果显示VP60蛋白氨基端(包括蛋白的前175个氨基酸)与抗血清的反应最强,而蛋白羧基端则较弱。以上结果表明VP60主要的抗原决定区分别在其两端,而中间区域的氨基酸序列对抗原性影响不大。
本研究将RHDV衣壳蛋白截短,分别将羧基端和氨基端的优势抗原区融合在一起,此种构建方式不仅有利于提高抗原的表达量,还增强了ELISA检测的特异性和敏感度,在兔瘟疾病的防控上有重要的应用价值。经优化,AB融合蛋白经表达纯化后可得到浓度为5 mg/mL的目的蛋白,Western blot检测目的蛋白具有很好的抗原性。建立的ELISA方法抗原包被浓度低,待检血清孵育时间短。通过对该方法各项性能的评价,确定该方法具有特异性强、敏感性高、重复性好的特点。这为生产兔瘟的快速诊断试剂盒提供了参考方向,对兔瘟的防制、疫苗免疫效果评价和抗体水平监测等都具有深远意义。
[1]刘胜江, 薛华平, 浦伯清, 等. 兔的一种新病毒病—兔病毒性出血症[J]. 畜牧与兽医, 1984, 16(6): 253-255.
[2]杨龙圣, 薛家宾, 王芳, 等. 兔出血症发病概况及疫苗研究进展[J]. 江苏农业科学, 2007, 256(2): 144-147.
[3]Wang X, Qiu L, Hao H, et al. Adenovirus-based oral vaccine for rabbit hemorrhagic disease[J].Vet Immunol Immunopathol, 2012, 145(1): 277-282.
[4]秦海斌. 兔出血症病毒单克隆抗体的制备及抗原捕获ELISA检测方法的建立[D]. 陕西: 西北农林科技大学,2007.
[5]刘怀然, 曲连东, 刘家森, 等. 昆虫细胞表达兔出血症VP60蛋白间接ELISA方法建立及评价[J]. 东北农业大学学报, 2010, 41(8): 81-88.
[6]Viaplana E, Plana J, Villaverde A. Antigenicity of VP60 structural protein of rabbit haemorrhagic disease virus [J].Arch Virol, 1997, 142(9): 1843-1848.
[7]Martinez-Torrecuadrada J L, Cortes E, Vela C, et al. Antigenic structure of the capsid protein of rabbit haemorrhagic disease virus [J]. J Gen Virol, 1998, 79(Pt8): 1901-1909.
[8]邱立, 郝华芳, 王兴龙, 等. 兔病毒性出血症病毒抗体间接ELISA检测方法的建立[J].畜牧与兽医, 2013, 45(1):29-33.
[9]Liu G Q, Ni Z, Yun T, et al. Rescued virus from infectious cDNA clone of rabbit hemorrhagic disease virus is adapted to RK13 cells line [J]. Chinese Sci Bull,2006, 51(14): 1698-1702.
[10]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Anal Biochem,1976, 72: 248-254.
[11]巩薇, 卫礼, 付瑞, 等. 兔出血症病毒血凝试验及血凝抑制试验影响因素的探讨[J]. 实验动物科学与管理, 2003,20(3): 7-10.
[12]李超美, 王芳, 蔡少平, 等. 检测兔出血症病毒抗体间接ELISA方法的建立[J]. 江苏农业学报, 2010, 26(3): 546-550.
[13]Abrantes J, van der Loo W, Le Pendu J, et al. Rabbit haemorrhagic disease (RHD)and rabbit haemorrhagic disease virus (RHDV): a review [J]. Vet Res, 2012, 43(1):12.
[14]Laurent S, Vautherot J F, Madelaine M F, et al.Recombinant rabbit hemorrhagic disease virus capsid protein expressed in baculovirus self-assembles into viruslike particles and induces protection [J]. J Virol,1994, 68(10): 6794-6798.
[15]Nagesha H S, Wang L F, Hyatt A D, et al. Selfassembly, antigenicity, and immunogenicity of the rabbit haemorrhagic disease virus (Czechoslovakian strain V-351)capsid protein expressed in baculovirus [J]. Arch Virol,1995, 140(6): 1095-1108.

