鸭坦布苏病毒病活疫苗(FX2010-180P株)毒种保存期的研究
吴晓刚,高旭元,余 磊,李雪松,闫丽萍,滕巧泱,李国新,李泽君
(中国农业科学院上海兽医研究所,上海200241)
鸭坦布苏病毒病是由鸭坦布苏病毒(duck Tembusu virus,DTMUV)引起的一种以蛋鸭产蛋下降为主要特征的传染病。该病2010年春季在中国上海市、浙江省和江苏省等地发生,继而传播到全国大多数养鸭地区[1,2]。病鸭主要表现为高热、运动障碍、食欲下降甚至废绝,产蛋鸭产蛋下降甚至停止,严重可导致死亡,死亡率可达 5%~10%[1,2]。几年来,鸭坦布苏病毒病给我国养鸭产业造成了巨大的经济损失。目前尚无商品化的疫苗用来预防鸭坦布苏病毒病。
在鸭坦布苏病毒病发生初期,我们分离到了1株鸭坦布苏病毒强毒株(FX2010株)[2]。把该强毒株在鸡胚成纤维细胞(chicken embryo fibroblasts,CEFs)上连续传代培养180代,获得了一株鸭坦布苏病毒弱毒株(FX2010-180P株),该弱毒株是一株安全性和免疫原性良好的疫苗候选毒株[3],我们以该弱毒株为种毒进行了鸭坦布苏病毒病活疫苗的研制。本研究对低温保存的鸭坦布苏病毒病活疫苗(FX2010-180P株)的原始种子和基础种子进行了纯净性检验、鉴别检验,并对毒种的病毒含量以及免疫原性进行了测定,为鸭坦布苏病毒病活疫苗的毒种保存期限提供了数据支持。
1 材料和方法
1.1 主要试剂 DMEM培养基、胎牛血清购自 Gibco公司,用于细胞培养;羊抗鼠 IgG-HRP 购自Sigma公司;TMB显色液购自武汉博士德公司;具有中和活性的抗鸭坦布苏病毒E蛋白的单克隆抗体由中国农业科学院上海兽医研究所禽传染病研究室制备并保存,这些试剂用于阻断ELISA。
1.2 毒种和细胞 鸭坦布苏病毒病活疫苗(FX2010-180P)的原始种子批(批号为179P-20110505)、基础种子批(批号分别为180P-20110507和180P-20110509)。DF-1细胞由中国农业科学院上海兽医研究所禽传染病研究室保存,用于病毒滴度测定及病毒分离。
1.3 实验动物 试验用鸭由种蛋(无特定病原,品种为麻鸭,购自中国农科院哈尔滨兽医研究所)孵化,并饲养于实验动物中心养鸭专用房间里的隔离器中,饲养至21日龄时使用。
1.4 鸡胚成纤维细胞(CEFs)的制备 取9~10日龄SPF鸡胚,无菌取出胚胎,去头、爪、翅及内脏,PBS洗涤2次,剪碎后,再用PBS液洗涤2次,自然沉淀,弃上清;每个胚加1~3 mL 0.25%胰蛋白酶溶液,37℃水浴中消化8~10 min,其间振荡3~4次,自然沉淀,弃上清;加入含有5%小牛血清的DMEM细胞生长液5~10 mL,用吸管反复吹打2~3次,450×g离心10 min,弃上清,取沉淀;加入含有5%小牛血清的DMEM细胞生长液,4层无菌纱布过滤,分装细胞瓶,置37℃、5%CO2培养箱中培养,细胞长成单层后,供接种病毒用。
1.5 毒种的TCID50测定 用无菌PBS将被检毒种按10倍比进行系列稀释,取10-4~10-7四个稀释度,分别接种于96孔细胞培养板上生长至80%~90%的DF-1细胞,每个稀释度接种4孔,每孔0.1 mL;37℃作用1~2 h, PBS清洗3次后换入含有2%胎牛血清的DMEM,5%CO2、37℃条件下继续培养6 d,观察并记录出现细胞病变的细胞孔,用Reed-Muench法计算病毒含量[4]。
1.6 病毒的传代与培养 取批号为180P-20110507毒种1支,用无菌PBS进行100倍稀释后,以0.1 MOI的量接种生长良好长成单层的CEF,吸附1.5 h。加入2%维持液,5%CO2、37℃条件下继续培养48 h,约80%细胞病变时,收获病毒液,离心后取上清液,分装。取一部分按照1.5方法测定病毒含量,其余部分置于-20℃保存待用。
1.7 细菌和支原体检验 按现行《中国兽药典》规定方法检验[5]。
1.8 外源病毒检验 按现行《中国兽药典》规定的相关方法进行[5]。将100倍稀释的毒种(病毒含量≥103.5TCID50)与等量的抗DTMUV单抗作用后,用于鸡胚检查法、细胞检查法、禽淋巴白血病病毒和禽网状内皮组织增生症病毒等检验。
1.9 鉴别检验 把毒种稀释至102.0TCID50/0.05 mL,与等量抗鸭坦布苏病毒特异性单抗(中和效价≥5)混合,置37℃中和1 h后,接种96孔细胞板上长成单层DF-1细胞,0.1 mL/孔,接种10孔。37℃作用1 h后,加入0.1 mL含5%胎牛血清的培养液,在5%CO2培养箱中37℃下培养144 h,观察细胞病变效应(cytopathic effect,CPE)[4]。
1.10 病毒的免疫原性检测 30只21日龄麻鸭,随机分成3组,每组10只。第1~2组分别接种剂量为101.5TCID50和102.5TCID50的由毒种增殖的病毒,接种方式为腿部肌肉注射,第3组为对照组,接种等体积的PBS。疫苗免疫后d14,采血,分离血清用于检测抗体。同时,每只鸭子肌肉注射103.5TCID50的鸭坦布苏病毒强毒(FX2010株)。攻毒后每天观察试验鸭的临床表现,并在d4剖杀,观察鸭的病理变化,并采集脾脏、肺脏、肾脏、脑组织,用于分离病毒。
1.11 抗体检测 按照参考文献[6]中的阻断ELISA检测鸭坦布苏病毒特异性抗体。用纯化的鸭坦布苏病毒作为包被抗原,4℃过夜;PBST缓冲液洗涤3次后,用5%脱脂乳封闭,37℃孵育1 h;PBST洗涤3次后,加入100 μL不同稀释度的血清样品,37℃孵育1 h;PBST洗涤3次后,加入抗鸭坦布苏病毒E蛋白单克隆抗体,37℃孵育1 h;PBST洗涤3次后,加入2000倍稀释的羊抗鼠 IgG-HRP,37℃孵育1 h;PBST洗涤3次后,每孔加入100 μL TMB显色液,避光显色10 min;每孔加入50 μL 2 mol/L H2SO4终止反应,酶标仪读取吸光度OD450值。按如下方法计算阻断率,阻断率(%)=(阴性对照的吸光度-待测样品的吸光度)/阴性对照的吸光度×100%。阻断率值≥18.4%,样品判定为阳性;阻断率值≤12.6%时,样品判定为阴性;阻断率值介于二者之间时,判定为可疑,重新检测阻断率仍小于18.4%则判为阴性。判定为阳性的血清样品的最高稀释倍数即为该血清样品的抗体效价。
1.12 病毒分离 将采集的脾脏、肺脏、肾脏和脑等组织,每克组织加1 mL PBS,研磨后离心,取上清。每种组织上清液分别接种DF-1细胞,分离病毒。同时,取等体积的脾脏、肺脏、肾脏和脑组织上清液混合后,接种DF-1细胞,观察6 d,出现典型的细胞病变判为阳性。
2 结果
2.1 低温保存的毒种病毒含量测定 种毒在保存16个月后,经在DF-1细胞上进行病毒滴定,确定批号为179P-20110505的3份毒种的病毒含量分别为105.5、105.0、105.5TCID50/0.1mL;批号为180P-20110507的3份毒种的病毒含量分别为105.5、105.0、105.5TCID50/0.1 mL;批号为180P-20110509的3份毒种的病毒含量分别为105.67TCID50、105.67、105.5TCID50/0.1mL。与初始毒价相比,种毒在保存16个月后,病毒滴度没有明显降低(表1)。
2.2 病毒的纯净性检验 对每批次毒种进行纯净性检验。结果显示无细菌、支原体和外源病毒污染。
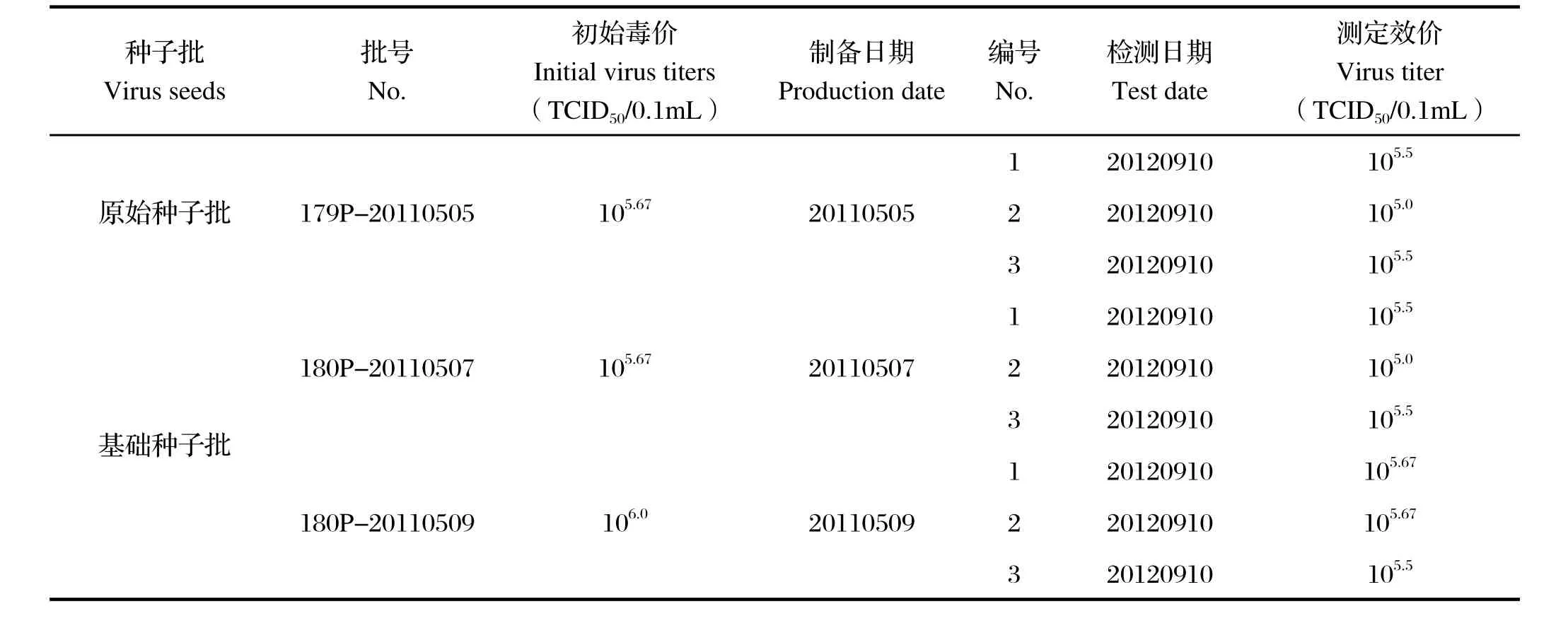
表1 鸭坦布苏病毒病活疫苗(FX2010-180P)毒种病毒含量检测结果Table 1 Results of virus titration of virus seeds for production of duck Tembusu virus live vaccine (FX2010-180P)
2.3 鉴别检验 每批毒种都可以被抗鸭坦布苏病毒特异性单克隆抗体中和,无CPE出现。
2.4 种毒的免疫原性检测 把基础种子在CEF上增殖后,低剂量免疫SPF麻鸭
2.4.1 抗体水平 雏鸭免疫后d14,第1、2组,即101.5TCID50和102.5TCID50剂量病毒免疫组,所有免疫鸭血清全部转阳,平均抗体效价分别达到1:41±23和1:50±22,而对照组鸭全部为阴性。
2.4.2 攻毒试验
2.4.2.1 临床症状 攻毒后,第1、2组免疫雏鸭在攻毒后饮食、粪便及精神状态等均无异常表现,而对照组雏鸭表现采食量下降,可见绿色稀便。
2.4.2.2 病理变化 攻毒后d 4剖检全部鸭,观察病理变化。第1组免疫鸭有1只表现为脾脏轻微肿大,该鸭抗体效价为1:10,其余9只鸭与第2组鸭的心脏、肝脏、脾脏、肺脏、肾脏、胃、肠等均无肉眼可见的病理变化。非免疫对照组鸭则全部表现为脾脏明显肿大。
2.4.2.3 病毒分离 102.5TCID50病毒免疫组的雏鸭的脾脏、肺脏、肾脏和脑等组织均没有分离到病毒;101.5TCID50疫苗免疫组中1只雏鸭的肺脏分离到了病毒;非免疫对照组鸭的脾脏、肺脏和肾脏都分离到了病毒,有7只雏鸭脑组织中分离到了病毒,统计结果见表2。
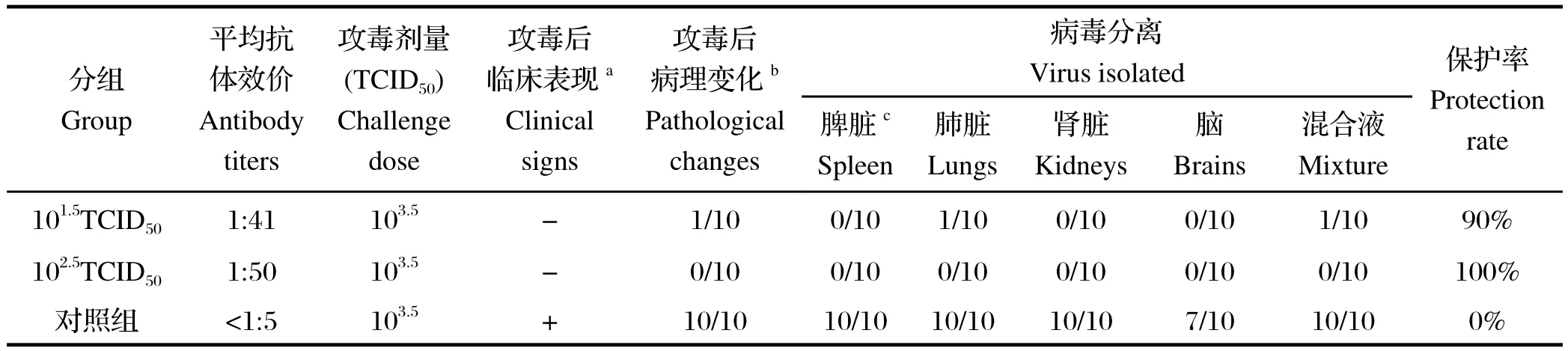
表2 鸭坦布苏病毒病活疫苗种毒接种鸭诱导的抗体水平及保护效力Table 2 The antibody titers and protection induced by the progeny of virus seeds for production of Duck Tembusu virus live vaccine in ducks
结果显示,鸭坦布苏病毒病活疫苗(FX2010-180P)毒种在保存16个月后,病毒含量没有明显下降,免疫原性良好,毒种增殖病毒以101.5TCID50剂量接种仍然可以为90%的接种鸭提供保护。
3 讨论
2010 年以来,鸭坦布苏病毒病已给中国养鸭业造成了巨大的经济损失,迫切需要安全性和免疫原性良好的疫苗来控制和预防该病的发生。黄病毒属的病毒中,已经报道了多株活疫苗,其中最为成功的是黄热病弱毒疫苗株(17D株)[7],该疫苗已有长期的安全性和有效性记载,成为研发其他黄病毒弱毒疫苗的模型。另外,乙型脑炎病毒(Japanese encephalitis virus,JEV),西尼罗病毒(West Nile virus,WNV),登革热病毒(Dengue virus,DENV)等病毒也已有多株活疫苗致弱毒株被报道[8-11]。对于黄病毒而言,将强毒株在培养介质中连续传代培养从而获得弱毒疫苗株是一种实用并可行的方法。例如,黄热病弱毒疫苗株(17D株)和乙型脑炎SA14-14-2 疫苗株即是通过强毒株进行连续传代培养获得的[12,13]。
本课题组将鸭坦布苏病毒强毒株(FX2010株)在CEFs上连续传代培养180代,获得了安全性和免疫原性良好的弱毒株(FX2010-180P株),并进行了鸭坦布苏病毒病活疫苗的研制。为了检验鸭坦布苏病毒病活疫苗(FX2010-180P)的毒种在低温条件下的保存期限,本研究抽取了3批次的毒种,分别检测了各批次毒种的毒价及其中1批次毒种作为免疫原的免疫效力。鸭坦布苏病毒病活疫苗(FX2010-180P株)种毒在-80℃保存16个月后,病毒含量没有明显降低,免疫原性良好,该毒种的保存期试验将继续进行。
[1]滕巧泱, 颜丕熙, 张旭, 等. 一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报, 2010, 18(6):1-4.
[2]Yan P, Zhao Y, Zhang X, et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China [J]. Virology, 2011, 417(1): 1-8.
[3]Li G, Gao X, Xiao Y, et al. Development of a live attenuated vaccine candidate against duck Tembusu viral disease [J]. Virology, 2014, 450-451: 233-242.
[4]Reed L J, Muench H. A simple method of estimating fifty percent endpoints [J]. Am J Hyg, 1938, 27: 493-497.
[5]中国兽药典委员会. 中华人民共和国兽药典(第三部)[M]. 2010 版. 北京: 中国农业出版社, 2011: 附录42-附录49.
[6]Li X, Li G, Teng Q, et al. Development of a blocking ELISA for detection of serum neutralizing antibodies against newly emerged duck Tembusu virus [J].PLoS One, 2012, 7(12): e53026.
[7]Monath T P. Yellow fever [M]// Plotkin S A, Orenstein W A. Vaccines. Third edition. Philadelphia, Pennsylvania:WB Saunders, 1999, 3: 815-880.
[8]McArthur M A, Holbrook M R. Japanese encephalitis vaccines[J]. J Bioterror Biodef, 2011, 25, S1: 2.
[9]Monath T P. Prospects for development of a vaccine against the West Nile virus [J]. Ann N Y Acad Sci, 2001,951: 1-12.
[10]Butrapet S, Huang C Y, Pierro D J, et al. Attenuation markers of a candidate dengue type 2 vaccine virus,strain 16681 (PDK-53), are defined by mutations in the 50noncoding region and nonstructural proteins 1 and 3 [J].J Virol, 2000, 74(7): 3011-3019.
[11]Chang G J, Kuno G, Purdy D E, et al. Recent advancement in flavivirus vaccine development[J]Expert Rev Vaccines, 2004, 3(2): 199- 220.
[12]Barrett A D, Teuwen D E. Yellow fever vaccine-how does it work and why do rare cases of serious adverse events take place? [J]. Curr Opin Immunol, 2009, 21(3):308-313.
[13]Yu Y. Phenotypic and genotypic characteristics of Japanese encephalitis attenuated live vaccine virus SA14-14-2 and their stabilities[J]. Vaccine, 2010, 28(21):3635-3641.

