姜黄素-邻二氮菲-镍配合物修饰电极的制备及其对葡萄糖的催化氧化*
王岩玲,王俊恩,曹静,吴婷婷
(淮北师范大学化学与材料科学学院,安徽淮北 235000)
姜黄素-邻二氮菲-镍配合物修饰电极的制备及其对葡萄糖的催化氧化*
王岩玲,王俊恩,曹静,吴婷婷
(淮北师范大学化学与材料科学学院,安徽淮北 235000)
研究了姜黄素-邻二氮菲-镍配合物修饰电极对葡萄糖的催化氧化行为。在pH 6.0的磷酸盐缓冲液条件下,姜黄素与邻二氮菲-镍配合物聚合,附着在铂碳电极上制得姜黄素-邻二氮菲-镍配合物修饰电极,该修饰电极对葡萄糖的催化效果优于姜黄素修饰电极。在优化测试条件下,姜黄素-邻二氮菲-镍配合物修饰电极对葡萄糖测定的线性范围为6.0×10-5~3.0×10-3mol/L,相关系数r=0.997 2。该修饰电极可用于测定血液中的葡萄糖,测定结果的相对标准偏差为2.16%~4.44%(n=10),回收率在98.2%~103.2%之间。该方法准确可靠,可用于测定血液中的葡萄糖。
姜黄素;姜黄素-邻二氮菲-镍配合物;修饰电极;葡萄糖;电催化氧化
葡萄糖是生物体内新陈代谢不可缺少的营养物质,葡萄糖氧化反应放出的热量是人类生命活动所需能量的重要来源。葡萄糖在生理条件下的氧化速度和完全度相对较低,葡萄糖氧化不完全产生的中间产物会影响大脑中枢神经系统的活动。长期以来,研制具有高灵敏度、高选择性的催化氧化葡萄糖传感器一直受到医药及食品行业的关注,电化学传感器在催化氧化葡萄糖方面的应用非常广泛[1-6]。
姜黄素(Cur)是从姜科姜黄属植物姜黄的干燥根茎中提取的天然活性成分,为二酮类化合物。姜黄素分子苯环上的4-羟基和3-甲氧基易发生氧化生成邻位醌式结构,醌式结构具有很强的氧化活性,可以使很多小分子还原性物质发生氧化,起到催化氧化媒质的作用[7-9]。姜黄素的结构式见图1。
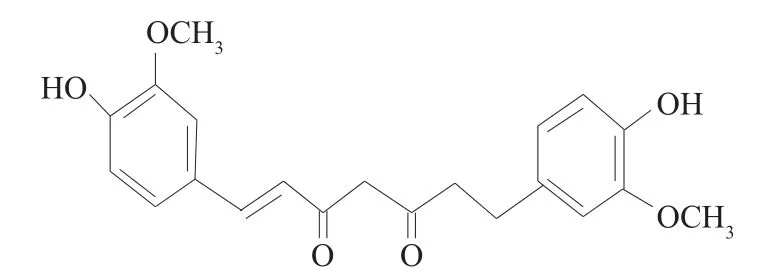
图1 姜黄素的结构式
姜黄素的水溶性及稳定性差,体内生物利用度低[7],因此其应用受到一定限制。多数金属配合物的水溶性和稳定性较好,如果将姜黄素与金属配合物结合,即可增加姜黄素的水溶性,实现对小分子化合物的催化。笔者将姜黄素和姜黄素-邻二氮菲-镍配合物(CPN)聚合到玻碳电极上,制备了膜修饰电极,研究了其对葡萄糖的催化氧化性质。
1 实验部分
1.1 主要仪器与试剂
电化学工作站:Lk2006型,天津市兰力科化学电子高技术有限公司;
pH计:pHSJ-3D型,上海今迈有限公司;
数控超声波清洗器:KQ-100DB型,昆山市超声仪器有限公司;
三电极体系:工作电极是修饰电极和玻碳电极,辅助电极为铂电极,参比电极为饱和甘汞电极;
六水合硝酸镍、邻二氮菲、姜黄素、葡萄糖:均为分析纯;
实验用水为石英亚沸水。
1.2 CPN配合物的合成
称取2.0 g水合1,10-邻二氮菲和11.5 g六水合硝酸镍,混合后加入温水,将其搅拌溶解,于室温放置,冷却后过滤,再用少量冰水洗涤沉淀,在空气中干燥,即得CPN配合物。
1.3 修饰电极的制备
将玻碳电极(GC)先用氧化铝粉末与水的混合物抛光,依次在乙醇、丙酮、蒸馏水中超声清洗。然后将其置于0.5 mol/L硫酸溶液中,在1.4~-0.5 V电位区间内扫描20周(扫描速率为100 mV/s)进行活化后用蒸馏水清洗备用。
将处理好的玻碳电极作为工作电极,以饱和甘汞电极为参比电极,铂丝为对电极,置于试样溶液(10 mmol/L姜黄素、4 mmol/L的邻二氮菲-镍配合物、0.1 mmol/L 磷酸盐缓冲液的混合溶液)中,在1.5~-1.5 V电位范围内进行扫描,扫描结束后用亚沸水淋洗电极表面即得到修饰电极。
2 结果与讨论
2.1 CPN配合物的电化学聚合
2.1.1 聚合底液pH的影响
实验考察了不同pH的磷酸盐缓冲溶液对聚合结果的影响。实验结果表明,CPN配合物在玻碳电极上的峰电位随溶液的pH值增大而负移,峰高也随溶液pH值增大而减小,图形趋于平缓,说明该电极过程有质子参与,氧化过程伴随质子的失去,其还原过程结合质子。在不影响图形的情况下,选择pH为6.4,该酸度条件下,实验比较温和。
2.1.2 聚合电位
分别固定正电位和负电位,为了使聚合后得到的修饰电极对葡萄糖的催化氧化具有较高的灵敏度,CPN配合物的聚合电位设定为1.5~-1.5V。
2.1.3 离子强度的影响
考查不同浓度的KCl溶液对电化学聚合的影响。实验结果发现KCl溶液浓度的改变对峰电流的影响不大,聚合过程不受离子强度的影响。
2.1.4 CPN的聚合循环伏安曲线
图2为CPN的循环伏安曲线。由图2可见,随着扫描次数的增加,无论是氧化峰还是还原峰,峰电流都持续增大,说明修饰物已经聚合在电极的表面,姜黄素和姜黄素-邻二氮菲-镍配合物修饰电极(CPNGC)制作完成且状态良好。
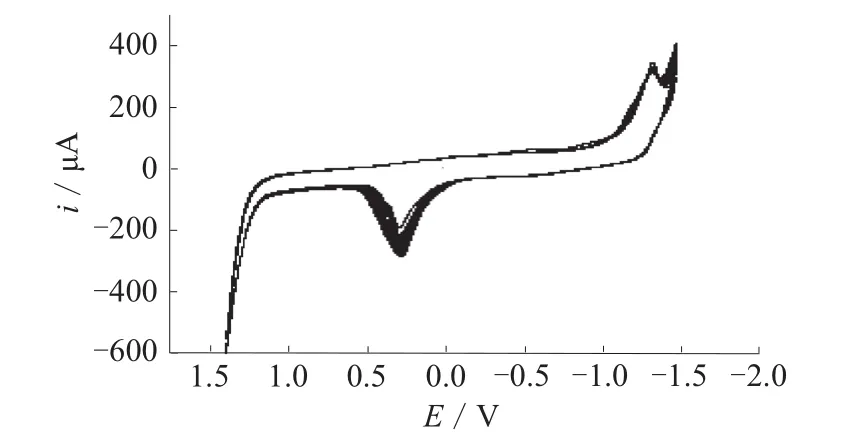
图2 CPN配合物溶液的循环伏安曲线
2.2 CPNGC对葡萄糖的催化作用
2.2.1 pH的影响
实验考查了不同pH的葡萄糖溶液对扫描曲线的影响。实验结果表明,在酸性条件下修饰电极比较稳定,葡萄糖的峰电流较大;在碱性条件下,修饰电极会被破坏,且对应葡萄糖的峰电流也有所下降。因此实验选择较温和的酸性条件(pH 6)作为测定葡萄糖的底液酸度。
2.2.2 CPNGC对葡萄糖的催化
图3是一组不同电极在不同溶液中的循环伏安曲线,反映了姜黄素修饰电极(CGC)对葡萄糖的催化氧化现象。其中曲线0显示的是裸电极在葡萄糖溶液中的循环伏安曲线,在扫描范围内没有明显的氧化还原峰;曲线1显示的是CGC在磷酸盐缓冲溶液中的循环伏安曲线,曲线中出现了姜黄素的一对氧化还原峰a和b。当向此溶液中加入不同浓度的葡萄糖时(曲线2,3),随着葡萄糖浓度的增加,原来的氧化还原峰a和b的峰电流都有所下降,而出现了新的氧化峰c(即葡萄糖的氧化峰),且电流会随着葡萄糖浓度的增大而增大。这说明CGC对葡萄糖具有明显的催化氧化作用。
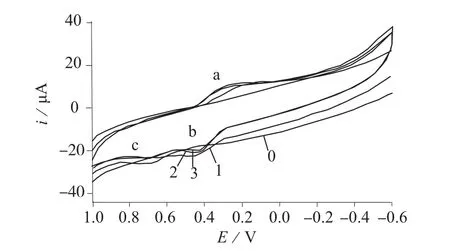
图3 CGC在不同浓度葡萄糖溶液中的循环伏安曲线
图4是CPNGC在不同浓度葡萄糖溶液中的循环伏安曲线。由图4可见,随着葡萄糖浓度的增大,原配合物的氧化还原峰(b和a)电流逐渐降低,而葡萄糖的氧化峰c的电流却越来越大。这说明CPNGC对葡萄糖有很好的催化效果。姜黄素的水溶性较差,需要在甲醇等有机溶剂中溶解,当将其与邻二氮菲-镍配合物结合后,溶解度增加。比较图3、图4可知,在同样的实验条件下,CPNGC比CGC对葡萄糖的催化效果更好。
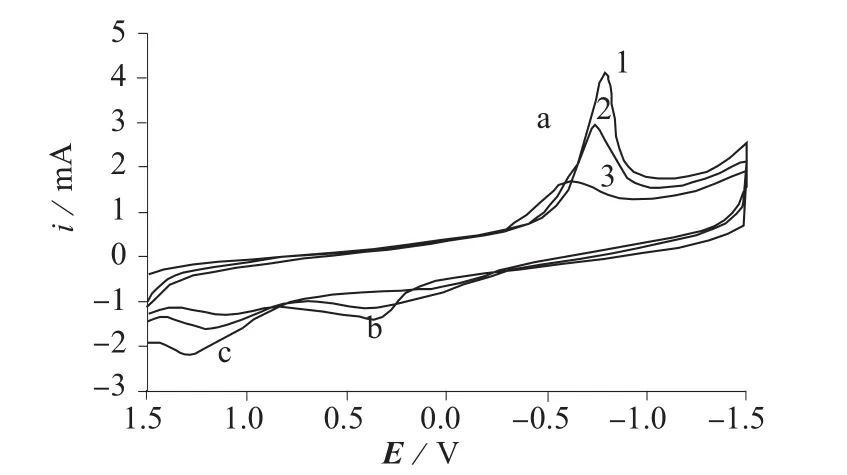
图4 CPNGC在不同浓度葡萄糖溶液中的循环伏安曲线
2.2.3 CPNGC对葡萄糖的线性响应
考查CGC,CPNGC两种修饰电极在不同扫描速率下对葡萄糖催化氧化的影响,结果发现葡萄糖的氧化峰电流IP与扫描速率的平方根ν1/2呈线性关系,因此葡萄糖在修饰电极上的氧化反应是受扩散控制的。当该两种修饰电极用于电化学检测葡萄糖时,CGC测定葡萄糖的线性范围为5×10-4~2×10-3mol/L,相关系数r=0.998 6;CPNGC测定葡萄糖的线性范围为6×10-5~3×10-3mol/L,相关系数r=0.997 2。通常人体生理水平的葡萄糖浓度为3~8 mmol/L,此时正常生理水平的抗坏血酸(0.1 mmol/L)及尿酸(0.02 mmol/L)对葡萄糖的检测不产生影响。
葡萄糖的催化氧化机理已有文献评述[10]。
2.3 CPNGC的分析应用
移取某血液试样(某医院取得)移至50 mL容量瓶中,用pH 6.0的磷酸盐缓冲溶液稀释到标线,用CPNGC电极作为工作电极,用标准加入法进行测定,结果见表1。由表1可知,10次测定结果的相对标准偏差为2.16%~4.44%,平均回收率在98.2%~103.2%之间,表明CPNGC电极稳定性良好,测量精密度和准确度都较高。
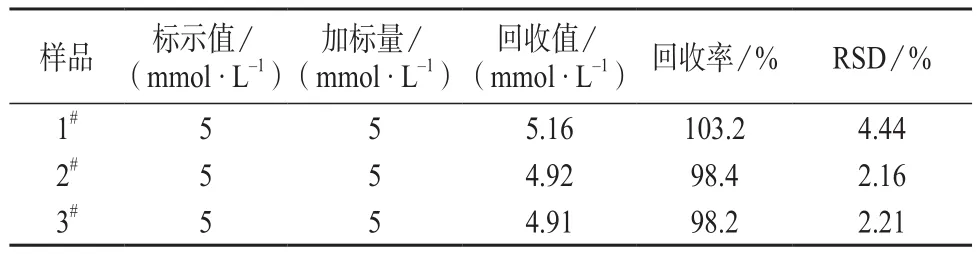
表1 样品测定结果(n=10)
3 结语
姜黄素与邻二氮菲-镍配合物在pH 6.4的磷酸盐缓冲液环境中聚合制成修饰电极,该修饰电极可定量催化葡萄糖的氧化反应,用于测定人体血液中的葡萄糖,测量精密度和准确度均满足要求。
[1]Zhang L,Dong S. The electrocatalytic oxidationg of ascorbic acid on polyanilinge film synthesized in the presence of camphorsulfonic acid[J]. J Electroanal Chem,2004,568(1): 189-194.
[2]石文韬,邸静,马占芳.电化学葡萄糖传感器[J].化学进展,2012,24(4): 568-576.
[3]Farhadi K,Kheiri F,Golzan M. Th(Ⅳ)-Hexacyanoferrate modified carbon paste electrode as a new electrocaatalytic probe for simultaneous determination of ascorbic acid and dopamine from acidic media[J]. J Braz Chem Soc,2008,19(7): 1 405.
[4]李银峰,欧阳华澎.基于ZnO/Nafion有机-无机复合膜固定双酶的葡萄糖传感器研究[J].河南城建学院学报,2011,20(5): 36-41.
[5]Ojani R,Raoof J B,Salmany-Afagh P. Electrocatalytic oxidation of soe carbohydrates by poly(1-naphthylamine)/nickel modified carbon paste electrode[J]. J Electroanal Chem,2004,571(1): 1-8.
[6]Warren S,Mccormac T,Dempsey E. Investigation of novel mediators for a glucose biosensor based on metal picolinate complexes[J]. Bioelectrochemistry,2005,67(1): 23-35.
[7]钟明远,全山丛,胡晋红.姜黄素制剂学研究进展[J].中成药,2007,29(2): 255-258.
[8]洪小平,蒋永祥,裴剑杰.姜黄素-碳纳米管-离子液体修饰电极对盐酸羟胺电催化氧化性能研究[J].科技通讯,2012,28(1): 20-24.
[9]潘国凤,张晓东,朱晓新.姜黄素的抗肿瘤作用及其机制研究最新进展[J].中药药理与临床,2007,23(5): 247-252.
[10]Elahi M Y,Heli H,Bathaie S Z,et al. Electrocatalytic oxidation of glucose at a Ni-curcuin modified glassy carbon electrode[J]. J Solid State Electrochem,2007,11(2): 273-282.
Preparation of Modified Electrode by Curcuin-Phenanthroline Monohydrate-Ni(Ⅱ) Complex and the Electrocatalytic Oxidation of Glucose
Wang Yanling, Wang Junen, Cao Jing, Wu Tingting
(School of Chemistry and Material Science, Huaibei Normal University, Huaibei 235000, China)
The electrocatalytic oxidation of glucose was investigated on the nickel-basedchemically modified electrodes prepared by electropolymerization of curcumin-phenanthroline monohydrate-Ni(Ⅱ)(CPN) complex. The preparetion of modifide electrodes and the eledtrocatalytic oxidation of gulcose were investigated by using cyclic voltammetry. Cyclic voltammograms showed that CPN modified electrode (CPNGC) exhibited a greater catalytic effect on glucose than curcumin modified electrode (CGC). Furthermore, the results showed that the linear response range of CPNGC electrode for glucose was 6×10-5-3×10-3mol/L with the correlation coefficent of 0.997 2. The modified electrode was applied to the detection of glucose in samples, RSD was 2.16%-4.44%(n=10), and the recovery was in the range of 98.2%-103.2%. The method is accurate and reliable and can be used for determination of glucose in the blood.
curcumin; curcumin-phenanthroline monohydrate-Ni(Ⅱ) complex; modified electrode; glucose; electrocatalytic oxidation
O614.122
A
1008-6145(2014)02-0018-03
10.3969/j.issn.1008-6145.2014.02.005
*安徽省自然科学基金项目(1308085QB42);安徽省“含能材料”重点实验室开放基金项目(KLEM2009012,KLEM2009013)
联系人:王岩玲;E-mail: wangyanl2002@163.com
2014-01-21

