瘤源性骨软化症的影像学诊断
瘤源性骨软化症(tumor-induced osteomalacia, TIO)是由肿瘤引起的肾脏排磷增加所致的一种代谢性骨病。国内首例TIO由张孝骞于1980年报道,目前国内外报道的TIO病例约160例[1]。TIO临床少见,发病隐蔽,特征性的临床表现较少,极易误诊。病程越长,致残率越高。本文回顾性分析7例TIO患者的影像学表现及临床表现,以提高临床对TIO的认识及诊断水平。
1 资料与方法
1.1 研究对象 收集2008~2014-02河南省洛阳正骨医院经临床、影像学、病理及随访证实的7例TIO患者,其中男4例,女3例;年龄33~55岁。7例肿瘤均发生于软组织内,3例位于大腿下段,臀部、上臂下段、腰部、足跟部各1例。临床表现:7例患者均出现全身多部位疼痛,胸腰骶部6例,髋部5例,季肋部4例,膝部4例,足跟部3例,每例患者疼痛部位均≥3个;2例病史较长者身高减低、驼背、胸廓畸形、长期卧床;4例行走呈鸭步样步态。患者病程6个月~10年。7例患者切除肿瘤前后均检测血清碱性磷酸酶(ALP)、血钙(Ca2+)、血磷(P),5 例肿瘤切除前检测血25-(OH)D、血清骨碱性磷酸酶(BAP)、血I型胶原C端肽(CTX)、血骨钙素(BGP)等骨代谢生化标志物。7例行X线检查及骨密度测定,4例行CT检查,4例行MRI检查,5例行99Tcm-亚甲基二磷酸盐(MDP)骨核素显像,6例行99Tcm-奥曲肽(OCT)核素显像。
1.2 影像学检查
1.2.1 X线检查、CT及MRI平扫 X线检查采用Kodak DR7500数字X线成像系统。CT检查采用Siemens Symbia-T6 SPECT/CT机,层厚4 mm,层间距3 mm,矩阵512×512,骨窗观察。MRI检查采用Marconi eclipse 1.5T 超导MRI仪,快速自旋回波(FSE)序列,T1WI、T2WI及脂肪抑制序列PDWI,根据病变部位行横断面、冠状面或矢状面扫描,层厚5 mm,层间距0.5 mm,矩阵256×256。主要检查胸腰椎、肋骨、骨盆、膝关节等疼痛部位。
1.2.2 骨密度测定 采用 HOLIGIC公司Delphi A(S/N45254)型双能X线骨密度仪,检测腰椎或髋部骨密度。
1.2.3 SPECT检查 采用Siemens Symbia-T6 SPECT/CT图像融合系统设备,采集能峰为140 keV,窗宽20%,矩阵256×256。全身骨显像,采用连续采集显像方法,15 cm/min。融合显像先进行SPECT采集,矩阵128×128,放大倍数1倍,旋转角度180°,6°/帧,采集时间20~30 s/帧。SPECT采集完成后,患者保持体位不动,选择局部骨断层显像范围进行CT扫描,层厚2 mm,螺距0.8,矩阵512×512。扫描完成后应用SPECT/CT图像融合软件配准、融合,获得SPECT/CT融合图像。
1.3 治疗方法 6例行奥曲肽核素扫描定位后行肿瘤切除术并病理检查,1例行右股骨下段皮下直接肿瘤切除术病理检查,2例行髋关节假体置换术。
2 结果
2.1 临床诊断情况 7例患者确诊之前全部误诊,其中6例误诊为骨质疏松症(OP),6例误诊为强直性脊柱炎(AS),2例误诊为腰椎间盘突出症(LDH),2例误诊为股骨头缺血性坏死(ANFH)。见表1。本组7例患者肿瘤切除术后疼痛症状均得到缓解,疼痛缓解时间5~23 d。
2.2 实验室检查结果 7例患者肿瘤切除前血清ALP增高,血钙正常,血磷明显减低;5例患者血CTX、BAP明显增高;肿瘤切除后,血ALP 10~46 d恢复正常,血磷6~20 d恢复正常,见表2。
2.3 影像学表现
2.3.1 X线表现 7例均表现为骨质结构模糊,骨小梁结构不清,骨密度减低,呈“雾霾征”(图1),6例表现为不同程度的骨折和假性骨折。2例病程较长者脊柱椎体多发压缩骨折,胸骨前突弯曲变形(图2A),骨盆呈三角样变形(图2B)。
2.3.2 骨密度测定结果 7例患者骨密度测定结果均提示严重骨质疏松样改变,见表3。
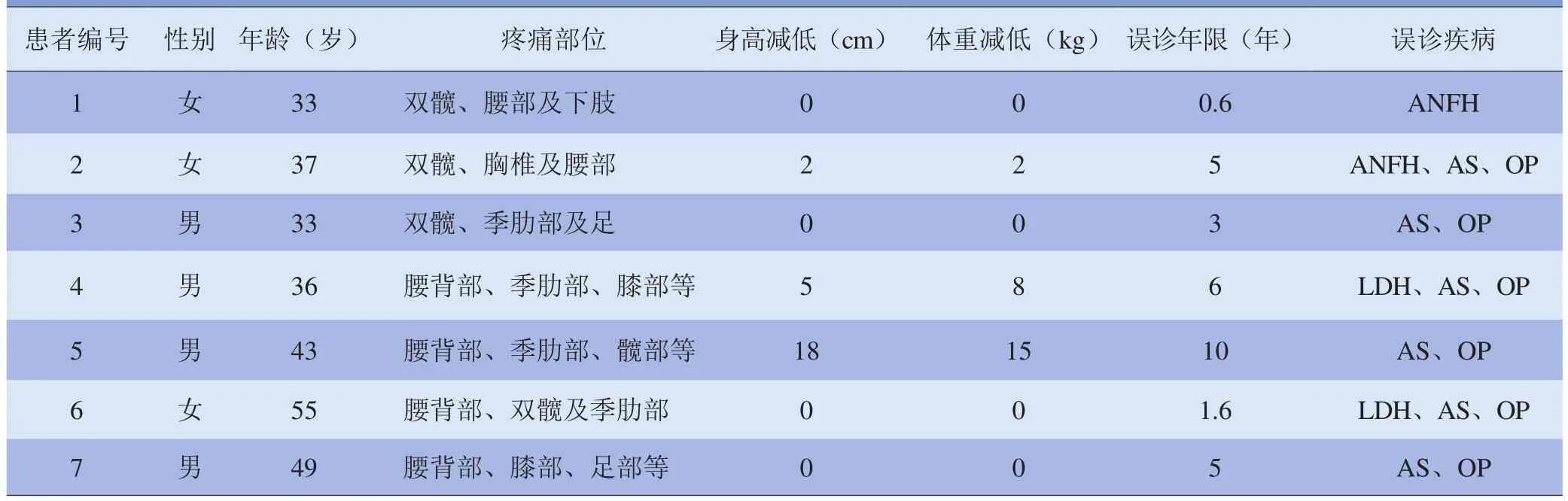
表1 7例患者的一般资料及临床表现

表2 7例TIO患者实验室检查结果*
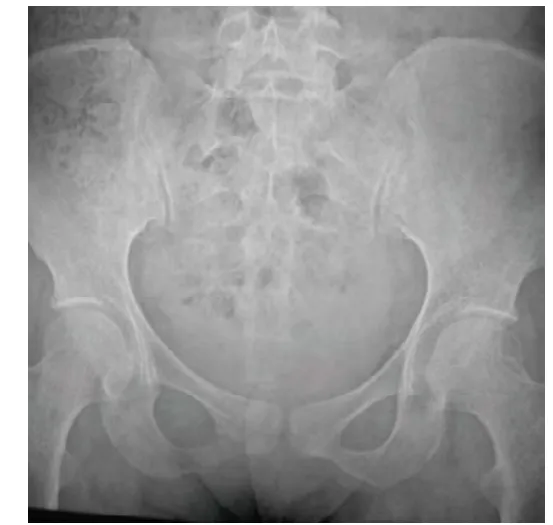
图1 女,33岁,右臀部血管内皮细胞瘤。骨盆骨质及骨小梁结构模糊,呈“雾霾征”
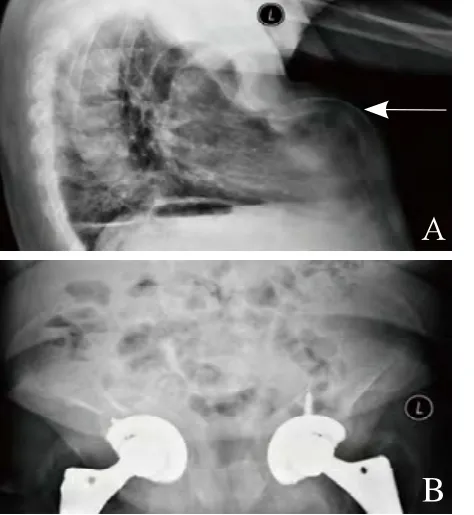
图2 男,43岁,右股骨下段软组织良性间叶组织肿瘤。胸腰椎多发骨折,胸骨弯曲变形(箭,A);骨盆呈三角样变形,双髋关节置换(B)

表3 7例TIO患者骨密度测定结果
2.3.3 CT及MRI表现 7例患者CT、MRI及X线均表现为多发骨折和骨骼变形。4例CT及MRI检查显示隐性骨折,包括腰椎2例、耻骨1例、坐骨1例。5例胸腰椎MRI表现为椎体呈双凹变形、楔形骨折,新鲜骨折与陈旧骨折并存,脊髓及硬膜囊受压不明显(图3)。2例髋部MRI表现股骨颈水肿样信号伴假骨折线影(图4)。
2.3.4 SPECT骨扫描表现 5例TIO患者99Tcm-MDP全身骨显像表现为多发异常放射性摄取增高,即表现为脊柱及四肢长骨多发性放射性摄取增高,颅骨放射性摄取增高,即“黑颅征”(图5)。3例肋骨呈串珠样(图6A)。2例表现为颅骨及松质骨肌肉韧带附着点放射样浓聚,2例显示膝关节干骺端呈条带样、对称性浓集影(图6B),2例单侧股骨颈片状浓集影,1例肋骨假骨折线影(图6C)。
2.3.599Tcm-OCT核素显像特点 6例患者行99Tcm-OCT核素显像,肿瘤位于软组织内,呈生长抑素受体高表达显像,其中股骨下端2例(图7),臀部1例,上臂下段1例,腰部1例,足跟部1例。
2.3.6 病理结果 7例患者肿瘤切除术后血磷升高(表2)、疼痛缓解。3例病理诊断为间叶组织细胞瘤(图8A、B),1例为低度恶性间叶瘤(图9A、B),1例为纤维瘤,1例为腱鞘巨细胞瘤,1例为血管内皮细胞瘤。
3 讨论
3.1 病因及发病机制 TIO是低磷性骨软化症的一种类型,由具有内分泌功能的肿瘤引起肾小管排磷增加,造成低血磷性骨软化症。该肿瘤多数为良性,少数是恶性[2]。本组6例均为良性肿瘤,1例为低度恶性肿瘤。TIO肿瘤的种类较多,大多数来源于多功能原始间叶组织,如血管瘤、血管内皮瘤、纤维瘤等[3]。本组3例病理诊断为间叶组织细胞瘤,1例为低度恶性间叶瘤,与文献报道基本一致。目前,TIO的病理机制尚不清楚,多数学者认为与纤维细胞生长因子-23(FGF-23)、细胞外基质磷酸糖蛋白、分泌型卷曲相关蛋白-4等调磷因子有关[4,5]。

图3 男,49岁,左上臂下段皮下良性间叶组织肿瘤。胸腰椎MRI压脂像示胸腰椎多发压缩骨折,新鲜与陈旧并存,椎体呈双凹样变形(箭)
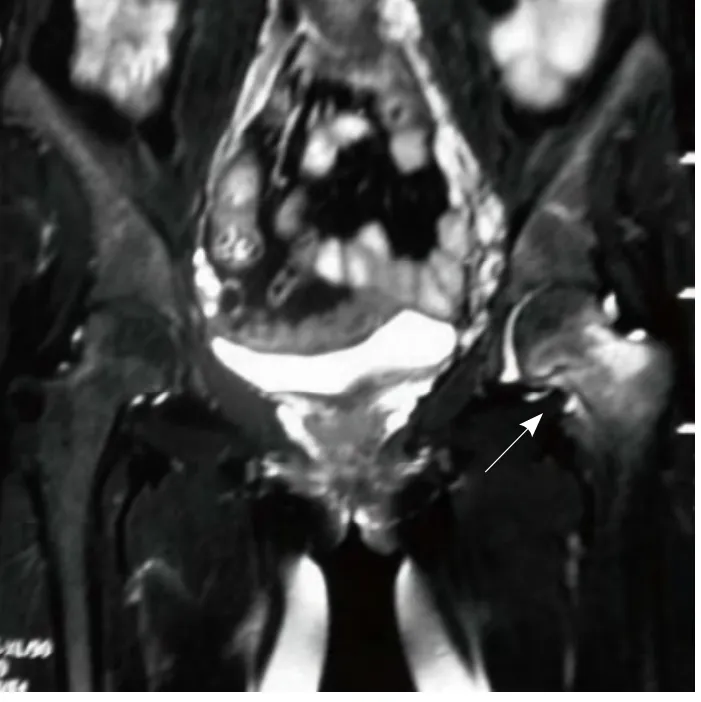
图4 男,33岁,腰背部软组织良性间叶组织肿瘤。MRI压脂像示左股骨颈水肿样高信号,伴有线样低信号假骨折线(箭)

图5 男,33岁,右跟部软组织腱鞘巨细胞瘤。99Tcm-MDP全身骨显像示干骺端多发异常浓聚(箭),颅骨放射性摄取增高,即“黑颅征”(箭头)
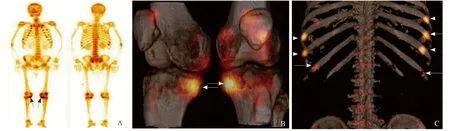
图6 男,36岁,右股骨下段皮下纤维瘤。99Tcm-MDP全身骨显像示肋骨与肋软骨交界处异常浓聚,双膝胫骨干骺端对称性浓聚(箭,A);SPECT/CT图像融合三维重建膝关节显示胫骨干骺端对称性浓聚(箭,B);SPECT/CT图像融合三维重建显示肋骨多发浓聚(箭头)和假骨折线影(箭,C)
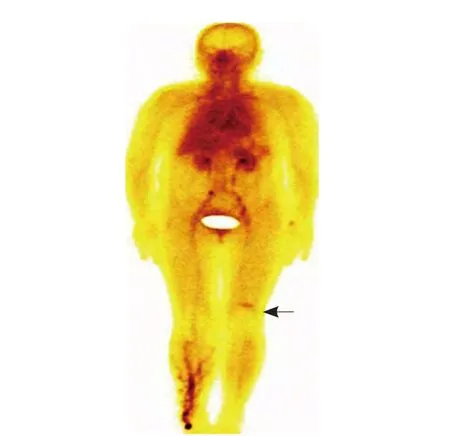
图7 女,55岁,左股骨下段软组织低度恶性间叶瘤。99Tcm-OCT核素全身显像示左大腿髌骨上缘梭型放射性浓聚(箭);右小腿及左腕部浓聚影为注射显像剂污染伪影
3.2 临床表现与误诊 TIO多发于青壮年,起病隐匿,病程长,临床少见,极易误诊,本组7例患者误诊时间最短6个月,最长10年。钟定荣等[6]报道的10例TIO患者,误诊时间最长达27年。本组7例曾误诊为OP、AS各6次,可能原因是临床医师对TIO与OP、AS的认识不足所致,OP多见于老年患者,骨折发生部位多见于胸腰椎、髋部及腕部,X线表现为骨小梁稀疏、清晰,多数血磷正常。AS多见于青少年,主要特征为晨僵及腰骶部酸困疼痛,病程久者可合并OP,根据实验室检查结果较易诊断。TIO是具有内分泌功能的肿瘤引起的骨软化症,肿瘤容易被忽视,骨骼改变主要是骨软化症表现,X线特点是骨小梁模糊和假骨折线,胸腰椎呈“双凹征”,且有低磷血症。
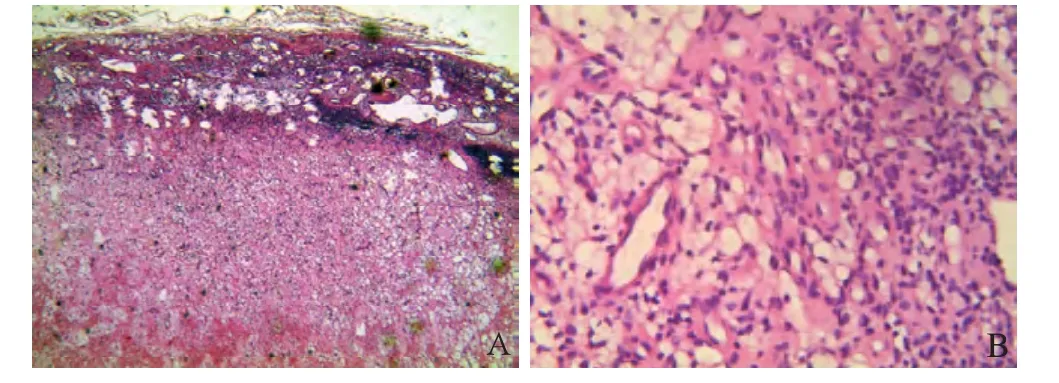
图8 男,43岁,右股骨下段软组织良性间叶组织肿瘤。间叶组织细胞瘤,肿瘤由外向内依次为包膜、丰富血管扩张的肉芽肿区、成纤维脂肪细胞区和纤维性变性区(HE, ×40, A);成纤维脂肪细胞区呈大量成纤维细胞和脂肪细胞(HE, ×400, B)
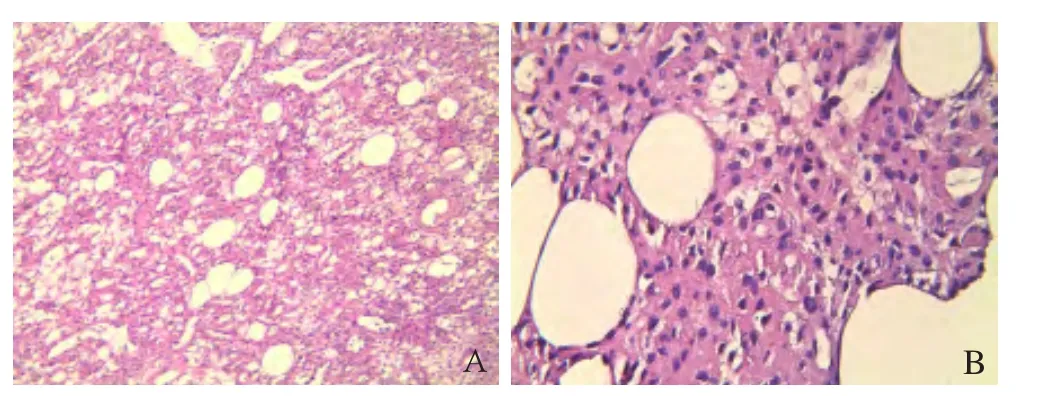
图9 女,55岁,左股骨下段软组织低度恶性间叶瘤。病理镜下见肿瘤组织由圆形、梭形、不规则形细胞构成,散在有脂肪组织,血管相对丰富并有扩张(HE, ×300, A);细胞核有异型性、浓染,细胞界限不清,肿瘤组织穿插于脂肪组织中间(HE, ×400, B)
TIO的特异性临床表现为肌肉无力、多部位骨痛、多发性骨折并骨骼畸形。患者多于30岁左右出现症状,起病隐匿,病程长,骨痛呈渐进性发展,多在四肢和负重关节;其生化特点为血磷降低,尿磷排出增多,ALP增高,血钙一般正常,少数可伴有继发性甲状旁腺功能亢进。肿瘤切除后,血磷短期内恢复正常,疼痛明显改善。本组7例疼痛部位多在3个部位以上,2例误诊时间较长者胸廓、脊柱、骨盆等部位骨骼变形。血ALP增高,血磷明显减低,血钙正常。本组5例患者血CTX、BAP明显增高,提示TIO患者骨吸收与骨形成均较快,骨转换速率较快,可能是造成TIO患者骨密度减低及多发骨折的原因。
由于TIO患者尿磷排泄增加,血磷减低,导致骨骼钙磷代谢紊乱,引起骨软化性骨密度减低。本组7例患者骨密度呈严重骨质疏松样改变,且骨密度与患者的年龄极不相称,是TIO的诊断特征之一。
3.3 影像学表现 TIO骨骼软化的X线表现与其他骨软化症无区别,典型表现为骨小梁模糊,多发的假性骨折线或骨折,椎体呈“双凹征”样改变,骨盆呈“三角样”改变等骨骼畸形。通常X线平片即可对骨软化明确诊断,特殊情况可以行CT和MRI检查,本组运用CT检查明确了X线检查不能确定的骨折,运用MRI检查发现TIO骨骼的隐性骨折、骨内水肿,鉴别出新鲜骨折与陈旧骨折,但未对肿瘤进行研究。余卫等[7]认为,CT及MRI检查能够显示TIO患者的肿瘤影像,但其影像学表现不具有特征性。Nakanishi 等[8]采用全身MRI扫描对TIO肿瘤发现有一定的价值,有待进一步研究。
本组5例TIO患者的骨显像具有一定的特征。首先,99Tcm-MDP全身骨显像的整体表现为代谢性骨病特点,即表现为脊柱及四肢长骨多发性放射性摄取增高,颅骨放射性摄取增高,即“黑颅征”[9]。5例骨显像表现为局灶性点状放射性浓集区,多位于肋骨或四肢长骨的承重部位,假性骨折是骨软化症的影像学特征之一[10,11]。3例患者出现肋软骨结合部对称性摄取增高,呈串珠样表现;2例患者骨骺出现对称性片状放射性摄取增高,可能与干骺端骨转换加快有关。全身骨显像可以显示假骨折的部位和受累范围,为诊断骨软化症提供了一种非常有价值的影像手段。但99Tcm-MDP全身骨显像不能对TIO进行肿瘤定位[12]。
3.4 肿瘤定位 诊治TIO的关键是确定肿瘤部位,目前寻找肿瘤的方法有99Tcm-OCT核素显像、PET/CT和分段取血FGF-23水平测定等[13,14]。由于PET/CT价格昂贵,分段取血FGF-23水平测定比较麻烦,临床少用。目前运用99Tcm-OCT核素显像进行TIO肿瘤定位越来越多。本组7例患者中,6例采用99Tcm-OCT核素显像技术成功对肿瘤进行定位,然后进行外科肿瘤切除,血磷在短时间内升高、疼痛明显缓解,阻止了骨软化症的发展。TIO含有生长抑素受体,而99Tcm-OCT核素能够特异性地与肿瘤的生长抑素受体结合显像,为肿瘤定位提供了有效的帮助,提高了肿瘤定位的诊断率。
总之,TIO临床罕见,容易误诊。TIO的影像学特征为骨小梁模糊,呈“雾霾征”,多发假骨折线和骨折,椎体呈“双凹征”,三角样骨盆,骨骼畸形改变。骨密度呈严重骨质疏松样改变。全身骨显像呈多发骨骼摄取增高、浓聚及“黑颅征”、“串珠肋”征象。奥曲肽显像对于肿瘤定位具有较高的特异性。TIO的诊治首先需确定低血磷性骨软化症,然后定位肿瘤位置,最后行肿瘤切除并观察血磷、尿磷变化及疼痛缓解情况。当临床发现骨软化症影像学特征时,需进一步追踪低磷性骨软化症的病因,并进行鉴别诊断,以提高TIO的诊断率。
[1]巴建明, 桑艳红, 陆菊明, 等. 12例肿瘤性骨软化症的临床诊治及术后随访. 中华内分泌代谢杂志, 2011, 27(1): 19-23.
[2]郑燕芳, 陆菊明. 肿瘤相关性低磷骨软化病13例临床分析.疑难病杂志, 2012, 11(8): 630-632.
[3]Lmel EA, Peacock M, Pitukcheewanont P, et al. Sensitivity of fibroblast growth factor 23 measurements in tumor-induced osteomalacia. J Clin Endocrinol Metab, 2006, 91(6): 2055-2061.
[4]Imanishi Y, Hashimoto J, Ando W, et al. Matrix extracellular phosphoglycoprotein is expressed in causative tumors of oncogenic osteomalacia. J Bone Miner Metab, 2012,30(1): 93-99.
[5]Houang M, Clarkson A, Sioson L, et al. Phosphaturic mesenchymal tumors show positive staining for somatostatin receptor 2A (SSTR2A). Hum Pathol, 2013, 44(12): 2711-2718.
[6]钟定荣, 刘彤华, 杨堤, 等. 骨软化或佝偻病相关的间叶组织肿瘤临床病理分析. 中华病理学杂志, 2005, 34(11): 724-728.
[7]余卫, 林强, 张云庆, 等. 瘤源性骨质软化症的影像学表现及临床诊断价值. 中华放射学杂志, 2006, 40(6): 616-620.
[8]Nakanishi K, Sakai M, Tanaka H, et al. Whole-body MR imaging in detecting phosphaturic mesenchymal tumor (PMT)in tumor-induced hypophosphatemic osteomalacia. Magn Reson Med Sci, 2013, 12(1): 47-52.
[9]杨芳, 张连娜, 冯瑾. 骨软化症核素骨显像影像特征分析.临床和实验医学杂志, 2013, 12(9): 656-658, 661.
[10]裘华兴, 夏瑞明. 维生素D缺乏性佝偻病的X线诊断. 实用放射学杂志, 2012, 28(8): 1262-1265.
[11]朱怀仕, 张建华, 王仁法. 肾小管性骨营养不良的临床与影像学. 实用放射学杂志, 2009, 25(4): 542-545, 592.
[12]Imanishi Y, Nakatsuka K, Nakayama T, et al. False-positive magnetic resonance imaging skeletal survey in a patient with aporadic hypophosphatemic osteomalacia. J Bone Miner Metab, 2003, 21(1): 57-59.
[13]Palot Manzil FF, Bhambhvani PG, O'malley JP. Evaluation of tumor-induced osteomalacia with 111In-pentetreotide scintigraphy. J Nucl Med Technol, 2013, 41(4): 299-301.
[14]Chong WH, Andreopoulou P, Chen CC, et al. Tumor localization and biochemical response to cure in tumor-induced osteomalacia. J Bone Miner Res, 2013, 28(6): 1386-1398.

