三维快速梯度回波水激发序列评价前交叉韧带损伤后膝关节软骨的形态学改变
马春忠 MA Chunzhong
于晓坤 YU Xiaokun
刘圣源 LIU Shengyuan
李 磊 LI Lei
张 乐 ZHANG Le
三维快速梯度回波水激发序列评价前交叉韧带损伤后膝关节软骨的形态学改变
马春忠 MA Chunzhong
于晓坤 YU Xiaokun
刘圣源 LIU Shengyuan
李 磊 LI Lei
张 乐 ZHANG Le
目的应用MRI三维快速梯度回波水激发序列观察前交叉韧带(ACL)损伤后膝关节软骨的形态学改变。资料与方法20例单侧膝关节ACL损伤患者行MRI三维快速梯度回波水激发成像扫描,分别扫描患者患侧及健侧膝关节,通过矢状位成像测量膝关节不同部位软骨体积,比较患侧和健侧的差异。结果ACL损伤患者患侧膝关节软骨总体积小于健侧(t=2.0263, P<0.05);男性患侧与健侧膝关节软骨总体积比较差异无统计学意义(P>0.05),女性患侧与健侧膝关节软骨总体积差异有统计学意义(t=2.6508, P<0.01);女性与男性比较,股骨外侧髁、胫骨外侧平台软骨体积改变更明显(t=2.0795, P<0.05; t=2.5339, P<0.01)。结论MRI三维快速梯度回波水激发序列可以用于评价前交叉韧带损伤后膝关节软骨体积的改变,女性前交叉韧带损伤后膝关节软骨改变更明显。
前交叉韧带;膝关节软骨;软骨,关节;磁共振成像;男(雄)性;女(雌)性
前交叉韧带(anterior cruciate ligament, ACL)损伤是最常见、最重要的运动损伤之一,是导致膝关节软骨形态和结构改变的直接原因[1]。由于软骨接触面承重部位的压力分布不同[2],ACL损伤的同时破坏了股胫关节软骨,最终发展为骨关节炎。MRI是一项非侵袭性、敏感有效的检查手段,通过对软骨形态的定量分析,获得膝关节软骨的体积和厚度,从而提供重要的有关病理学机制方面的证据[3-5]。既往研究采用MRI定量分析评价膝关节软骨形态学改变,发现在急性ACL损伤后的第1年内,出现股骨滑车处的软骨体积减少,而股骨内侧近中央处软骨有所增加[6],提示膝关节软骨在急性ACL损伤后会经历一系列形态学改变。本研究拟对ACL损伤患者进行MRI扫描,并以对侧正常膝关节为对照,以评价ACL损伤早期膝关节软骨形态的改变。
1 资料与方法
1.1 研究对象 2013-05~2014-01在天津市第五中心医院就诊的20例单侧ACL损伤患者,均经关节镜手术证实,排除明显膝关节软骨缺损、既往接受膝软骨手术、骨关节炎及对侧膝关节有过外伤、手术或伴发其他疾病者。其中男10例,女10例;年龄21~39岁;体重55~79 kg;右膝关节损伤11例,左膝关节损伤9例;损伤时间1~6个月。男、女患者年龄、体重指数及损伤时间差异均无统计学意义(t=5.0123、3.2580、3.6521, P>0.05),见表1。所有受试者均知情同意并签署知情同意书。
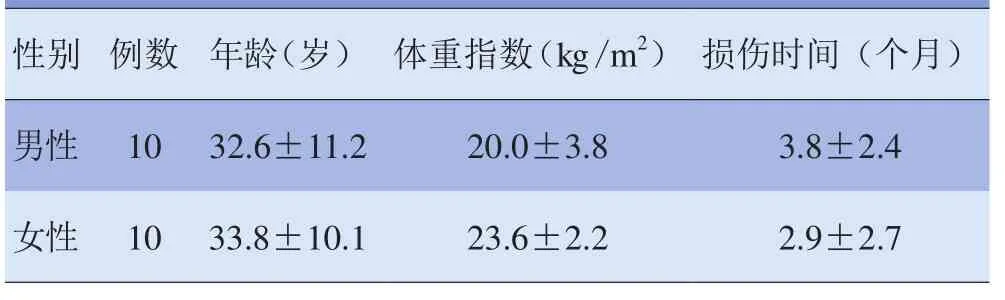
表1 不同性别ACL损伤患者基本资料比较
1.2 仪器与方法 采用Philips 3.0T双源MRI扫描仪,图像采集采用膝关节自然伸直位,将膝关节置于线圈中央,利用矢状位三维快速梯度回波水激发序列,TE 5 ms,TR 20 ms,翻转角15°,视野16 cm×16 cm,层厚2 mm,层间距1 mm,重建层厚4 mm。
1.3 图像分析 将图像导入Rhinoceros 4.0后处理工作站,膝关节骨和软骨轮廓手动描绘(图1),三维几何模型下膝关节的骨骼和相应的软骨构建的准确性和精确性可被验证,这个软骨厚度测量的精确度基于MRI的膝关节三维表面模型[2]。
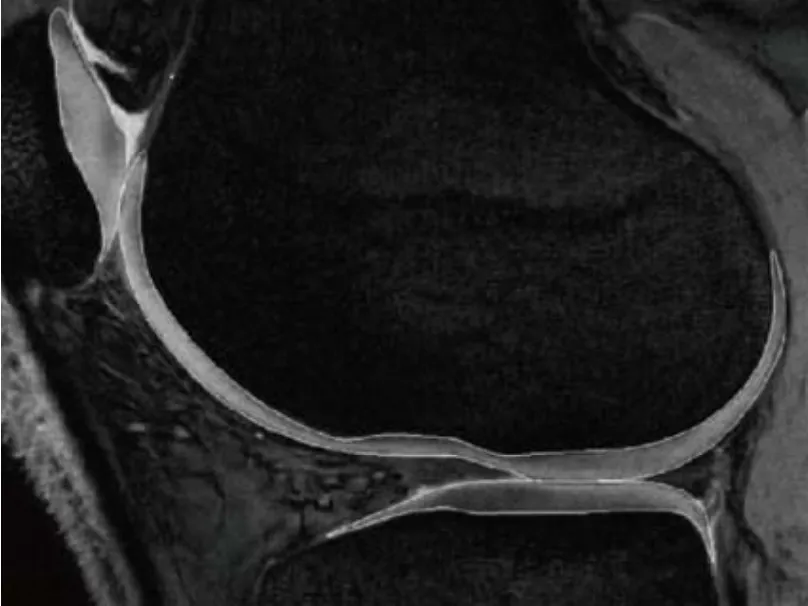
图1 膝关节软骨体积的MR手动描绘
股骨远端的软骨分为股骨外侧髁(lateral femoral condyle, LF)、股骨内侧髁(medial femoral condyle, MF)和滑车(trochlea, Tr),胫骨近端的软骨分为胫骨外侧平台(lateral tibial plateau, LT)和胫骨内侧平台(medial tibial plateau, MT)。分区的标准是根据ACL和后交叉韧带(posterior cruciate ligament, PCL)的附着点(图2),软骨体积用Rhinoceros软件直接测量。
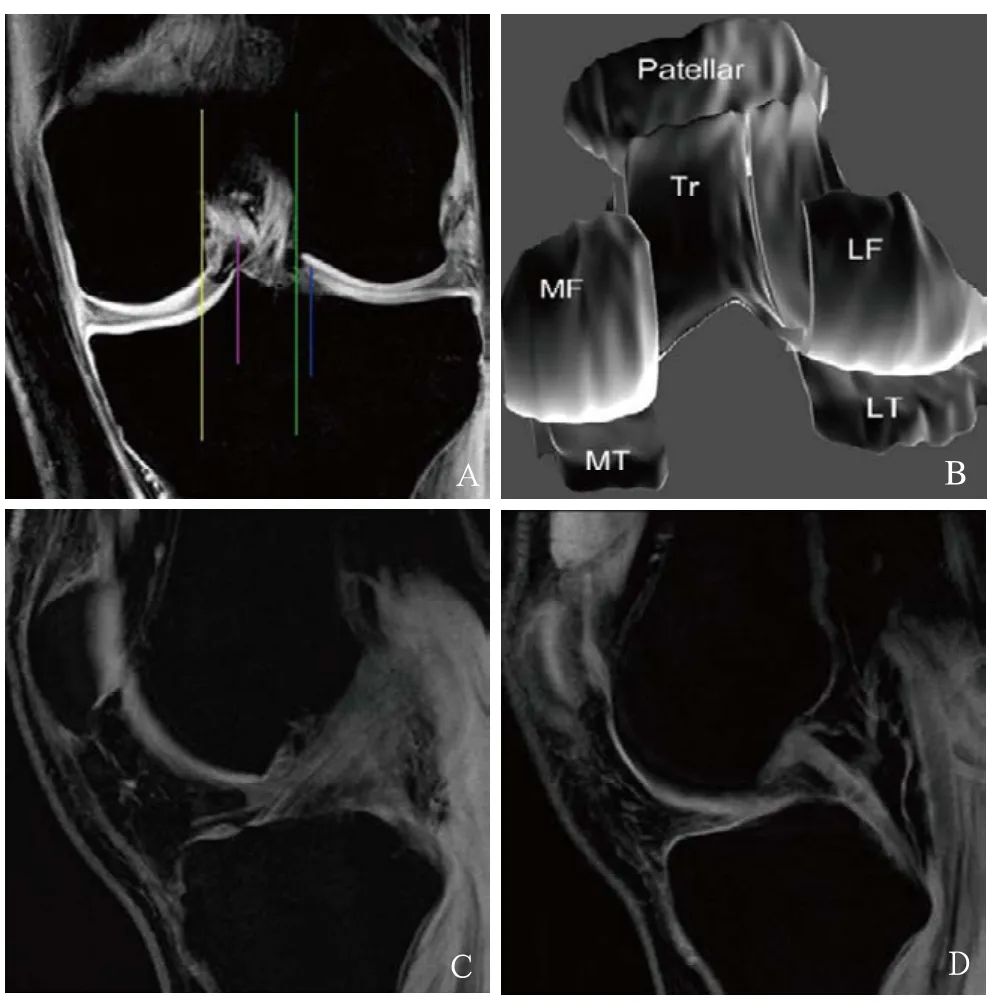
图2 膝关节软骨分区及结构。A为膝关节软骨分区,绿线:前交叉韧带位于股骨外侧髁内缘的附着处为股骨外侧髁与滑车软骨的分界;黄线:后交叉韧带位于股骨内侧髁外缘的附着处为股骨内侧髁与滑车软骨的分界;粉线及蓝线:前、后交叉韧带位于胫骨髁间起始处为胫骨内、外侧平台软骨的分界;B为膝关节软骨的三维大体图像;C、D为矢状位图像中显示的前交叉韧带及后交叉韧带层面。Patellar:髌骨;Tr:滑车;MF:股骨内侧髁;LF:股骨外侧髁;MT:胫骨内侧平台;LT:胫骨外侧平台
1.4 统计学方法 采用Statistica 16.0软件,以患者健侧软骨体积作为对照,患侧和健侧软骨体积比较采用配对t检验,同时按性别进行分层分析,男性和女性患者组内比较采用配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 健侧与患侧膝关节软骨体积比较 20例ACL损伤患者患侧与健侧膝关节软骨总体积比较差异有统计学意义(t=2.0263, P<0.05),其中股骨、胫骨总体积以及LF、LT处患侧与健侧膝关节软骨体积差异有统计学意义(t=2.0105、2.0100、1.9451、1.9701, P<0.05),而髌骨、MF、Tr和MT处患侧与健侧膝关节软骨体积差异无统计学意义(t=0.4850、0.2747、0.8414、0.6201, P>0.05),见表2。
2.2 不同性别ACL损伤患者健侧与患侧膝关节软骨体积比较 男性患者患侧与健侧膝关节软骨总体积及各部位软骨体积差异均无统计学意义(P>0.05)。女性患者患侧膝关节软骨总体积、股骨及胫骨软骨总体积及LF、LT处软骨体积较健侧减小,差异有统计学意义(t=2.6508、2.0314、1.9439、2.0795、2.5339, P<0.01、P<0.05),而髌骨、MF、Tr、MT处软骨体积差异无统计学意义(t=0.4207、1.5732、0.8944、0, P>0.05)。见表2。
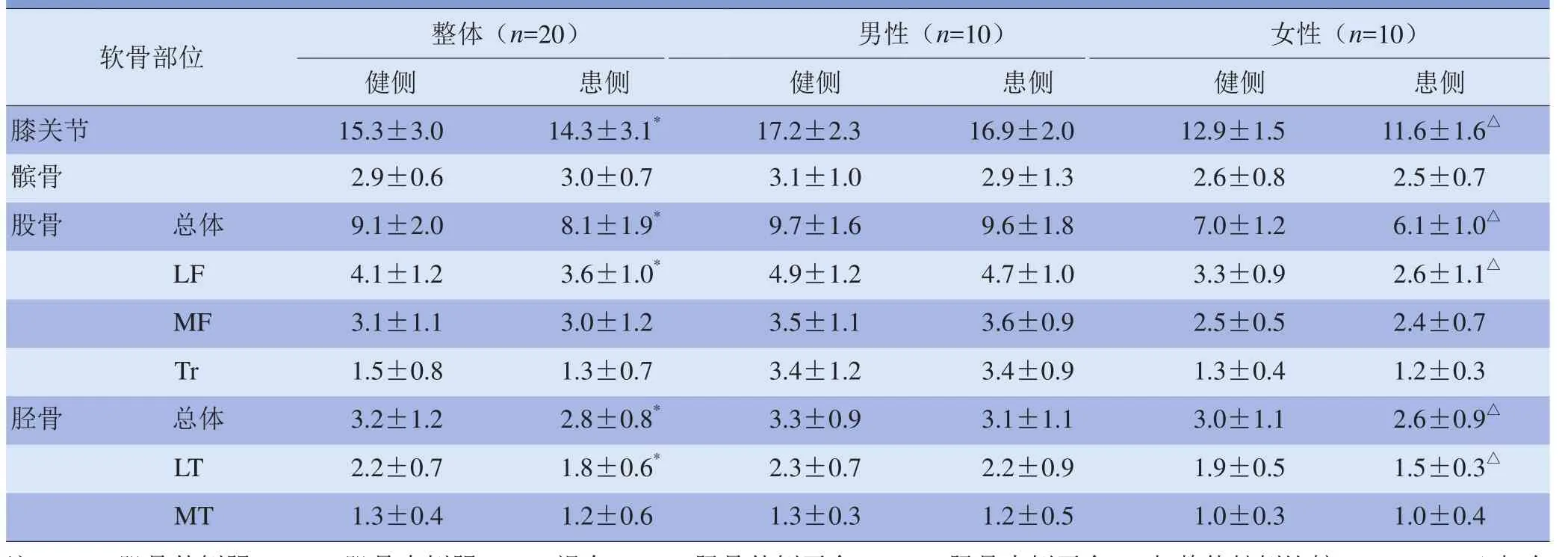
表2 ACL损伤患者健侧与患侧膝关节软骨体积比较(cm3)
3 讨论
本研究利用三维立体软骨模型对股骨、胫骨及髌骨平均软骨体积进行测量和计算,发现女性ACL损伤后部分承重软骨体积发生改变,而男性改变不明显。
膝关节软骨是关节内非常重要的结构,在运动中起到减压和轴承作用,其形态受年龄、性别、体重指数、运动活动水平[7]、骨关节炎、疼痛[5]及ACL损伤等[8,9]多种因素的影响,其中ACL损伤是引起软骨形态改变的急性因素,动物模型证实ACL切除导致软骨细线化改变[10]。利用钆对比剂增强后的MRI来探测软骨成像,Fleming等[11]发现当人体发生ACL损伤后软骨成分发生改变,提示关节软骨发生形态改变,且改变多发生在承重部位软骨,与本研究结果一致。
Frobell等[12]研究发现,膝关节软骨形态学改变发生在ACL损伤后1年内,而且软骨体积减少发生在大多数ACL损伤的软骨中。本研究发现,女性ACL损伤的软骨中平均软骨体积减少,包括LF及LT,可能与ACL损伤造成不稳定的膝关节中发生异常的生物力学运动有关。ACL损伤造成软骨细胞的缺乏是由于改变了接触面软骨区的生物力学方式,使得接触区域变小,从而导致软骨变薄,当受力逐步增大,超过软骨承受范围后,软骨形态渐渐发生改变[13]。本研究基于上述假设来探讨ACL损伤后造成的一系列软骨形态学的改变,而Van De Velde等[2]发现正常膝关节与ACL损伤后的关节软骨厚度并无显著差异。因此,本研究利用MRI三维快速梯度回波水激发序列成像提高软骨成像质量,在此基础上对膝关节软骨进行形态学定量分析,其临床价值明显优于常规序列扫描[14]。
本研究中,女性患侧膝关节软骨改变显著,而男性不显著,可能与人体激素水平差异有关[15]。另外,女性较男性软骨体积小[16,17]、厚度薄,而薄的软骨更易造成损伤,这也是女性较男性更容易发生骨性关节炎的原因之一[18,19]。
本研究的局限性在于:①样本量小,仅有20例患者,需要进一步增加样本量以验证研究结果;②研究对象仅仅是膝关节损伤的一个亚群,并且是针对损伤时间较短(半年内)的患者,因此不能代表所有ACL损伤患者的情况。尽管人体自身左、右膝关节本身存在差异[15],但对于单侧受伤的膝关节患者利用对侧正常膝关节作为对照仍是有效而准确的方法,因此可以认为本研究结果在ACL损伤人群中具有普遍意义。
本研究发现,女性ACL损伤后位于股骨及胫骨外侧承重部位的软骨体积较健侧明显减小,而男性ACL损伤后软骨体积改变不明显。ACL损伤后早期出现的软骨细胞脱失为骨性关节炎最初的发生机制,女性ACL损伤对软骨结构的破坏较男性更为严重,尤以股骨及胫骨的外侧软骨变化显著。总之,本研究利用MRI三维快速梯度回波水激发序列对ACL损伤后膝关节软骨体积进行量化分析,可以为临床探讨早期软骨形态学改变提供更多有价值的信息。
[1] Brophy RH, Zeltser D, Wright RW, et al. Anterior cruciate ligament reconstruction and concomitant articularcartilage injury: incidence and treatment. Arthroscopy, 2010, 26(1): 112-120.
[2] Van De Velde SK, Bingham JT, Hosseini A, et al. Increased tibiofemoral cartilage contact deformation in patients with anterior cruciate ligament deficiency. Arthritis Rheum, 2009, 60(12): 3693-3702.
[3] Cotofana S, Eckstein F, Wirth W, et al. In vivo measures of cartilage deformation: patterns in healthy and osteoarthritic female knees using 3T MR imaging. Eur Radiol, 2011, 21(6): 1127-1135.
[4] Greater rates of cartilage loss in painful knees than in painfree knees after adjustment for radiographic disease stage: data from the osteoarthritis initiative. Arthritis Rheum, 2011, 63(8): 2257-2267.
[5] Farrokhi S, Colletti PM, Powers CM. Differences in patellar cartilage thickness, transverse relaxation time, and deformational behavior: a comparison of young women with and without patellofemoral pain. Am J Sports Med, 2011, 39(2): 384-391.
[6] Maleki-Fischbach M, Jordan JM. New developments in osteoarthritis. Sex differences in magnetic resonance imagingbased biomarkers and in those of joint metabolism. Arthritis Res Ther, 2010, 12(4): 212.
[7] Mosher TJ, Liu Y, Torok CM. Functional cartilage MRI T2 mapping: evaluating the effect of age and training on knee cartilage response to running. Osteoarthritis Cartilage, 2010, 18(3): 358-364.
[8] Frobell RB. Change in cartilage thickness, posttraumatic bone marrow lesions, and joint fuid volumes after acute ACL disruption: a two-year prospective MRI study of sixty-one subjects. J Bone Joint Surg Am, 2011, 93(12): 1096-1103.
[9] Theologis AA, Kuo D, Cheng J, et al. Evaluation of bone bruises and associated cartilage in anterior cruciate ligamentinjured and -reconstructed knees using quantitative t(1ρ) magnetic resonance imaging: 1-year cohort study. Arthroscopy, 2011, 27(1): 65-76.
[10] Sakane M, Mutsuzaki H, Hattori S, et al. Time dependence of changes of two cartilage layers in anterior cruciate ligament insertion after resection on chondrocyte apoptosis and decrease in glycosaminoglycan. Sports Med Arthrosc Rehabil Ther Technol, 2009, 1(1): 27.
[11] Fleming BC, Oksendahl HL, Mehan WA, et al. Delayed gadolinium-enhanced MR imaging of cartilage (dGEMRIC) following ACL injury. Osteoarthritis Cartilage, 2010, 18(5): 662-667.
[12] Frobell RB, Le Graverand MP, Buck R, et al. The acutely ACL injured knee assessed by MRI: changes in joint fluid, bone marrow lesions, and cartilage during the first year. Osteoarthritis Cartilage, 2009, 17(2): 161-167.
[13] 石银龙, 王传兵, 张廉良. MRI水激励序列显示膝关节软骨的临床应用. 江苏医药, 2010, 36(23): 2746-2748.
[14] 乔建兰, 龚建中, 马建忠, 等. 磁共振水激发MEDIC3D序列在膝关节成像中的应用. 实用放射学杂志, 2011, 27(8): 1256-1259, 1286.
[15] Wluka AE, Davis SR, Bailey M, et al. Users of oestrogen replacement therapy have more knee cartilage than non-users. Ann Rheum Dis, 2001, 60(4): 332-336.
[16] Srikanth VK, Fryer JL, Zhai G, et al. A meta-analysis of sex differences prevalence, incidence and severity of osteoarthritis. Osteoarthritis Cartilage, 2005, 13(9): 769-781.
[17] 于小利, 潘兆春, 袁永丰, 等. FS-3D-FISP序列在膝关节检查中的应用. 中国临床医学影像杂志, 2009, 20(11): 877-879.
[18] Eckstein F, Müller S, Faber SC, et al. Side differences of knee joint cartilage volume, thickness, and surface area, and correlation with lower limb dominance--an MRI-based study. Osteoarthritis Cartilage, 2002, 10(12): 914-921.
[19] 姜艳丽, 田金徽, 杨克虎, 等. 磁共振不同成像序列对膝关节软骨损伤诊断价值的Meta分析. 临床放射学杂志, 2012, 31(1): 101-106.
(本文编辑 冯 婕)
Morphological Change of Knee Cartilage After Anterior Cruciate Ligament Injure Using Three-dimensional FFE-WATS
PurposeTo evaluate the morphology changes of knee cartilage after anterior cruciate ligament injury using three-dimensional-TFE-WATS imaging.Materials and MethodsTwenty patients (10 male and 10 female) who had anterior cruciate ligament injury underwent 3D-FFE-WATS scan of both ipsilateral and contralateral knees, the cartilage volume in different parts of the knee joint was measured in sagittal images, and differences between ipsilateral and contralateral knees were compared.ResultsThe volume of knee articular cartilage after ACL injury was lower than that of the normal side, and there was signifcant difference between normal and ACL-injured knees (t=2.0263, P<0.05). In the male group, there was no significant differences between the normal and ACL-injured knee in cartilage volume (P>0.05), while in female group, there was signifcant difference (t=2.6508, P<0.01) in cartilage volume between ACL-injured side and the control side. Compared with the result of male group, cartilage volume change of condylus lateralis femoris and lateral tibial plateau in female group was more obvious (t=2.0795, P<0.05; t=2.5339, P<0.01).Conclusion3D-FFE-WATS imaging can be used to evaluate the change of knee cartilage volume after anterior cruciate ligament injury, the cartilage volume change of women was much obvious than that in males.
Anterior cruciate ligament; Knee cartilage; Cartilage, articular; Magnetic resonance imaging; Male; Female
天津市第五中心医院放射科 天津 300450
于晓坤
Department of Radiology, the Fifth Center Hospital of Tianjin, Tianjin 300450, China
Address Correspondence to: YU Xiaokun
E-mail: kitty678711@sina.com
R686;R445.2
2014-02-24
修回日期:2014-07-16
中国医学影像学杂志
2014年 第22卷 第8期:620-623
Chinese Journal of Medical Imaging
2014 Volume 22 (8): 620-623
10.3969/j.issn.1005-5185.2014.08.018

