动物体内甲硝唑药动学特征及残留检测研究进展
韩 飞 张 曼 张 周 王晶钰
(1.杨凌职业技术学院,陕西杨凌 712100;2.西北农林科技大学动物医学院,陕西杨凌 712100)
甲硝唑(Metronidazole MTZ)又称为甲硝咪唑或灭滴灵,化学名称为1-(β-羟乙基)-2-甲基-5-硝基咪唑,其化学结构式如图1。甲硝唑是畜牧生产中最常用的一种硝基咪唑类药物,具有抗厌氧菌和抗原虫作用[1]。

图1 甲硝唑的化学结构式
1 药理作用
甲硝哇是不带电荷的小分子化合物,可通过扩散进入微生物体内。甲硝唑的硝基在无氧环境中还原成氨基,生成有生物活性的高细胞毒的中间体。该中间体与细菌的DNA反应,阻断其转录和复制而显示抗厌氧菌的作用,但对需氧菌或兼性厌氧菌无效[2]。甲硝唑还广泛应用于生殖道滴虫病,家禽的组织滴虫病,犬、猫、马的贾地鞭毛虫病。
甲硝唑对抗厌氧菌活性比较实验(表1)证明,甲硝唑对专性厌氧菌有明显的抗菌作用,如拟杆菌属(包括脆弱拟杆菌)、梭形杆菌属、梭状芽抱杆菌属(包括破伤风杆菌)、部分真杆菌、消化球菌和消化链球菌[3]。
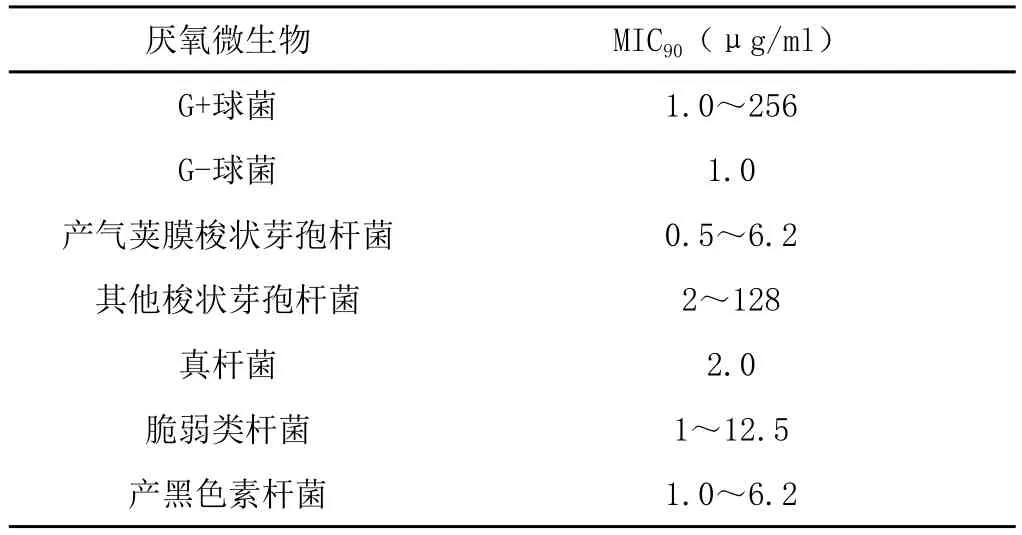
表1 甲硝唑对厌氧微生物的MIC90(μg/ml)比较
2 药动学特征
甲硝唑口服吸收较好,生物利用度较高。口服1 h后,吸收达80%以上,空胃与进食后服用,未发现其生物利用度有明显差异。甲硝唑可以通过血脑屏障,在胆汁、羊水、胎盘、唾液、尿液、脓液、精液和脑脊液中均可出现有效浓度。甲硝唑主要在肝脏中代谢,通过母体化合中的代谢产物与葡萄糖醛酸结合,氧化成为酸性物质并进一步降解为小分子化合物[4]。甲硝唑代谢产物和原形药主要经肾脏随尿液排到体外,少数(6%~15%)经粪便排出。总体排出量占给药量的60%~80%,其中原形药不足10%[5]。
丁祖锐[6]等采用紫外分光光度法测定家兔体内甲硝唑血药浓度,结果表明,口服与静注给药均符合二室模型。口服甲硝唑片后1.381 h出现血药峰浓度,消除半衰期为4.903 h;静脉注射甲硝唑葡萄糖液后,其消除半衰期为4.680 h,二者的生物利用度均为0.66。高苏莉[7]等经小鼠尾静脉给药后,得到甲硝唑的主要动力学参数:消除半衰期为1.26 h、中央室分布容积为0.76 L/kg、表观分布容积为32.32(mg/L)·h以及体清除率为0.62 L/(kg·h)。任国莲[8]等将甲硝唑片剂口服饲喂健康犬,采用反相高效液相色谱法(RP-HPLC)测定犬血浆中甲硝唑的浓度,结果表明,药峰时间为(1.4±0.5)h,峰浓度为(15.0±1.8)μg/ml,半衰期为(3.8±0.7)h。
3 残留检测
甲硝唑为兽医临床和畜牧养殖业做出了重要贡献,但由此产生的动物体内药物残留,不仅给动物的生存与福利带来危害,而且间接地威胁着人类的健康与生活质量。近年来,我国水产品、畜产品和农产品等在食品出口时因药物残留检测技术壁垒屡屡遭遇打击,造成了不可估量的经济损失。因此,分析动物食品中药物残留超标的原因,阐明药物残留的危害性,并建立合适的药物残留检测方法是十分必要的。
3.1 残留超标原因
第1,在动物饲养过程中,饲养员由于缺乏相关的甲硝唑用量及用法知识,没有严格遵守甲硝唑的使用对象、使用剂量以及使用期限等规定。第2,甲硝唑的休药期与其在动物体内的残留量和消除率密切相关,而且与给药途径、给药剂量和动物种类有关,而大多数养殖户几乎不按照规定执行休药期。第3,动物发病时,养殖户急于治疗,以减少经济损失,误以为用药量越大,疾病恢复得越快。
3.2 毒副作用
甲硝唑的副作用最常见的是消化道反应,如恶心、厌食、呕吐、腹泻、腹痛等,疗程较长时,消化道反应会明显增多[9]。服用甲硝唑后,动物尿液常呈现红棕色,剂量过大时,还会出现白细胞数量减少甚至神经症状,但通常可以耐过[10]。甲硝唑可引起皮肤过敏反应,如皮肤红斑、潮红、瘙痒、水泡浮肿等,停药后消失。甲硝唑易穿透血脑屏障,使神经系统中毒,并能透过乳腺屏障和胎盘屏障,因此妊娠早期和哺乳期的动物不宜使用。Elizondo[11]等报道了长期大剂量饲喂家兔、大鼠、小鼠甲硝唑时,三者均发生致癌作用。
3.3 残留检测方法
为了控制兽药在动物食品中的残留量,保障食品卫生安全,农业部于1999年发布17号文《动物性食品中兽药最高残留限量》规定:洛硝哒唑、二甲硝咪唑、甲硝唑在所有食品动物可食用组织中的最高残留量为零,即不允许甲硝唑在动物食品中有残留。目前,甲硝唑在动物体内残留检测的方法主要有高效液相色谱法(HPLC)、质谱联用法和免疫分析技术等。
3.3.1 高效液相色谱法
甲硝唑是硝基咪唑类抗生素,含有硝基咪唑共轭结构,在紫外条件下具有强烈的吸收功能。因此,高效液相色谱法检测甲硝唑在动物体内的残留时大多使用紫外检测器。
艾霞[12]等建立了草鱼皮肤、肌肉组织中检测甲硝唑残留的高效液相色谱法,紫外检测波长为325 nm,皮肤、肌肉组织中的最低定量限均为1 μg/kg,结果表明,甲硝唑在0.01~50.00 mg/L浓度范围内线性关系良好,相关系数为0.999 9;皮肤、肌肉组织中的甲硝唑平均回收率分别为75%和69%,日间变异系数均低于15%。刘书庆[13]等建立了猪和鸡肌肉组织中检测甲硝唑残留的高效液相色谱法,紫外检测波长为325 nm,猪和鸡肌肉中甲硝唑的最低检测限为1 μg/kg,结果表明,甲硝唑在0.012 5~5.000 0 μg/ml浓度范围内有良好的线性关系,相关系数为0.9998;二者肌肉中甲硝唑的绝对回收率为74.4%~81.6%,日间变异系数不超过5%。沈建忠[14]等建立了家禽肌肉组织中检测二硝基咪唑、洛硝哒唑、甲硝唑残留的高效液相色谱法,检测波长为320 nm,其中甲硝唑的最低检测限为0.5 ng/g,结果表明,甲硝唑在15.0~750.0 ng/ml范围内线性关系良好,相关系数为0.998;肉鸡肌肉组织中的平均回收率为89.8%,变异系数为2.8%~6.9%。汪纪仓[15]等建立了猪肌肉、肾脏、肝脏和脂肪中检测甲硝唑、地美硝唑和洛硝唑等硝基咪唑类药物残留的高效液相色谱法,检测波长为320 nm,其中甲硝唑在肾脏和肝脏中的最低检测限为1.0 μg/kg,在脂肪和肌肉组织中为0.5 μg/kg,结果表明,甲硝唑在0.005~2.0 μg/ml范围内线性关系良好,相关系数为0.999 8;平均回收率为62.4%~82.7%,变异系数为9.6%~10.3%。
3.3.2 质谱联用法
普通的色谱分析法只能进行色谱峰大小、保留时间的定量分析,不能鉴定残留组分的结构。而质谱可对残留样品进行高效分离和较强的结构鉴定,适用于难挥发、极性强、热不稳定和残留度浓低的药物。
权伍英[16]等建立了鸡蛋中检测甲硝唑残留量的液相色谱-串联质谱法,最低定量限为0.05 μg/kg,检测线性浓度范围为0.05~25 μg/kg,相关系数为0.998 1;3个添加水平的平均回收率为98.1%~107%,相对偏差低于14%。王海[17]等建立了猪组织中检测硝基咪唑类药物残留量的高效液相色谱-质谱法,猪皮下组织、肾脏、肝脏和肌肉中的检测限为0.5~1μg/kg,其中甲硝唑检测线性浓度范围为0.5~250 μg/L,相关系数为0.9999;在3个添加水平下测得回收率:皮下组织为63.59%~79.54%,肾脏为65.21%~72.52%,肝脏为64.99%~78.62%,肌肉为63.34%~83.73%,相对偏差为4.30%~8.91%。
3.3.3 免疫分析技术
免疫分析技术是一种以抗原、抗体的可逆性、特异性结合反应为基础的分析技术,可将药物分子以半抗原的形式与蛋白载体共价偶联制成人工抗原,引发动物免疫应答,产生活性物质识别并结合药物分子。通过标记抗体或半抗原,利用标记物的化学、物理、生物放大作用,定性、定量检测样品中药物的残留物。该技术具有特异性强、灵敏度高、分析成本低、分析容量大、方法快捷等优点。
何万洋[18]等通过筛选硝基咪唑类药物的单克隆抗体,采用ELISA检测方法研制出了检测鸡肉中硝基咪唑类药物残留的试剂盒。该试剂盒的最低检测限为0.04μg/kg,其中甲硝唑在2个添加水平的平均回收率为82.7%~96.7%,批内变异系数为7.8%~13.4%,批间变异系数分别为13.5%和12.4%。
4 小结
甲硝唑在体内吸收迅速而完全,蛋白结合率低于5%,在体液和组织中分布广泛。药动学特征表明甲硝唑半衰期较长,能在体内保持有效浓度。甲硝唑主要经尿液排出体外,因此,养殖场内的动物服用甲硝唑后,尿液应进行有效处理,减少周围的微生物对甲硝唑的耐药性,从而降低微生物耐药性对人体健康带来的潜在威胁。甲硝唑的不良反应也是非常明显,尤其是在食品动物中的残留,不仅危害动物健康,也会对人们的生活产生潜在的不良影响。分析甲硝唑残留原因,减少残留来源的同时,应加强动物组织中药物的残留检测。由于甲硝唑的硝基咪唑共轭结构具有强烈的紫外吸收,紫外液相色谱仪测定甲硝唑残留较为常见,国内外也有很多文献进行报道,但其检测限较高;而气相色谱-质谱联用法的衍生化过程繁琐复杂,液相色谱-质谱联用法虽可进行多组定量分析和高效分离,但操作繁琐且费用较高,推广难度较大;免疫分析技术操作简单、灵敏度高、费用较低,但此技术尚不成熟,国内外的相关报道也较少。因此,甲硝唑的残留检测方法应根据实际情况需要进行适当的分析、优化。
[1]Baggot JD,Wilson WD,Hietala S.Clinical pharmacolinetics of metronidazole in horses [J ]. J Vet Pharmacol Therap,1988,(11):417-420.
[2]温玉麟,张瑞文.新的一类抗厌氧微生物药物一硝基咪哇类化合物[J].医药工业,1985,(7):36-41.
[3]熊德鑫,祝小枫,盛志勇.替硝哇对厌氧菌体外抗菌活性的研究[J].中国抗生素杂志,1997,22:472-476.
[4]Adams H.R. Pharmacology and Therapeutics(8thedition)[M].USA:lowa State University Press,2001:993-994.
[5]Boggot J D,Wilson W D,Hietala S. Clinical pharmacolinetics of metronidazole in horses. J. Vet. Pharmacol. Therap,1988,(11):417-420.
[6]丁祖锐,秦玉华,方凤琴.甲硝唑药物动力学研究[J].中国药学杂志,1991,26(2):88-90.
[7]高苏莉,顾宜,黄宝文.替硝唑与甲硝唑对厌氧菌的作用及其药动学比较[J].第四军医大学报,2004,25(10):901-903.
[8]任国莲,白克华,吴婧,等.反相高效液相色谱法测定犬血浆中甲硝唑浓度[J].山西医科大学学报,2008,39(12):1109-1111.
[9]吴志全,夏高辉,王浩,等.甲硝唑毒副作用49例报告[J].实用外科杂志,1989,9:275.
[10]陈杖榴.主编.兽医药理学(第三版)[M].北京:中国农业出版社,2009,348-349.
[11]Elizondo G,Gonsebatt M E,Salazar A M. Genotoxic ects of metronidazole. Mutation Research,1996,370:75-80.
[12]艾霞,王大菊,张丛兰,等.高效液相色谱法检测草鱼可食用组织中甲硝唑的残留[J].天津农学院学报,2005,12(2):10-14.
[13]刘书庆,王大菊,秦大伟.HPLC法测定甲硝唑在鸡和猪肌肉组织中的残留[J].山东轻工业学院学报,2005,19(3):5-8.
[14]沈建忠,项新华,张跃,等.家禽肌肉组织中硝基咪唑类药物残留高效液相色谱检测研究[J].中国农业科学,2003,36(6):700-703.
[15]汪纪仓,王大菊,高小龙,等.高效液相色谱法检测猪组织中硝基咪唑类药物残留[J].中国农业科学,2008,41(10):3318-3325.
[16]权伍英,栾燕,谷晶,等.鸡蛋中甲硝唑残留的液相色谱-串联质谱检测方法研究[J].中国卫生检验杂志,2007,17(2):231-233.
[17]王海,刘素英,单吉浩,等.高效液相色谱-质谱法测定猪组织中硝基咪唑类药物残留量[J].中国兽医杂志,2005,39(12):8-11.
[18]何万洋,万宇平,祝旋,等.鸡肉中硝基咪唑类药物残留ELISA检测试剂盒的研制[J].中国家禽,2011,33(7):31-34.

