高效液相色谱法测定美托拉宗片在人体内的血药浓度
孙卉玲
高效液相色谱法测定美托拉宗片在人体内的血药浓度
孙卉玲
使用反相LichroCART Purospher C18色谱柱,流动相为乙腈和0.5%三乙醇胺(35:65)洗脱15min。应用带有光电二极管阵列检测器的高效液相色谱仪检测美托拉宗。检测限和最低定量限分别为1ng/ml和2.5ng/ml。该方法成功用于美托拉宗在人血浆中的药代动力学研究,灵敏性、重现性好。
美托拉宗;生物利用度;药代动力学
美托拉宗是喹唑啉类药物,化学名是7-氯-1,2,3,4-四氢-2-甲基-3-(2-甲基苯基)-4-氧代-6-喹唑磺酰胺,美托拉宗是喹唑啉类利尿剂,与通常的噻嗪类利尿剂功效相当。美托拉宗的作用机制是干扰肾小管对电解质的重吸收。美托拉宗主要在皮质稀释部位抑制钠的重吸收,对近曲小管作用弱。钠和氯离子被排出的总量大致相等。肾小管远端钠子交换量的增加导致钾离子排泄的增加。美托拉宗不抑制碳酸酐酶。美托拉宗对人类的药理作用与其他动物相似,表现为增加磷酸盐和镁离子的排泄,显著增加肾小球滤过率功能严重受损的患者的钠离子的排泄。这个作用机制已经在动物体内通过微刺控研究被证明。
美托拉宗的抗高血压机制尚不明了,可能与其利尿、促排尿作用相关。美托拉宗的药代学的分析方法仅有少数报道,包括HPLC法和LC-MS法。我们的目的是寻找一个新的灵敏的美托拉宗药代学的分析方法。
1 试剂与材料
1.1 药品 美托拉宗标准品含量为99.86%,厂家是江苏倍达医药科技有限公司。塞来昔布标准品含量为99.38%,厂家是南京中标晨曦化学技术有限公司,乙腈(色谱级)、磷酸二氢钾、磷酸、甲醇、三氯乙酸(均为分析纯)均采购自美国天地公司。整个实验过程中均使用超纯水设备制备的水。在这个实验中使用的新鲜冷冻血浆来自山东省血液中心,并且使用前一直贮存在(-70±2)℃的温度条件下。
1.2 使用仪器 高效液相系统由以下仪器组成:10AT-VP高效液相色谱仪(Shimadzu Ltd.,Japan);带100μl定量环手动进样器和紫外分光检测器(Shimadzu Ltd.,Japan),检测波长为225nm,检测器输出量化使用CLASS VP(6.01版)色谱分析软件。分离是使用的LichroCART Purospher○RC18色谱柱(250mm×4.6mm,5μm),使用0.5%三乙胺混合液(PH3.5)和乙腈(65∶35,v/v)作为流动相,流速为1ml/min,总分析时间为15min,所有分析均在室温下进行。
1.3 标准液的制备和质量控制标准 美托拉宗和塞来昔布(I.S) (1mg/ml)置于乙腈水溶液(1∶1v/v),进一步稀释得到一系列标准液。通过在空白血浆里加入适当数量的美托拉宗制成美托拉宗标准液(2.5,5.0,10.0,25.0,50.0,75.0,100.0,250.0 and 500.0ng/ml)。低、中、高质控标准液的浓度分别为:6.0、50.0、500.0ng/ml,在使用前这些标准液均贮存于(-20±2)℃温度下。
1.4 用SPE制备样品 向0.5ml含有美托拉宗(标准品)血浆样品中加入0.5ml内标物(1.0μg/ml),混合离心。使用菲罗门公司的Strata C18-E色谱柱,顺序应用乙腈和水润湿活化小柱。活化好的小柱加入1ml样品,用水冲洗,使用1ml流动相洗脱药品和内标物,在保留时间内血浆样品内的药物没有受到内源物的干扰(见图1)。我们也通过别的方法比如:蛋白质沉淀法、液-液萃取法等,在这些方法中,还是SPE法结果更精确(98.28%重现率)。

图1 空白样品色谱图
2 结果
2.1 选择性/敏感性 方法的选择性考察是通过筛选6批不同的空白人血浆样品完成的。在这个条件下,美托拉宗和内标物的保留时间分别为7.97min和10.36min。其它杂峰来源于血浆内其它成分。美托拉宗和内标物在上述色谱条件下溶解度很好,在保留时间内没有受到其他内源物的干扰(见图2)。

图2 样品色谱图
2.2 精确度与精密度 本方法的精确度平均百分比为98.37%,在保留时间内,分别在6.0,50.0和500.0ng/ml的条件下,日内精密度分别为(5.82±0.43)ng/ml,(49.85±1.48)ng/ml,(491.35±13.16)ng/ml(见表1)。
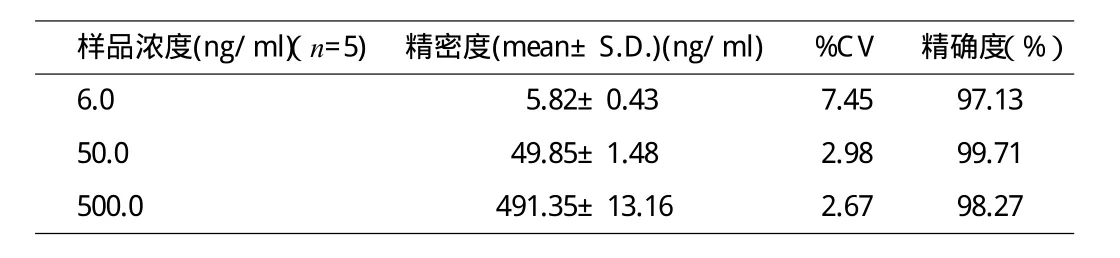
表1 美托拉宗的精确度与精密度
2.3 线性 线性关系研究使用7个浓度的美托拉宗样品(2.5、5.0、10.0、25.0、50.0、75.0、100.0、250.0、500ng/ml)。在浓度范围内峰面积符合线性关系。在所有浓度点每个试验都要在3个不同的日期重复3次获得数据。相关系数‘r2’为0.9978(见表 2、图 3 和图 4)。
2.4 回收率 美托拉宗在6.0,50.0and 500.0ng/ml浓度下,回收率分别为98.87%,99.03%和99.94%。
2.5 稳定性研究 原液贮存在4℃条件下,进行短期和长期稳定性研究,所得数据均无明显偏离。美托拉宗在血浆中的稳定性研究通过测定随时间推移质控样品中的药物浓度变化来进行。质控样品经过三个冻融循环并与新鲜配制的样品进行比较以确定其稳定性。在这种贮存条件下,质控样品中美托拉宗的平均浓度没有发生变化。根据长效稳定性试验推断,在人血浆中的美托拉宗在(-20±2)℃条件下至少可以稳定的贮存30d(见表3)。

表2 美托拉宗矫正曲线

图3 美托拉宗矫正曲线

表3 美托拉宗稳定性试验研究报告
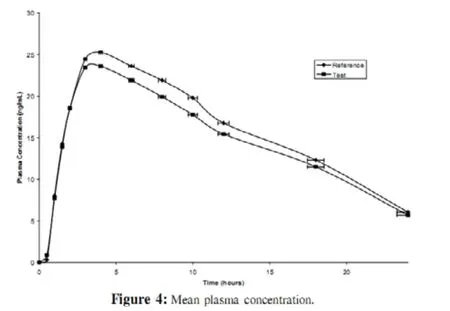
图4 平均血药浓度
2.6 药代动力学研究 对Cmax,Tmax,半衰期,消除速率常数K,AUC0-t,AUC0-∞这些药代动力学参数进行了计算。参比制剂和受试制剂相比较(见表4)。

表4 美托拉宗药代动力学参数对照
3 结论
固相萃取人血浆中的美托拉宗比其他萃取法更精确。这个方法具有很高的精确度、精密度、重吸收度而且分析时间较短。必将成为美托拉宗在人体内药代动力学研究的有用的工具。
[1] Brodie RR,Chasseaud LF,Walmsley LM.Determination of the di-uretic agent metolazone in plasma by high-performance liquid chromatography[J].J Chromatogr B,1981,226:526-532.
[2] Farthing D,Fakhry I,Gehr TW,Sica DA.Quantitation of metolazone in urine by high-performance liquid chromatography with fluorescence detection[J].J Chromatogr B,1990,534:228-232.
[3] Farthing D,Sica DA,Fakhry I,Gehr TW.Novel high-performance liquid chromatographic method using solid-phase on-line elution for determination of metolazone in plasma and whole blood[J].J Chromatogr B,1994,653:171-176.
[4] Guidance for Industry Bioanalytical Method Validation. U.S. De-partment of Health and Human Services[J].Food and Drug Administration,Center for Drug Evaluation and Research,CDER,Rockville,MD,USA,2001.
[5] Guidance for Industry,Statistical Approaches in Establishing Bioequivalence.U.S.Department of Health and Human Services[J].Food and Drug Administration,Center for Drug Evaluation and Research,CDER,Rockville,MD,USA.2001.
[6] Jadhav V,Mande P,Kadam V.Validation Of Reverse Phase High Performance Liquid Chromatography Method Of Metolazone And Its De-termination In Bulk Drug And Pharmaceutical Dosage[J].J Pharm Res,2009,2:961-963.
[7] Wei G,Xiao S,Liu C.Determination of metolazone in human blood by liquid chromatography with electrospray ionization tandem mass spectrometry[J].J Chromatogr B,2007,845:169-173.
10.3969/j.issn.1009-4393.2014.3.105
山东 250100 山东省济南市历下区第三人民医院药剂科(孙卉玲)

