基于高光谱成像技术和因子判别分析的玉米黄曲霉毒素检测研究
袁 莹 王 伟 褚 璇 P.Feldner G.Heitschmidt
(中国农业大学工学院1,北京 100083)
(Quality&Safety Assessment Research Unit,USDA-ARS2,Athens 30605)
黄曲霉毒素是黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)的代谢产物[1],具有极强的毒性,1993年被世界卫生组织癌症研究机构划定为Ⅰ类致癌物[2],它主要有 B1、B2、G1、G2、M1和 M2等类型,其中以B1毒性最大。黄曲霉毒素主要污染粮油食品、动植物食品等,如花生、玉米、大米、小麦、豆类、坚果类、肉类等,其中以玉米和花生污染最为严重。玉米作为我国主要的经济型粮食作物,但因霉变造成的产后损失巨大,不仅如此,食用了感染黄曲霉毒素的玉米,将会直接危及人、畜生命和健康,因此对黄曲霉毒素的及时检出就显得尤为重要。
目前,黄曲霉毒素的检测方法主要包括薄层层析法(TLC)、高效液相色谱法(HPLC)、免疫分析法(ELISA)等[3-6],然而这些检测方法普遍存在检测时间长、检测结果慢、不适于在线应用、经济性差等缺点[7]。高光谱成像技术是融合图像技术和光谱技术而成的一门新技术[8]。所谓高光谱成像技术,即在紫外到近红外(200~2 500 nm)的光谱范围内,利用成像光谱仪,在光谱覆盖范围内的几十到数百个光谱波段对目标物体连续成像,在获得物体空间特征成像的同时,也获得被测物体的光谱信息,在可见光到近红外波段,其光谱分辨率可达纳米级[9]。高光谱成像技术结合光谱与计算机图像技术两者的优点,可获得大量可包含连续波长光谱信息的图像块,图像信息可用于检测表面,而光谱信息可用于检测内部成分、品质。与传统的近红外光谱分析技术和可见光图像技术相比,分别具有像素级检测能力,可同时获取样品物理和内部化学成分信息等优点[10]。因而高光谱成像技术在果蔬表面品质[11]、内部品质[12]、禽类肉质品质[13]以及对水果糖度等指标的定量分析[14-16]均得到了广泛应用。本试验采用高光谱成像技术对玉米籽粒表面的黄曲霉毒素B1进行检测。
1 材料与方法
1.1 试验材料
本试验采用的样品为先锋玉米籽粒,选取了150粒尺寸和外观大致相同的于2010年夏季收获的同种玉米籽粒。样品由美国农业部农业研究署真菌毒素研究所提供。
1.2 样品准备
为了排除玉米样品中天然自带的霉菌对光谱数据的干扰,先将试验用的玉米籽粒放入盛有20%甲醇溶液的烧杯中浸泡,然后放置在滤纸上进行干燥,以杀死残余的霉菌孢子。将500μg/L的黄曲霉毒素原液用甲醇稀释,配制成4种不同质量浓度的黄曲霉毒素溶液,浓度依次为10、20、100、500μg/L。
将150个样品平均分为5组,保证每粒玉米样品的胚芽朝上,方向一致放置在聚四氟乙烯板上对应的凹槽处,每块聚四氟乙烯板的表面被设计成分布30个浅椭圆形的小坑,用以摆放30个玉米样品。预留一组30粒玉米作为对照样品组,不再进行任何处理;然后分别用移液管在其余4组每组30粒玉米颗粒表面中心位置处滴上之前所配制的4种不同浓度的黄曲霉毒素溶液。
1.3 高光谱成像系统
利用搭建在美国农业部农业研究所的可见/近红外高光谱成像系统进行光谱采集。该高光谱成像系统是由4.5mmPCO.EDGE高灵敏度相机(Romulus,MI,U.S.A.),光谱仪(Specim V10M spectrograph Oulu,Finland),蔡司 Distagon T 25 mm f/2.8镜头(Oberkochen,Germany)和2个500W的卤钨灯(Watsonville,CA,U.S.A.)组成。该高光谱系统可以采集400~1 000 nm范围的反射光谱,采集光谱的数据点为835个。
1.4 光谱信息的提取
对于每张图像,都是将玉米籽粒上感染黄曲霉毒素的可见的干燥、白色点作为感兴趣区域(Regions of Interest,ROI’s)。针对每个样品,在集中分布黄曲霉毒素的地方取最小50个像素为ROI’s,这50个像素应选择在被污染点的中心,大小应小于被污染面积,避免包含边缘部分,以防止光谱采集时采集到污染物以外信息的光谱数据。每个ROI的平均反射率被计算并转化为log(1/反射率)以表示吸收率。图1为转换后的每组30粒玉米颗粒的平均近红外吸收光谱。

图1 样品的平均吸收光谱
1.5 光谱数据的预处理
为了消除由于样品形状不同及表面凹凸不平产生的散射对光谱的影响[17],需要用适当的光谱预处理方法来消除背景噪声及特定的物理因素的干扰,提高谱图与化学成分之间的相关性。采用标准正态变量校正处理,在Matlab2012a软件中进行预处理。预处理后所得的光谱曲线如图2所示。
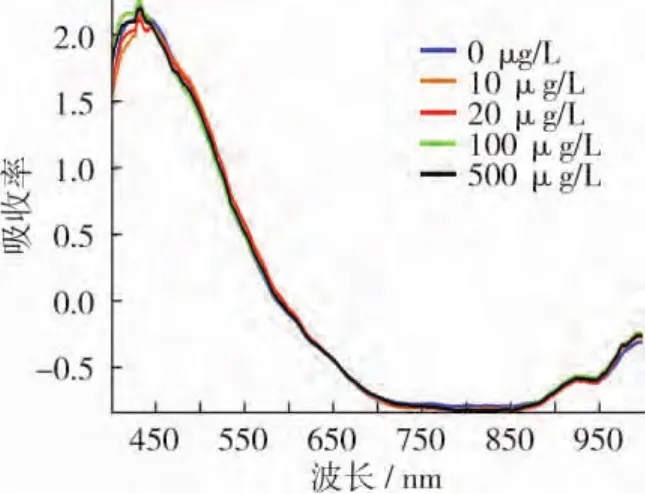
图2 预处理后的样品光谱
2 结果与分析
2.1 主成分分析(Principal Component Analysis,PCA)
由于试验中每个样品有835个原始光谱数据点,各个光谱数据都在不同程度上反映了某些信息,且各个数据之间彼此又有一定的相关性,因而所得的统计数据反映的信息在一定程度上有重叠。在进行数据处理时,数据量太多、数据存在多重共线性会增加计算量和分析问题的复杂性。为了解决这一问题,试验采用PCA进行数据处理。PCA[18-19]是多元统计中的一种方法,利用它可以对样品光谱数据进行降维,并从多重因素中解析出主要影响因素[20]。分析结果如图3所示。
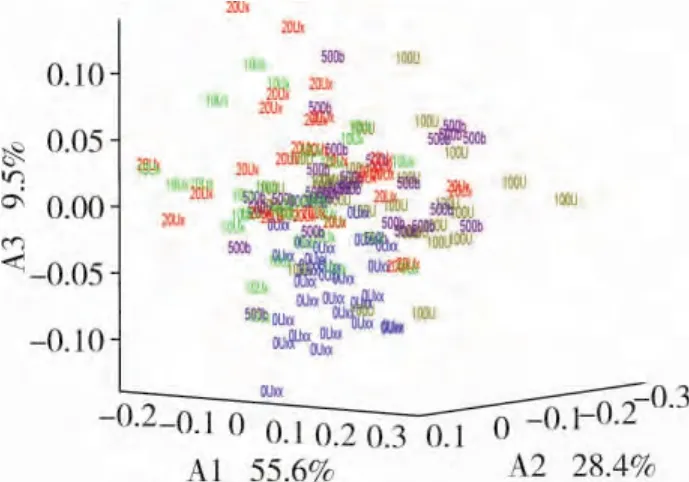
图3 基于PCA的前3个主成分的样本分布
图3中x轴表示样品第一主成分得分(A1),y轴表示样品第二主成分得分(A2),z轴表示样品第三主成分得分(A3),从图3中可看出0μg/L的样品组呈现较为明显的聚类现象,但各组样品无法进行明显的区分。为了进行正确的区分检测,采用因子判别分析(Factorial Discriminant Analysis,FDA)建立试验5组样品的检测分析模型。
经主成分分析光谱数据后得到前14个主成分累计贡献率如表1所示,前14个主成分的累计贡献率已经达到了99.8%,几乎可以表征原始光谱的全部信息。
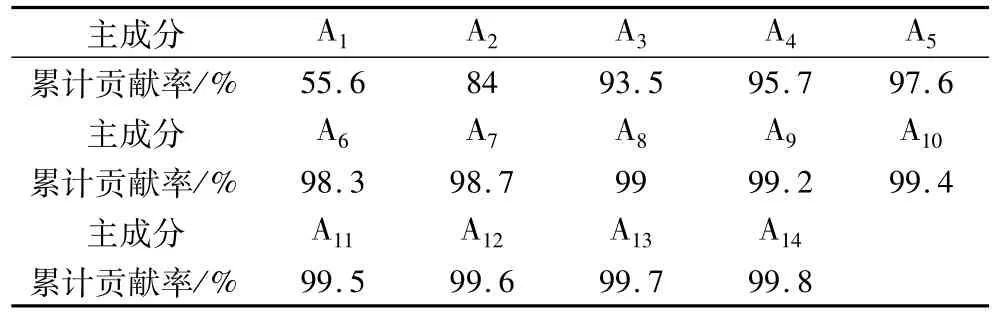
表1 前14个主成分累计贡献率
2.2 因子判别FDA分类分析
因子判别FDA是一种监督辨别分类技术,FDA旨在通过最大化类间方差找到原始变量空间中最好分开各类的子空间,其优点在于是一个可以逐步回归寻找特征变量的简单线性非参数分类器[21]。因此,试验采用FDA对样品数据进行辨别分类。
将150个样品数据,利用Matlab2012a随机选取100个样品作为训练集,其余的50个样品作为验证集,随机选取的结果如表2所示,可见所选取的各类数量大致相同。

表2 样品选取结果
利用FDA函数,将前14个主成分作为输入,所建立FDA判别函数F1、F2、F3和F4分别如公式(1)-(4)所示:


进而将训练集和验证集的前14个主成分数据作为输入分别进行分类结果验证,得到的判别结果混淆矩阵及正确率如表3、表4所示。
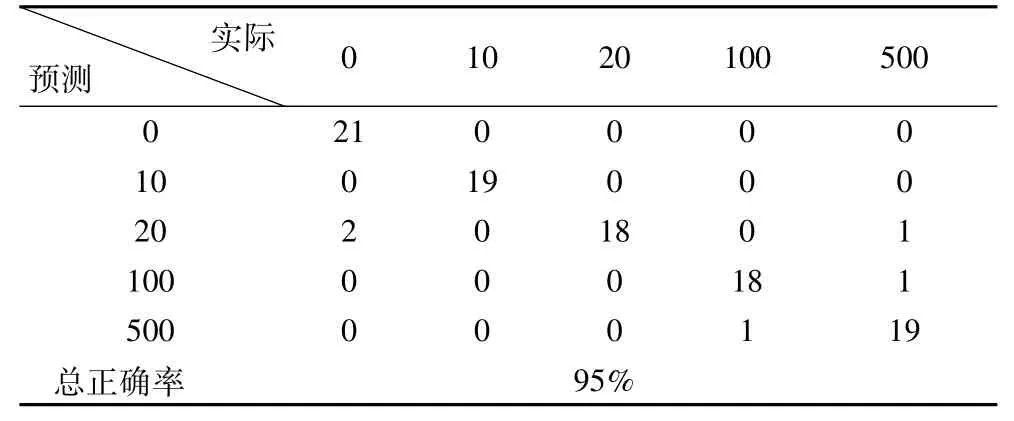
表3 训练集的判别结果及正确率
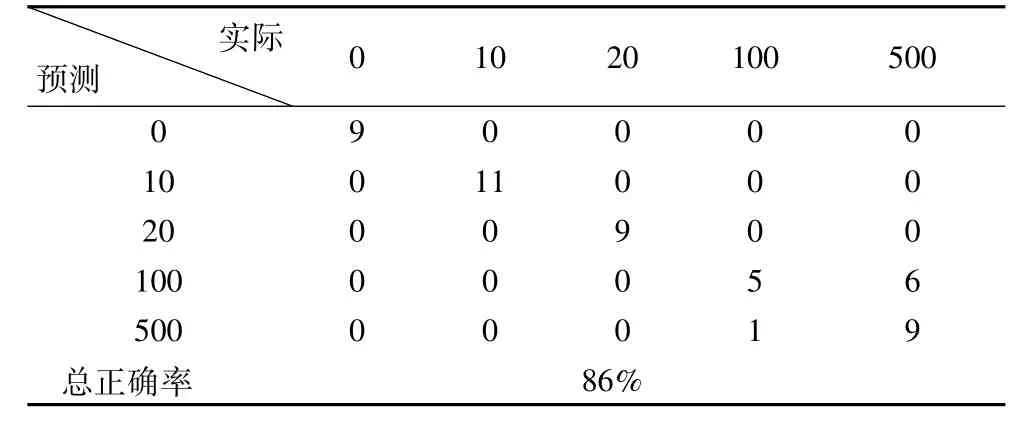
表4 验证集的判别结果及正确率
判别结果显示,训练集的判别正确率达到95%。验证集的50个样品中,除了有1个500μg/L的样品被错判为100μg/L,6个100μg/L的样品被错判为500μg/L外,其余的43个样品均判别正确,正确率达到86%。这是由于100μg/L和500μg/L的黄曲霉毒素都属于高质量浓度,在数据上存在着一定的近似,所以会出现错判。判别结果证实了将样品的前14个主成分作为输入,利用FDA的方法进行玉米表面不同黄曲霉毒素浓度的识别是可行的。
3 结论
对滴有不同浓度黄曲霉毒素的玉米籽粒进行波长范围为400~1 000 nm可见/近红外高光谱数据获取,对光谱数据进行PCA分析实现数据降维后,以所获得的前14个主成分作为输入,利用因子判别分析建立分类判别模型,实现了包含对照样品在内的5类玉米表面含有不同黄曲霉毒素浓度的准确识别,训练集和验证集的识别准确率分别达到了95%和86%。表明利用高光谱成像技术,将主成分分析和因子判别分析相结合,进行玉米表面不同黄曲霉毒素浓度的识别是可行的。
[1]陈宁庆.实用生物毒素学[M].北京:中国科学技术出版社,2001:251-275
[2]张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006:5-7
[3]Khan M R,Alothman Z A,Ghfar A A,Wabaidur SM.A-nalysis of aflatoxins in nonalcoholic beer using liquid-liquid extraction and ultraperformance LC-MS/MS[J].Journal of Separation Science,2013,36(3):572-577
[4]Campone L,Piccinelli A L,Celano R,et al.Application of dispersive liquid-liquidmicroextraction for the determination of aflatoxins B1,B2,G1 and G2 in cereal products[J].Journal of Chromatography A,2011,1218(42):48-54
[5]王晶,王林,黄晓蓉.食品安全快速检测技术[M].北京:化学工业出版社,2002:92-94
[6]Jaimez J.Application of the assay of aflatoxins by liquid chrommatograghy with fluorescence detection in food analysis[J].Journal of Chromatography A,2000(882):1-10
[7]谢刚,王松雪,张艳.超高效液相色谱法快速检测粮食中黄曲霉毒素的含量[J].分析化学,2013,41(2):223-228
[8]马本学,应义斌,饶秀勤.高光谱成像在水果表面缺陷及污染检测中的研究进展[Z].中国农业工程学会2007年学术年会,大庆,2007
[9]马本学,应义斌,饶秀勤,等.高光谱成像在水果内部品质无损检测中的研究进展[J].光谱学与光谱分析,2009,29(6):1611-1615
[10]洪添胜,李震,吴春胤,等.高光谱图像技术在水果品质无损检测中的应用[J].农业工程学报,2007,23(11):280-285
[11]Qin J,Lu R.Detection of pits in tart cherries by hyperspectral transmission imaging[J].Transactions of the American Society of Agricultural Engineers.2005,48(5):1963-1970
[12]洪添胜,乔军,Ning Wang,等.基于高光谱图像技术的雪花梨品质无损检测[J].农业工程学报,2007,23(2):151-155
[13]Qiao J,NgadiM,Wang N.Pork quality andmarbling level assessmentusing a hyperspectral imaging system[J].Journal of Food Engineering,2007,83(1):10-16
[14]Zhao Jiewen,Chen Quansheng,Vittayapadung S,et al.Determination of apple firmness using hyperspectral imaging technique and multivariate calibrations[J].Transactions of the Chinese Society of Agricultural Engineering,2009,25(11):226-231
[15]Rajkumar P,Wang N,Eimasry G,et al.Studies on banana fruit quality and maturity stages using hyperspectral imaging[J].Journalof Food Engineering,2012,108(1):194-200
[16]周竹,李小昱,高海龙,等.马铃薯干物质含量高光谱检测中变量选择方法比较[J].农业机械学报,2012,43(2):128-133,185
[17]褚小立,袁洪福,陆婉珍.近红外分析中光谱预处理及波长选择方法进展与应用[J].化学进展,2004,16(4):528-542
[18]Louis Ferré.Selection of components in principal component analysis:a comparison ofmethods[J].Computational Statistics&Data Analysis,1995,19(6):669-682
[19]Januj Juneja.Common factors,principal components analysis,and the term structure of interest rates[J].International Review of Financial Analysis,2012,24:48-56
[20]何勇,李晓丽,邵咏妮.基于主成分分析和神经网络的近红外光谱苹果品种鉴别方法研究[J].光谱学与光谱分析,2006,26(5):850
[21]Taylor JA,Coulouma G,Lagacherie P,etal.Mapping soil unitswithin a vineyard using statistics associated with high-resolution apparent soil electrical conductivity data and factorial discriminant analysis[J].Geoderma,2009,153:278-284.

