Eag1 钾离子通道、HIF-1α 以及VEGF 在子宫颈癌中的表达及其临床意义
刘 邦,刘 钧,蹇顺海,黄一凡,韩颖苹,付秋娟,聂 佳
(1.仪陇县人民医院肿瘤科,四川 仪陇 637641;2.川北医学院附属医院病理科,四川 南充 637000)
本刊网址:http://www.nsmc.edu.cn 作者投稿系统:http://noth.cbpt.cnki.net 邮箱:xuebao@nsmc.edu.cn
近年来研究表明,钾离子通道是细胞膜上重要的离子通道,并参与肿瘤细胞的增殖、分化和凋亡,可以为肿瘤治疗提供新的靶点[1]。其中Eag1(ether à go-go,Eag1)钾离子通道是研究相对较多的一种,Eag1 通道在其细胞内部分存在一个氧感受器(PAS)区,肿瘤细胞在生长过程中发生缺氧时,Eag1通道表达增高,并且在低氧环境下诱导低氧诱导因子(hypoxia inducible factor-1α,HIF-1α)的大量转录,产生糖酵解增加及血管生成增多等一系列低氧适应反应,从而使肿瘤细胞在缺氧环境中继续生长发展[2]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是最关键的血管生成调节因子,可以增加血管通透性,抑制血管内皮细胞凋亡并刺激其增殖,从而促使血管生成,促进肿瘤生长。Eag1、HIF-1α、VEGF 均与肿瘤发生发展密切相关,但三者联合检查尚未见报道。本文采用免疫组化方法检测慢性宫颈炎、宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)及宫颈鳞癌组织中Eag1、HIF-1α 及VEGF 的表达情况,分析三者与宫颈鳞癌临床病理特征的关系,并分析Eag1、HIF-1α 及VEGF 的相关性。
1 材料与方法
1.1 临床资料
收集川北医学院附属医院病理科2006 年6 月至2012 年6 月经病理确诊病例的石蜡蜡块,其中慢性炎症宫颈组织40 例,CIN 40 例(其中CINⅠ~Ⅱ20 例,CINⅢ20 例),宫颈鳞癌100 例。100 例宫颈鳞癌均为手术切除标本,均有完整临床病理资料,其中50 例术前先接受放射治疗,年龄33 ~65 岁,平均年龄49 岁。按照世界卫生组织(WHO,2003)子宫颈癌组织学分类标准,角化型47 例,非角化型45例,其他类型宫颈鳞癌8 例;伴有淋巴结转移34 例,无淋巴结转移66 例。临床分期根据国际妇产科联盟(FIGO,2009)宫颈癌分期标准,由妇科医生根据临床检查确定临床分期,早期宫颈癌即Ⅰ~Ⅱa 期63 例;中晚期宫颈癌Ⅱb 及Ⅱb 期以上37 例。
1.2 实验方法及试剂
Eag1 兔抗人多克隆抗体和HIF-1α 兔抗人多克隆抗体均购自北京雷根生物技术有限公司(中国),VEGF 兔抗人单克隆抗体购自北京中杉金桥生物技术有限公司(中国)。将原病例常规石蜡包埋的蜡块,作4 μm 连续切片4 张,分别作HE 染色,Eag1、HIF-1α 和VEGF 免疫组化染色(SP 法)。免疫组化染色各步骤均按试剂盒说明书严格操作。已知阳性切片为阳性对照,以PBS 代替一抗为阴性对照。
1.3 判断标准
Eag1 为光镜下细胞质或细胞膜内染成棕黄色者为阳性表达(图1);HIF-1α 为光镜下以肿瘤细胞核内或胞质有棕黄色细颗粒者为阳性表达(图2);VEGF 为光镜下以肿瘤细胞胞质内有棕黄色细颗粒者为阳性表达(图3)。双盲法观察切片,采用半定量积分法进行分级[3],每张切片随机选择具有代表性的10 个高倍镜视野(×400)进行计数,每个视野计数100 个细胞,共计1 000 个细胞,计算阳性细胞数与细胞总数的百分率,分级如下:不论其染色强弱如何,阳性细胞少于或等于10%计为0 分;阳性细胞为11% ~30%,计为1 分;阳性细胞为31% ~75%,计为3 分,>75%为3 分;根据细胞染色强度分级如下:无色为0 分,浅黄色为1 分,黄色为2 分,棕黄色为3 分。染色强度与阳性细胞百分比的乘积≤1 分为阴性,1 ~2 分为弱阳(+),2 ~4 分为阳性(+ +),>4 分为强阳(+ + +)。若两人判断结果相差2 分则重新判定。
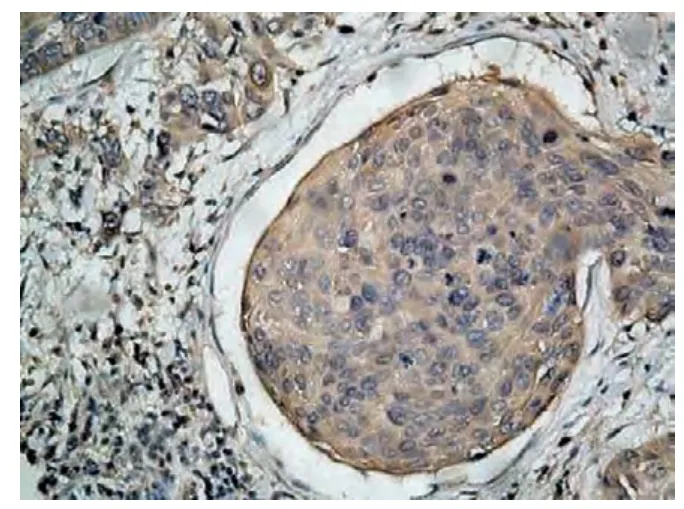
图1 Eag1 在宫颈癌中的表达(SP×200)
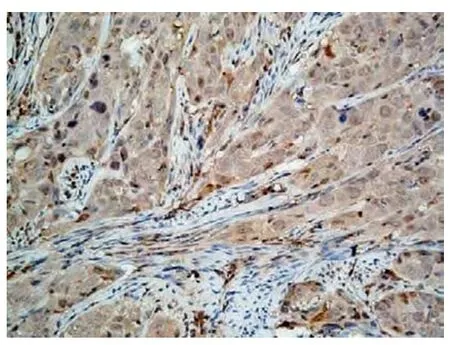
图2 HIF-1α 在宫颈癌中的表达(SP×200)
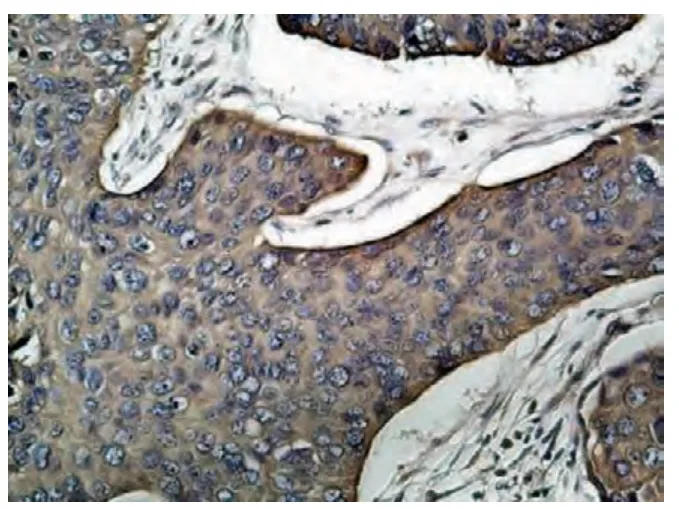
图3 VEGF 在宫颈癌中的表达(SP×200)
1.4 统计学分析
应用SPSS19.0 软件,采用χ2检验,方差分析及Spearman 等级相关分析方法进行统计分析,以P <0.05 表示结果具有统计学意义,P <0.01 表示结果具有显著统计学意义。
2 结果
2.1 Eag1、HIF-1α 和VEGT 在不同病变宫颈组织中的表达
从表1 可知,Eag1、HIF-1α 和VEGT 的表达在CIN、宫颈鳞癌均显著增加,均具有统计学意义(P <0.01)。
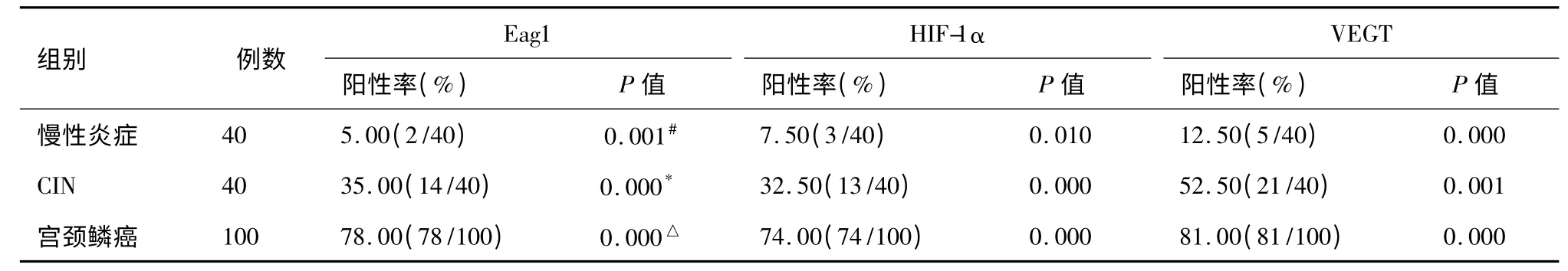
表1 Eag1、HIF-1α 和VEGT 在不同病变宫颈组织中的表达
2.2 Eag1、HIF-1α 和VEGT 的表达与宫颈癌临床病理特点
从表2 可知,Eag1、HIF-1α 及VEGF 阳性表达率在非角化型鳞癌中高于角化型、Ⅱb 及以上期高于Ⅰ~Ⅱa 期、伴有淋巴结转移者明显升高,均具有统计学意义(P <0.05)。
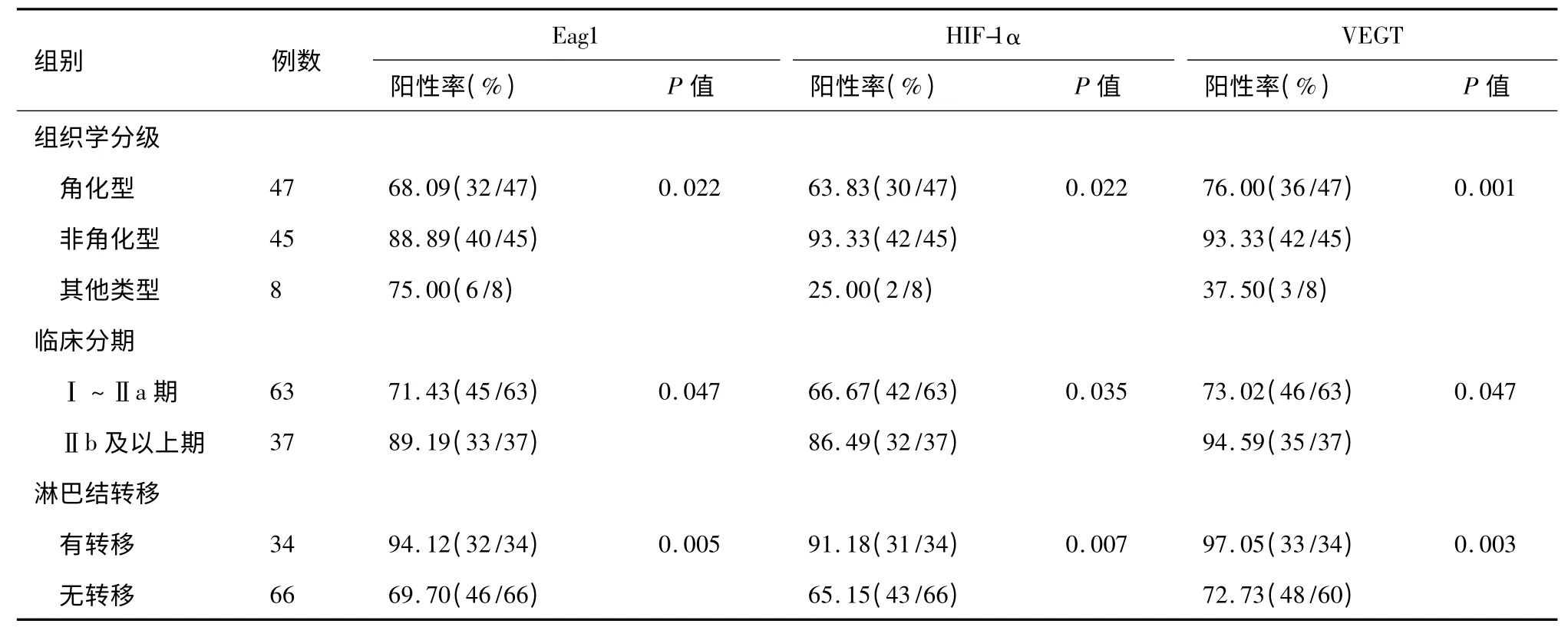
表2 Eag1、HIF-1α 和VEGT 的表达与临床病理特点
2.3 Eag1、HIF-1α 和VEGT 蛋白在放射治疗前后的表达
从表3 可知,放疗前Eag1、HIF-1α 及VEGF 阳性表达率较放射治疗后阳性表达率明显下降,两者比较有统计学意义(P <0.05)。
2.4 宫颈鳞癌中Eag1、HIF-1α 和VEGF 蛋白表达的相关性
从表4 可知,子宫颈鳞癌组织中Eag1 蛋白与HIF-1α 蛋白的表达(r =0.291)及VEGF(r =0.297)蛋白的表达均呈正相关(均为P <0.01)。子宫颈鳞癌组织中HIF-1α 蛋白与VEGF 蛋白的表达呈正相关(r=0.294,P <0.01)。因此,Eag1、HIF-1α 与VEGF三者在宫颈癌组织中的表达呈正相关性。

表4 宫颈鳞癌组织中Eag1、HIF-1α 和VEGF 蛋白表达的相关性
3 讨论
3.1 Eag1 在宫颈不同病变组织中的表达及其临床意义
在人类,Eag 家族被发现有8 个成员,而成员之一Eag1(Kv10.1,KCNH1)钾通道被认为是Eag 家族中与恶性肿瘤关系最为密切的钾通道之一[4]。在正常组织中Eag1 钾离子通道蛋白主要存在于脑组织,在胎盘和成肌细胞中也有少量表达[5]。在多种上皮性肿瘤组织中钾通道蛋白均有高表达,如肝癌、胰腺癌、肾细胞癌、前列腺癌、子宫内膜癌、卵巢囊腺癌、甲状腺乳头状癌、支气管癌等[6]。
本实验显示宫颈鳞癌组织中Eag1 蛋白的阳性表达率高于CIN 组和宫颈慢性炎症组,CIN 组Eag1蛋白的阳性表达率高于宫颈慢性炎症组。Eag1 蛋白的表达率在非角化型宫颈鳞癌高于角化型鳞癌,晚期宫颈癌(Ⅱb 及Ⅱb 期以上)高于中早期宫颈癌(Ⅰ~Ⅱa 期),有淋巴结转移者高于无淋巴结转移,并且随着病变程度的加重,Eag1 表达逐渐增高。提示Eag1 钾通道蛋白的表达在宫颈癌发生发展过程中起十分重要的作用,并且与宫颈癌的临床分期、淋巴结是否转移密切相关,该结果与林爽等[7]研究结果一致。实验中我们还发现Eag1 的表达与宫颈癌组织学类型也有密切关系,该结论与现有报道不太一致,有待进一步增加病例数充实该项结论。
研究中,还选择了50 例放射治疗前后标本对比观察Eag1 的表达情况,结果发现放疗前Eag1 的阳性表达率高于放疗后。进一步观察时发现,5 例在放疗前Eag1 呈弱阳性表达的患者,完成放射治疗后,经手术切除的标本中,仅见少量癌残留,可见明显炎症反应和坏死。而强阳性表达的患者放疗后癌组织均残存较多。Eag1 在恶性肿瘤组织放疗前后的表达情况尚未见报道,初步分析放疗后Eag1 表达减少的原因可能是:①经过放射治疗后肿瘤细胞抗原发生丢失,造成Eag1 表达减少;②放射后癌组织体积缩小甚至不见癌残留,从而影响阳性表达;③放射过程中会使宫颈组织中的微血管和淋巴管发生闭塞,造成肿瘤坏死组织增多,从而影响Eag1 的表达。我们认为,Eag1 的表达与放疗效果之间存在相关性,癌组织中低表达者对放射治疗敏感,放疗效果好于高表达者,原因可能是Eag1 的高表达会促使HIF 转录增多,促使血管生成增多,使肿瘤组织适应缺氧环境,增加肿瘤内部乏氧区域,造成放射抵抗,影响放射治疗效果。林爽等[8]应用钾通道阻断剂四氨基吡啶(4-amino-pyridine,4-AP)研究宫颈癌Hela 细胞时发现,4-AP 能增加宫颈癌细胞对中子照射的敏感性。分析认为4-AP 能明显降低HIF-1α 表达,降低HIF-1α 高表达所致的肿瘤低氧性放疗抵抗。进一步说明Eag1 的表达与肿瘤治疗密切相关,有望成为肿瘤靶向治疗的靶点。
3.2 HIF-1α 在宫颈不同病变组织中的表达及其临床意义
缺氧诱导因子(HIF-1)是人体细胞发生缺氧应答时的关键性调控因子,在缺氧状态下,HIF-1α 会在缺氧信号的刺激下大量转录,且转录出的HIF-1蛋白表达稳定,进而促进一系列缺氧反应基因的转录,进而促进多种缺氧适应蛋白的合成,促进肿瘤细胞生长、浸润和转移[9-10]。
本研究显示宫颈鳞癌组织中HIF-1α 蛋白的阳性表达率高于CIN 组和宫颈慢性炎症组,CIN 组HIF-1α 蛋白的阳性表达率高于宫颈慢性炎症。进一步分析发现宫颈癌病理分化程度愈低、临床分期得愈晚以及有淋巴结转移者,HIF-1α 蛋白的阳性表达率表达愈高。这与结肠癌、胃癌的研究结果相似[11-12]。结果提示随着宫颈病变的进展,缺氧程度不断加重,肿瘤细胞内HIF-1α 浓度增加,促使相关靶基因转录,促使宫颈癌病变进展。50 例宫颈癌放疗前HIF-1α 阳性表达率是48%,放疗后为22.8%,放疗后明显下降,具有统计学意义(P <0.05),再进一步观察发现,5 例放疗前HIF-1α 呈弱阳性表达的患者,经过放疗后手术标本中,仅见少量癌细胞残留,提示HIF-1α 的表达与放疗效果之间存在相关性,癌组织中低表达者对放射治疗敏感,放疗效果好于高表达者,这与宋娜莎[13]研究结果类似。
3.3 VEGF 在宫颈不同病变组织中的表达及其临床意义
VEGF 是诱导肿瘤产生新生血管的关键因子之一。黄一凡等[14]在应用实时荧光定量(PCR)和免疫组化法检测结肠癌组织及正常结肠组织中VEGFmRNA 及VEGF 蛋白的表达情况时发现,VEGF 蛋白的表达与结肠癌发生、淋巴结转移、组织学分类及Dukes 分期呈正相关(P <0.05)。
本实验研究显示宫颈鳞癌组织中VEGF 蛋白的阳性表达率高于CIN 组和宫颈慢性炎症组,CIN 组VEGF 蛋白的阳性表达率高于宫颈慢性炎症。非角化型鳞癌中VEGF 的表达高于角化型鳞癌,早期宫颈癌(Ⅰ~Ⅱa 期)VEGF 蛋白表达率低于晚期宫颈癌(Ⅱb 及Ⅱb 期以上),在淋巴结转移组中VEGF蛋白的表达明显高于无淋巴结转移组。说明VEGF在宫颈癌的生长发展,侵袭过程中起着重要作用,与子宫颈癌的侵袭、转移及患者预后不良有密切联系。
放疗前宫颈鳞癌VEGF 的阳性表达率是56%,放疗后降为24%,放疗前VEGF 阳性表达率明显高于放疗后。提示VEGF 在宫颈鳞癌放射治疗过程中发挥重要的作用,可作为宫颈鳞癌放射治疗疗效的预测指标之一。
3.4 Eag1、HIF-1α、VEGF 在宫颈不同病变组织中表达的相关性
从表1 -4 中可知,Eag1、HIF-1α、VEGF 三者均随宫颈鳞癌的进展而表达增高,并且三者呈正相关表达。我们推测在宫颈鳞癌的生长发展过程中,Eag1 钾离子通道的激活与肿瘤的缺氧状态和血管生成密切相关。肿瘤组织在体积增大到一定程度后中央区域必然会发生缺氧[15],Eag1 钾离子通道感受到肿瘤细胞缺氧信息后将低氧信息传递到细胞核内,激活HIF-1α 基因的表达,在肿瘤细胞内产生大量的HIF-1α,过多的HIF-1α 蛋白又进一步促进VEGF 蛋白的表达增多,Eag1、HIF-1α,VEGF 大量表达的结果是为肿瘤细胞的持续增生提供营养,促进肿瘤细胞增殖,肿瘤体积增大。
综上所述,我们认为Eag1、HIF-1α、VEGF 联合检查可作为宫颈鳞癌早期诊断、判断肿瘤浸润进展和预后的指标,有望成为宫颈鳞癌患者的治疗新靶点。
[1] 刘黎琼,李慧玉,黄士昂.herg1 基因与肿瘤[J].国际病理科学与临床杂志,2006,27(1):15 -18
[2] Ziechner U,Schönherr R,Born AK,et al.Inhibition of human ether à go-go potassium channels by Ca2+/calmodulin binding to the cytosolic N-and C-termini[J].FEBS J,2006,273(5):1074 -1086
[3] Hao XP,Willis JE,Pretlow TG,et a1.Loss of fragile histidine triad expression in colorectal carcinomas and premalignant lesion[J].Cancer Res,2000,60(1):18 -21
[4] Swinson DE,Jones JL,Cox G,et al.Hypoxia-inducible factor-1 alpha in non small cell lung cancer:relation to growth factor,protease and apoptosis pathways[J].Int J Cancer,2004,111(1):43 -50
[5] Zhong H,Semenza GL,Simons JW,et al.Up-regulation of hypoxiainducible factor 1alpha is an early event in prostate carcinogenesis[J].Cancer Detect Prev,2004,28(2):88 -93
[6] Hemmerlein B,Weseloh RM,Mello de Queiroz F,et al.Overexpression of Eag1 potassium channels in clinical tumours[J].Mol Cancer,2006,5:41
[7] 林 爽,李 力,易 萍,等.宫颈癌中Eag1 钾离子通道的表达以及缺氧对其的调控作用[J].重庆医学,2010,39(8):899 -901
[8] 林 爽,李 力,刘 媛.钾通道阻断剂四氨基吡啶增加宫颈癌细胞对中子照射的敏感性[J].第三军医大学学报,2008,30(10):953 -956
[9] Clottes E.Hypoxia-inducible factor 1:regulation,involvement in carcinogenesis and target for anticancer therapy[J].Bull Cancer,2005,92(2):119 -127
[10] Luo H,Rankin GO,Liu L,et al.Kaempferol inhibits angiogenesis and VEGF expression through both HIF dependent and independent pathways in human ovarian cancer cells[J].Nutr Cancer,2009,61(4):554 -563
[11] 潘克俭,赖 雁,梁素华,等.HIF-1α 和VEGF 在结肠癌组织和SW480 细胞中表达的生物学意义[J].川北医学院学报,2007,22(4):316 -319
[12] 刘长兵,吴继锋.胃癌中TGF-β、HIF-1α、VEGF 的表达及临床意义[J].临床与实验病理学杂志,2013,29(7):733 -736
[13] 宋娜莎.HIF-1α 在食管鳞癌中的表达情况及其与治疗疗效关系的研究[D].河南:河南科技大学,2013
[14] 黄一凡,唐琼兰,谢贤镛,等.VEGF 基因在结肠癌中的表达及意义[J].川北医学院学报,2007,22(3):216 -218
[15] Fang JS,Gillies RD,Gatenby RA.Adaptation to hypoxia and acidosis in carcinogenesis and tumor progression[J].Semin Cancer Biol,2008,18(5):330 -337

