产纤维素酶芽孢杆菌10768原生质体紫外诱变探讨
钟丽娟,赵新海,池景良,张庆华,朱巍巍,关艳丽
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
利用原生质体进行微生物遗传育种是近几十年来迅速发展的一种育种技术,其基本实验方法已较成熟,主要集中在原生质体制备及再生、紫外及化学诱变、原生质体融合与转化等方面。应用原生质体诱变技术改造微生物菌种在实践中取得了显著成果,例如通过原生质体紫外诱变提高相关菌种产紫杉醇、苏云金毒素、谷胱甘肽、α-淀粉酶等微生物代谢产物的能力[1]。作者对秸秆生物降解产品的生产菌株10768进行原生质体紫外诱变,比较了突变菌株的刚果红透明圈大小和纤维素酶活力,旨在筛选出高产纤维素酶的菌株,为下一步菌种选育及菌株改良提供依据。
1 材料与方法
1.1 供试菌株
LCCC10768由辽宁省微生物菌种保藏中心提供,该菌株为辽宁省微生物科学研究院自主研发的秸秆生物降解菌种,产品已获得农业部微生物肥临时登记证 (2011临字1374号)。
1.2 原生质体制备
取进入对数生长期的菌种以1%的接种量转入LB液体培养基中,30℃,180 r·min-1振荡培养3 h后,加入4 U·mL-1青霉素钠溶液继续培养2 h,3000 r·min-1离心10min收集菌体,用高渗磷酸缓冲液洗涤2次,调整菌体浓度至108个·mL-1,吸取菌液 10mL,3000 r·min-1离心5min,加入5mL溶菌酶缓慢混合均匀,置于37℃温水浴中保温酶解,每隔30min取样镜检,至大部分菌体破壁,释放出原生质体即停止酶解。酶解结束后,3000 r·min-1离心10min,用高渗磷酸缓冲液洗涤2次以清除酶液,将原生质体重新悬浮于渗透压稳定液SMM中[2],用血球计数板计数,计算原生质体形成率[3-6]。
1.3 原生质体紫外诱变
将制备好的原生质体用SMM稀释至106mL-1,取5mL于无菌培养皿中,将培养皿置于磁力搅拌器上,调整距离为30 cm,紫外灯照射剂量分别为30 s,60 s和120 s,照射的同时进行磁力搅拌[7]。
1.4 原生质体再生
在暗室条件下,将经过紫外诱变的原生质体分别用SMM和无菌水进行梯度稀释,轻轻吸放于DM3琥珀酸钠再生培养基[8]上 (下层加入2%琼脂,上层加入0.5%琼脂,提前一天倒好再生培养基的下层,以使表面干燥),缓慢倒入培养基上层,混合均匀,每处理重复3次,放置于纸箱中避光,30℃恒温培养。将未进行紫外诱变的原生质体用SMM稀释后吸放于再生培养基上培养,3次重复,用于计算紫外致死率。
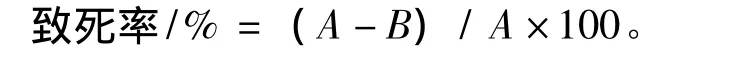
其中,A为未诱变的原生质体再生菌落数,B为SMM稀释的紫外诱变原生质体菌落数。
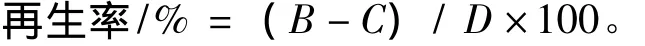
其中,B为SMM稀释后再生菌落数,C为水稀释后生长菌落数,D为血球计数器法测得的原生质体数。
将经过紫外照射60 s,将DM3培养基上生长出的菌落挑至LB平板培养基上,划线纯化保存。
1.5 刚果红透明圈法初筛
将突变菌株点接至CMC-Na培养基上,30℃恒温培养48 h,用游标卡尺测定菌落直径后,倒入10mg·mL-1刚果红染色1 h后,用1 mol·L-1NaCl溶液冲洗,测定透明圈直径。
1.6 突变菌株液体产酶活力测定
将供试液体菌株以2%接种至秸秆粉培养基中,30℃,180 r·min-1振荡培养120 h后,将培养液转于7000 r·min-14℃条件下离心10min,上清液即为粗酶液。产酶活力测定方法参照吴红艳等[9]。
2 结果与分析
2.1 紫外诱变剂量对菌株10768原生质体致死率的影响
不同紫外诱变剂量对10768原生质体致死率的影响见表1,随着诱变剂量增加,致死率升高,据文献报道,致死率在70%~80%时存活菌变异现象显著,正突变率高,诱变效果好。因此选择10768原生质体的紫外诱变剂量为60 s。
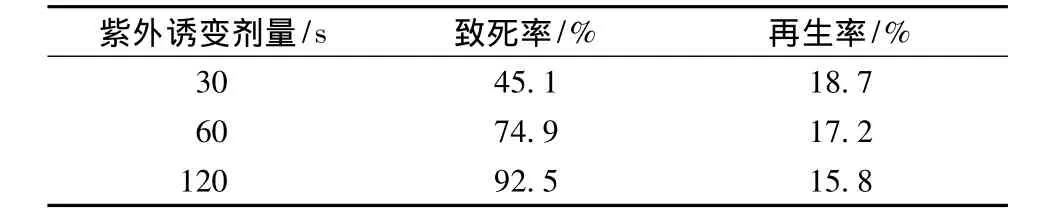
表1 紫外诱变剂量对原生质体致死率及再生率的影响
2.2 突变菌株刚果红透明圈法初筛结果
利用紫外突变,共分离出97株菌株,分别点接至CMC-Na培养基上,其中11株透明圈较大,其透明圈直径/菌落直径均大于原始菌株,测定结果见表2。UV09,UV14和UV22的比值较大,选择这3个菌株为优良突变株进行纤维素酶酶活的测定。
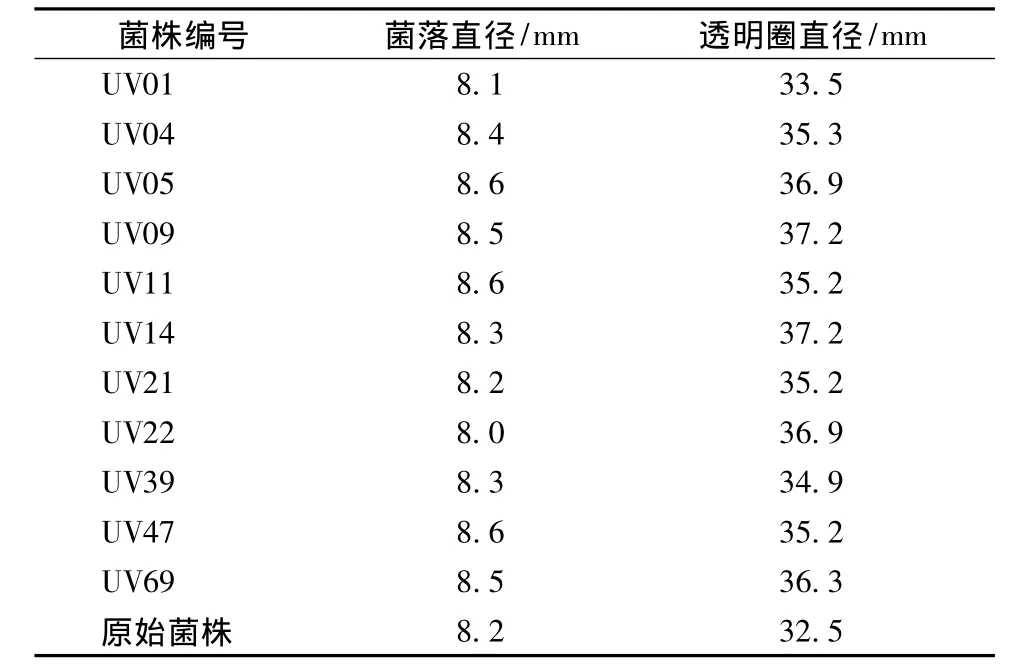
表2 原生质体再生突变株刚果红透明圈法测定结果
2.3 突变菌株液体培养物纤维素酶活测定结果
供试的3株突变菌株的纤维素酶活力测定结果见表3。透明圈大的突变株,其在液体培养基中纤维素酶活也高,其中UV22的纤维素酶活较原始菌株提高了51%。
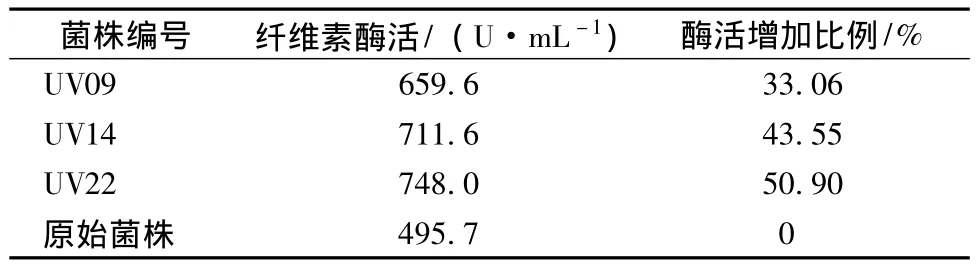
表3 突变菌株固体培养物纤维素酶活测定结果
3 小结与讨论
本文主要研究了秸秆生物降解菌株10768的原生质体紫外诱变剂量及其突变株纤维素酶活力。虽然原生质体制备的试验技术已相当成熟,但不同菌株生理特性各异,原生质体制备条件不尽相同,本研究在原生质体制备中加入了4 U·mL-1青霉素,缩短了试验周期;所获得的97株突变株有3株透明圈直径/菌落直径的比值大于4.38,纤维素酶活力较原始菌株提高30%以上,尤其是UV22的纤维素酶活力增加了50.90%。本试验结果表明原生质体紫外诱变技术是进行菌种选育的有效手段,后续还将开展突变菌株产酶稳定性的研究。随着原生质体技术的发展,微生物的原生质体融合及转化技术也已日渐成熟[10],融合2株乃至多株菌株从而获得多个优良性状的生产菌种是微生物菌种选育今后的努力方向。
[1]丁晓兵,李宗伟,刘晓波,等.原生质体诱变在工业微生物育种中的应用进展[J].食品工业科技,2008(7):260-262.
[2]张克旭,陈宁,张永志,等.用原生质体融合技术选育谷氨酸高产菌[J].微生物学报,1991,31(2):108-114.
[3]袁铸,王忠彦,胡承,等.地衣芽孢杆菌JF-20菌原生质体的形成及其再生的最佳条件[J].四川大学学报:自然科学版,2001,38(5):723-727.
[4]涂永勤,肖崇刚.蜡质芽孢杆菌(Bacillus cereus)原生质体形成与再生条件研究 [J].生物学杂志,2005,22(5):17-19.
[5]王媛媛,段玉玺,陈立杰,等.枯草芽孢杆菌 Snb2原生质体制备和再生研究 [J].沈阳农业大学学报,2011,42(1):110-113.
[6]郑重谊,谭周进,肖克宇,等.不同因素对两株细菌原生质体制备的影响[J].生物技术通报,2007(5):131-135.
[7]谢凤行,张峰峰,周可,等.原生质体诱变选育高纤维素酶活性枯草芽孢杆菌的研究 [J].华北农学报,2010,25(5):211-214.
[8]刘新梅,高宇,赵静,等.纳豆菌原生质体制备与再生条件的研究 [J].食品科学,2007,28(5):231-236.
[9]吴红艳,王智学,陈飞,等.有机物料腐熟剂中纤维素酶活力测定方法的验证 [J].微生物学杂志,2011,31(4):107-109.
[10]王登宇,臧威,孙剑秋,等.细菌原生质体融合育种技术及其应用进展[J].中国酿造,2008,184(7):1-6.

