酒精性脂肪肝大鼠肠源性内毒素血症模型的建立
张军会,王永辉,周 然,王悦尧
·酒精性肝病·
酒精性脂肪肝大鼠肠源性内毒素血症模型的建立
张军会,王永辉,周 然,王悦尧
目的建立酒精性脂肪肝大鼠肠源性内毒素血症模型。方法采用梯度酒精灌胃法早晚两次灌胃,并以10%酒精为饮料,建立大鼠酒精性脂肪肝模型。分别于3w和6w检测肝脂肪变、肝内炎症、肝功能和血清内毒素水平。结果模型组自6w出现显著的肝脂肪变,肝指数(3.6±0.2)、肝脂肪变积分(3.0±0.9)和炎症积分(1.0±0.6)均显著高于同期对照组水平[分别为(3.1±0.1)、(0.0±0.0)和(0.0±0.0),P<0.05];在6周时模型动物血浆内毒素、血清D-乳酸、二胺氧化酶和AST分别为(1435.6±52.9)pg/ml、(20.7±5.4)mmol/L、(25.5±2.0)U/L和(124.5±13.2)U/L,较正常组均明显升高[分别为(89.9±10.5)pg/ml、(5.0±1.1)mmol/L、(7.4±1.7)U/L和(40.4±15.2)U/L,P<0.05]。结论用该方法连续6w成功建立单纯性酒精性脂肪肝肠源性内毒素血症模型。
酒精性脂肪肝;肠源性内毒素血症;肠黏膜通透性;大鼠
深入研究酒精性肝病的发病机理,寻找有效的防治药物及探讨防治机制,需要建立一个可靠的动物模型。研究资料显示:肠源性内毒素是血液中内毒素的主要来源,长期大量饮酒可引起酒精性肝病和血液内毒素水平明显升高[1]。内毒素在酒精性肝病的发病和疾病的进展过程中的作用至关重要[2]。尽管目前建立酒精性肝病及内毒素血症动物模型的文献报道较多,却未见明确提出建立酒精性肝病和肠源性内毒素血症复合动物模型的报道。有鉴于此,本文就建立单纯酒精性脂肪肝肠源性内毒素血症模型作了反复试验,得到了较为可靠的造模方法,现报道如下。
1 材料与方法
1.1 动物与试剂健康SPF级雄性SD大鼠100只[军事医学科学院实验动物中心提供,许可证号:SCXK-(军)2007-004],体质量220~250g;乳果糖口服液(北京韩美药品有限公司);无水乙醇(分析纯,天津市北辰方正试剂厂)。检测大鼠内毒素(lipopolysaccharide,LPS)试剂盒和D-乳酸(D-lac-tate,D-LAC)试剂盒(上海西唐生物科技有限公司);二胺氧化酶(diamine oxidase,DAO)试剂盒、丙转氨氨基转移酶(alanine aminotransferase,ALT)测试盒(微板法)、天冬氨酸氨基转移酶(aspertate aminotransferase,AST)测试盒(微板法,南京建成生物工程研究所)。
1.2 酒精性脂肪肝肠源性内毒素血症模型的建立取大鼠100只,随机分为正常组(20只)、模型组(40只)和乳果糖处理组(40只)。模型组动物在1w以30%酒精15m1·kg-1·d-1(相当于纯酒精4.5g·kg-1·d-1),2 w以40%酒精15m1·kg-1·d-1(6g·kg-1·d-1)和3 w及以后以50%酒精15m1·kg-1·d-1(7.5g·kg-1·d-1,每周根据动物体重变化调整剂量)灌胃,2次/d,同时给予10%酒精为唯一饮料;乳果糖组自3 w开始,给予模型动物乳果糖(1.35g·kg-1·d-1)灌胃,1次/d;正常组生理盐水灌胃,2次/d,试验周期为6 w。自3 w末开始每周每组于灌胃结束后2~24h内随机抽取6只动物,以水合氯醛腹腔注射麻醉后,在无菌条件下打开腹腔,于腹主动脉取血,分别置于有抗凝剂(除热源)和无抗凝剂的试管中,离心,分别取血浆或血清,置-40℃冰箱低温保存,备检;迅速取下肝脏,生理盐水冲洗后用滤纸吸干,用电子天平称量肝脏湿重,并计算肝指数[肝指数=肝脏湿质量(g)/动物体质量(g)×100%][3,4];取肝左叶,甲醛固定,石蜡包埋,切片,HE染色,光镜下观察肝脏细胞脂肪变性程度及炎症程度,并根据中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的酒精性肝病诊疗指南(2010年修订版)将肝脂肪变性分为4度(F0~4),将炎症程度分为4级(G0~4)[5],并分别计分为0~4分。
1.3 统计方法所有数据均采用SPSS17.0软件进行统计分析。计量资料以(±s)表示,采用t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 肝指数变化见表1。
表1 各组大鼠肝指数(±s)比较

表1 各组大鼠肝指数(±s)比较
与正常组和乳果糖组比,①P<0.05
2.2 肝脏组织病理学变化见表2。
表2 各组肝脂肪变性和炎症程度计分(±s)的比较
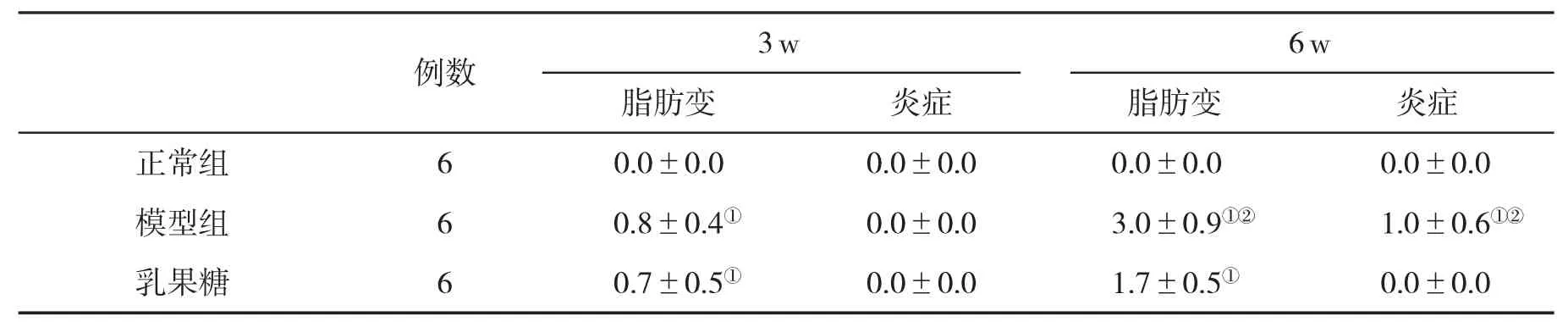
表2 各组肝脂肪变性和炎症程度计分(±s)的比较
与正常组比,①P<0.05;与乳果糖组比,②P<0.05
2.3 各组血清指标的比较见表3。
表3 各组血清指标(±s)的比较

表3 各组血清指标(±s)的比较
与正常组和乳果糖组比,①P<0.01
3 讨论
肝脏组织病理学检查是判断酒精性脂肪肝和酒精性肝炎的金标准,通过在光镜下直接观察,可以较准确地判断组织是否有脂肪变性、炎细胞浸润及其病变程度等[6]。
在正常情况下,肠道内细菌产生大量的LPS,但在肠道的屏障作用下,仅有极少量的LPS通过肠壁进入血液循环,一般不会对人体造成损害[7]。长期饮酒可引起肠道菌群失调和肠黏膜屏障功能障碍,肠道产生的LPS便可大量吸收入血液循环,当超过肝脏的清除能力时即可造成血液LPS水平升高,造成器官功能损害,而肝脏是LPS损害的主要靶器官[8,9]。D-LAC是细菌发酵的代谢产物,哺乳动物组织不会产生D-LAC,被吸收入血的D-LAC也不能或仅能缓慢地被代谢清除。正常情况下血D-LAC水平很低,当肠粘膜生物屏障受到损害时,致肠粘膜通透性增加,肠道中细菌产生的大量D-LAC可通过受损粘膜经循环入血,故血液D-LAC水平可及时反映肠粘膜通透性改变和肠粘膜损害程度[10]。DAO是具有高度活性的细胞内酶类,95%以上存在于哺乳动物的小肠黏膜或纤毛上皮细胞中,当肠粘膜屏障功能损害时,DAO随肠粘膜细胞脱落入肠腔而最终进入血液,使其血中活性升高。因此,血DAO活性可反映肠粘膜屏障功能的状况[11,12]。
目前,在制备酒精性脂肪肝动物模型时多选用市售白酒,或白酒联合高脂饲料。在白酒(或乙醇)联合高脂饲料造出的模型中究竟是高脂饲料发挥了主要作用,还是白酒的作用,可能无法定论,因而存在弊端。本试验以无水乙醇(分析纯)为造模试剂,其纯度高(乙醇质量浓度≥99%)、杂质少,排除了其它杂质对造模的影响。
国外学者在对SD大鼠肠道微生态的研究发现,乳果糖可以抑制肠道有害细菌生长,增加肠道双歧杆菌的活菌数量[13]。体外实验证明:乳果糖可直接灭活试管内和肠道内的内毒素[14]。人体试验也证实口服乳果糖对肠源性内毒素血症有较好的治疗作用[15]。
本组模型大鼠在实验4w均出现肝细胞脂肪变性,但脂肪变程度仍较轻,5w则出现中、重度脂肪变性,但未见明显的炎症改变,在6w大多数出现较明显的炎症表现。模型动物在5w血浆LPS水平升高显著,证实了内毒素血症的存在,5w血清DAO和D-LAC明显升高,与内毒素的升高呈平行关系,可作为血液中内毒素为肠源性内毒素的佐证。
在3~6w给予乳果糖灌胃后,模型动物血浆内毒素水平明显低于灌胃前水平(P<0.05),可能与乳果糖改善了肠道的屏障功能,抑制了血清DAO和D-LAC水平有关。乳果糖在一定程度上还减缓了肝细胞脂肪变程度,抑制了酒精性脂肪肝向酒精性肝炎的转化,可能与乳果糖通过降低血浆内毒素水平,减弱了内毒素对肝细胞的损伤有关。乳果糖的干预在一定程度上反证了模型动物血浆内毒素为肠源性内毒素。
长期饮酒是导致人类肝损伤的重要原因,也是血液内毒素水平升高的主要原因。内毒素血症在酒精性肝病的发病和进展过程中的作用至关重要。本试验成功建立了酒精性脂肪肝肠源性内毒素血症动物模型,将会为进一步研究内毒素与肝损伤的作用机制及研发针对酒精性脂肪肝内毒素血症的新药提供可靠的动物模型。
[1]方志红,胡义扬,崔剑巍,等.大鼠酒精性肝损伤与肠内毒素渗漏的关系及健脾理气活血方的干预作用.中国中西医结合杂志,2006,26(9):813-817.
[2]茹清静.脂肪性肝病.北京:中国医药科技出版社,2010:34.
[3]张瑶纾,吴志丽,王焕,等.桔梗对异烟肼和利福平致小鼠肝损伤的保护作用.天津医科大学学报,2010,16(4):577-579.
[4]勾春燕,阎海燕,尚宏伟,等.复方牛胎肝提取物减轻非酒精性脂肪性肝炎大鼠肝脏脂肪变性及炎症程度.中华肝脏病杂志,2009,17(2):141-142.
[5]中华医学会肝病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南(2010年修订版).中华肝脏病杂志,2010,18(3):167-170.
[6]汪锐.中药治疗乙肝患者前后血清中AST、ALT及AST/ALT比值的变化.临床和实验医学杂志,2010,9(15):1176-1177.
[7]马思远,张雅萍.肠源性内毒素损害防治策略思考.中华烧伤杂志,2011,27(2):125-127.
[8]黄古叶,毛德文.胡国平,等.大黄煎剂配合西药治疗慢性重型肝炎肠源性内毒素血症疗效观察.辽宁中医杂志,2006,33(12):1588-1589.
[9]王融冰,刘军民,吴云忠,等.清毒汤治疗肝病肠源性内毒素症临床观察.中西医结合肝病杂志,2004,14(3):135-137.
[10]Murray MI,Gonze MD,Nowak LR,et al.Serum D-lastate levels as all aid to diagnosing acute intestinal ischemia.Am J Surg,1994,167(6):575-578.
[11]赵薇,李晓欧,娄国强,等.病毒性肝炎后肝硬化患者肠道的通透性.中华传染病杂志,2002,20(2):105-107.
[12]于淑霞,王惠吉.肝硬化患者肠通透性及乳果糖对其影响的研究.临床肝胆病杂志,2006,22(2):108-110.
[13]Bielecka M,Biedrzycka E,Majkowska A,et a1.Effect of nondigestible oligosaccharides on gut microecosystem in rats.Food Res Inter,2002,35:139-144.
[14]于中麟,钱林学.乳果糖在肝病中的应用.中华内科杂志,1996,35(2):65-66.
[15]张顺财,戴茜,王吉耀,等.口服乳果糖对肝病肠源性内毒素血症及细胞因子的影响.中华肝脏病杂志,2000,8(3):185.
(收稿:2013-09-06)
(校对:陈从新)
Establishment of experimental model of alcoholic fatty liver accompanied with intestinal endotoxemia in rats
Zhang Junhui,Wang Yonghui,Zhou Ran,et al.
Chengdu University of Traditional Chinese Medicine,Chengdu 610075,Sichuan Province,China
ObjectiveTo establish an experimental model of alcoholic fatty liver accompanied with intestinal endotoxemia in rats.MethodsA rat model of alcoholic fatty liver was established by gradient ethanol gavage method;The liver steatosis,intrahepatic inflammation,liver function tests and serum lipopolysaccharide were determined at 3 and 6 weeks of experiment.ResultSignificant liver steatosis was observed after 6 weeks of ethanol administration in the model rats;The liver index,liver steatosis scores,inflammation scores in model rats were(3.6± 0.2),(3.0±0.9)and(1.0±0.6),respectively,significantly higher than those in normal controls[(3.1±0.1),(0.0±0.0)and(0.0±0.0),respectively,P<0.05)];Similarly,serum lipopolysaccharide,D-lactate,diamine oxidase and aspertate aminotransferase levels in model rats at 6 months were(1435.6±52.9)pg/ml,(20.7±5.4)mmol/L,(25.5±2.0)U/L and(124.5±13.2)U/L,which were also significantly higher than those in normal controls[(89.9±10.5)pg/ml,(5.0± 1.1)mmol/L,(7.4±1.7)U/L and(40.4±15.2)U/L,respectively,P<0.05].ConclusionA rat model of alcoholic fatty liver accompanied with intestinal endotoxemia can be successfully establish by using gradient ethanol gavage for 6 weeks.
Alcoholic fatty liver;Intestinal endotoxemia;Permeability of intestinal mucosa;Rats
10.3969/j.issn.1672-5069.2014.01.005
610075成都市成都中医药大学(张军会,王悦尧);山西中医学院(张军会,王永辉,周然,王悦尧)
张军会,男,33岁,博士研究生,讲师。主要从事方剂临床应用、作用的物质基础及其机理研究。E-mail:522610483@qq. com

