不同氧环境及葡萄糖浓度对骨骼肌卫星细胞生长的影响
吴 嵽,陆耀飞
骨骼肌卫星细胞在骨骼肌的生长、维持和损伤后的修复过程中起着重要的作用[26]。对于骨骼肌卫星细胞而言,O2是一个非常重要的环境因素[9]。正常情况下,空气中O2浓度约为21%,生理条件下,在体培养的骨骼肌纤维内O2含量却低于21%,约为5%[17]。有研究指出,<6%的O2浓度可以认为是低氧环境[12];还有研究通过微电极测量发现:设定3%O2浓度的培养箱内实际测得的浓度为3±2%,近似等于生理条件下的骨骼肌纤维中O2的水平[24]。又有研究认为,从含标准浓度(5mM)至高浓度(20 to 115mM)葡萄糖的生长培养液来看,细胞的增殖与葡萄糖的浓度呈现量效关系[20]。
本研究通过不同氧环境结合不同葡萄糖浓度,观察两者对骨骼肌卫星细胞生长的影响,探讨可能的作用机制,为骨骼肌卫星细胞的增殖、骨骼肌的损伤修复提供进一步的实验依据。
1 材料与方法
1.1 实验动物与分组
雄性SD大鼠2只,4周龄,体重120g,清洁级,由上海第二军医大学实验动物中心提供。
原代培养后取第三代骨骼肌卫星细胞作为实验对象。分组:对照组:生长培养液中不加细胞;实验组:生长培养液中加细胞;实验组又分为:常氧低糖组(21%O2+5.5 mM Glu)、常氧高糖组(21%O2+25mM Glu)、低氧低糖组(1%O2+5.5mM Glu)、低氧高糖组(1%O2+25mM Glu)。
1.2 主要仪器和试剂
CO2细胞培养箱(Thermo)、Leica倒置显微镜(Leica)、酶联免疫检测仪 (Bio-rad)、低氧工作站INVIVO2200(RUSKINN TECHNOLOGY);DMEM、马血清、胎牛血清(Gibco)、横纹肌肌动蛋白抗体、SABC试剂盒、DAB显色剂(武汉博士德)CCK-8试剂盒(南通碧云天)、LDH试剂盒(南京建成)。
1.3 实验方法
1.3.1 准备工作
手术前1天,0.001%的多聚赖氨酸工作液包被细胞培养瓶,置于超净工作台内12h以上。包被完成后,吸去多余的多聚赖氨酸工作液,用0.01M无菌PBS清洗细胞培养瓶底1~2次,置于超净工作台内晾干备用。
1.3.2 原代培养
10%的水合氯醛以0.4ml/100g体重的剂量腹腔麻醉大鼠。无菌条件下分离两侧腓肠肌与比目鱼肌,0.1%II型胶原酶消化后胎牛血清终止消化,弃去上清液,加入5 ml种植培养液后吹打混匀。收集细胞悬液,依次通过100目、200目、400目的不锈钢细胞筛过滤后制成单细胞悬液,台盼蓝染色后进行细胞活性检测。将细胞接种于未经多聚赖氨酸包被的细胞培养瓶中,种植密度不低于105个细胞/ml,放入培养箱中培养,培养条件为:37℃,5%CO2,100%空气湿度。2h后,将细胞培养瓶中细胞悬液接种到新的未经多聚赖氨酸包被的细胞培养瓶中。2h后,将第一次差速贴壁的细胞培养瓶中的细胞悬液接种到经多聚赖氨酸包被的细胞培养瓶中,48h后首次换液。之后每隔两天换液一次[1]。
1.3.3 细胞传代培养
胰蛋白酶消化细胞后,按1∶3比例将细胞接种到培养瓶中[1]。
1.3.4 骨骼肌卫星细胞纯度鉴定
原代培养后进行细胞传代,继续培养7d。弃去培养板中的生长培养液,用0.01MPBS清洗1次。4%多聚甲醛固定细胞20min后,0.02MPBS清洗3次,3min/次。梯度酒精脱水:75%,85%,95%各1次,3min/次。3%H2O2室温浸泡10min,灭活内源性过氧化物酶后,0.02M PBS清洗3次,3min/次。滴加5%BSA封闭液,37℃孵育20min,弃去多余液体,无需清洗。滴加1∶100稀释的α-SCA,4℃过夜后,0.02MPBS清洗3次,3min/次。滴加生物素化山羊抗小鼠IgG,37℃孵育20min,0.02MPBS清洗3次,3min/次。滴加试剂SABC,37℃孵育20min,0.02M PBS清洗3次,3min/次。使用DAB试剂盒,取1ml蒸馏水,加试剂盒中A、B、C试剂各一滴,混匀后加至培养板中,室温显色,倒置显微镜下观察,控制反应时间。10min后用蒸馏水终止反应,然后用洗涤0.02MPBS清洗。显微镜下观察阳性细胞数,计算细胞纯度。细胞纯度(%)=(细胞总数-阴性细胞数)÷细胞总数×100%[6-7]。
1.3.5 骨骼肌卫星细胞增殖测定
将传代后的骨骼肌卫星细胞以2.5×104的密度接种在96孔培养板中,细胞贴壁后更换相应浓度葡萄糖的生长培养液。其中,常氧低糖实验组的细胞加入低糖生长培养液中后在常氧环境中培养3h,常氧高糖实验组加入高糖生长培养液后在常氧环境中培养3h;低氧低糖实验组的细胞加入低糖生长培养液后在低氧环境中培养3h;低氧高糖实验组的细胞加入高糖生长培养液后在低氧环境中培养3h后进行增殖测定。每孔加入10μl CCK-8溶液。将加入相同量培养液和CCK-8溶液,但没有加入细胞的孔作为空白对照,在细胞培养箱内继续孵育1h。在450nm测定吸光度,记录A值。
1.3.6 骨骼肌卫星细胞损伤测定
通过乳酸脱氢酶(LDH)法测定骨骼肌卫星细胞的损伤程度(表1)。
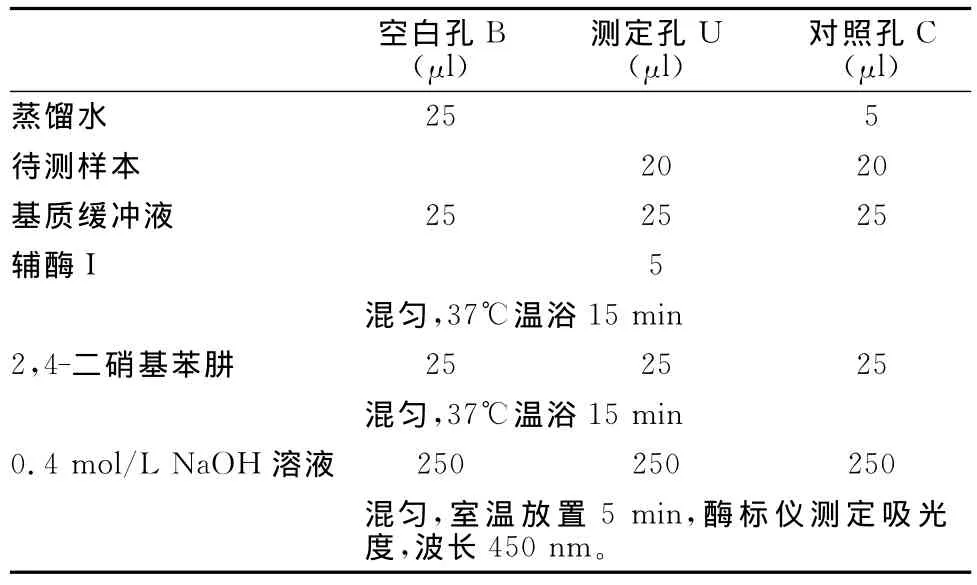
表1 本研究LDH法测定骨骼肌卫星细胞损伤程度的实验步骤一览表Table 1 The Measurement of LDH Activity Released from Damaged Cells into the Supernatant
1.4 统计学处理
2 实验结果
2.1 骨骼肌卫星细胞的形态
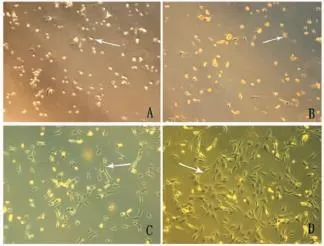
图1 本研究原代培养后不同时相的骨骼肌卫星细胞的形态观察图(100×)Figure 1. Morphological Observations of Primary Cultured Skeletal Muscle Satellite Cells(100×)
2.2 骨骼肌卫星细胞的鉴定
经α-SCA actin免疫细胞化学染色,骨骼肌卫星细胞呈阳性反应,细胞质染成棕色(图2)。
本实验计数1 000个细胞。阴性细胞数为15。
细胞纯度(%)=(1000-15)÷ 1000×100%=98.5%,达到了纯化的目的(即细胞纯度≥95%)。
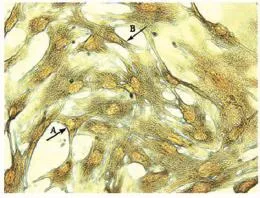
图2 本研究α-SCA actin免疫细胞化学染色图Figure 2. The Expression ofα-sarcomeric Actin(α-SCA)
2.3 不同氧气浓度、不同葡萄糖浓度培养液对骨骼肌卫星细胞的增殖影响
表2 本研究不同氧气浓度、不同葡萄糖浓度培养液对骨骼肌卫星细胞增殖的影响一览表(A值,±SD)Table 2 The Effects of Oxygen and Glucose Concentration on the Proliferation of Satellite Cells(A value,±SD)

表2 本研究不同氧气浓度、不同葡萄糖浓度培养液对骨骼肌卫星细胞增殖的影响一览表(A值,±SD)Table 2 The Effects of Oxygen and Glucose Concentration on the Proliferation of Satellite Cells(A value,±SD)
常氧低糖 常氧高糖 低氧低糖 低氧高糖对照组0.119±0.006 0.131±0.003 0.120±0.007 0.139±0.012实验组0.124±0.010 0.142±0.010 0.133±0.018 0.146±0.013
如图3所示:放入培养箱中3h后,CCK-8的结果显示,常氧低糖实验组的A值高于对照组(P<0.05),常氧高糖实验组和低氧低糖实验组的A值均显著高于对照组(P<0.01),低氧高糖实验组与对照组之间的差异没有显著性(P>0.05)。
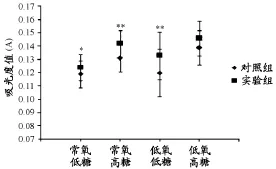
图3 本研究各对照组与实验组之间骨骼肌卫星细胞增殖情况曲线图Figure 3. The Proliferation of the Skeletal Muscle Satellite Cells of the Control Groups and the Experimental Groups
如图4所示,放入培养箱3h后,CCK-8的结果显示,常氧高糖实验组的A值显著高于常氧低糖实验组(P<0.01),低氧高糖实验组的A值显著高于低氧低糖实验组(P<0.01),表明相同氧气浓度下,高葡萄糖浓度较低葡萄糖浓度的培养液更能促进骨骼肌卫星细胞的增殖;低氧低糖实验组的A值显著高于常氧低糖实验组(P<0.01),表明相同葡萄糖浓度下,低氧浓度可以促进骨骼肌卫星细胞的增殖。

图4 本研究实验组之间骨骼肌卫星细胞增殖对比情况柱状图Figure 4. The Proliferation of the Skeletal Muscle Satellite Cells between the Experimental Groups
2.4 不同氧气浓度、不同葡萄糖浓度培养液对骨骼肌卫星细胞释放LDH的影响
表3 本研究不同氧气浓度、不同葡萄糖浓度培养液对骨骼肌卫星细胞释放LDH的影响一览表(A值,±SD)Table 3 The Effects of Oxygen and Glucose Concentration on the LDH Activity Released from the Damaged Satellite Cells(A value,±SD)
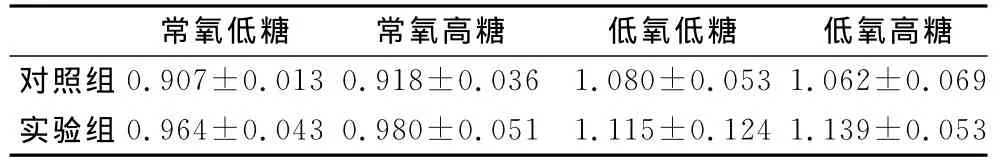
表3 本研究不同氧气浓度、不同葡萄糖浓度培养液对骨骼肌卫星细胞释放LDH的影响一览表(A值,±SD)Table 3 The Effects of Oxygen and Glucose Concentration on the LDH Activity Released from the Damaged Satellite Cells(A value,±SD)
常氧低糖 常氧高糖 低氧低糖 低氧高糖对照组0.907±0.013 0.918±0.036 1.080±0.053 1.062±0.069实验组0.964±0.043 0.980±0.051 1.115±0.124 1.139±0.053
如图5所示,放入培养箱3h后,LDH的结果显示,常氧低糖实验组、常氧高糖实验组和低氧高糖实验组的A值均显著高于对照组(P<0.01),低氧低糖实验组和对照组之间的差异没有显著性(P>0.05)。

图5 本研究各对照组与实验组之间骨骼肌卫星细胞释放LDH的情况曲线图Figure5.The LDH Activity Released from Damaged Skeletal Muscle Satellite Cells of the Control Groups and the Experimental Groups
如图6所示,培养3h后,LDH的结果显示,低氧低糖实验组的A值显著高于常氧低糖实验组(P<0.01),低氧高糖实验组的A值显著高于常氧高糖实验组(P<0.01),表明相同葡萄糖浓度下,低氧会使骨骼肌卫星细胞的LDH释放量增加。
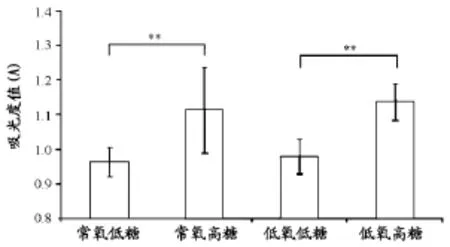
图6 本研究实验组之间骨骼肌卫星细胞释放LDH的情况柱状图Figure 6. The LDH Activity Released from Damaged Skeletal Muscle Satellite Cells between the Experimental Groups
3 分析与讨论
3.1 不同葡萄糖浓度对骨骼肌卫星细胞增殖程度的影响
生物在物质代谢和能量代谢的基础上完成各种基本生命活动。葡萄糖作为骨骼肌收缩的重要能源物质之一,主要通过以下代谢途径参与机体的物质合成与能量供应:糖酵解、磷酸戊糖途径、苹果酸-天冬氨酸穿梭、甘油磷酸穿梭、三羧酸循环、呼吸链。细胞的糖代谢取决于细胞对葡萄糖的摄取,由于葡萄糖无法自由通过细胞膜脂质双层结构进入细胞,因此,细胞对葡萄糖的摄入需要借助细胞膜上的葡萄糖转运体(glucose transporter,GLUT)来完成[33]。本实验中,在相同氧浓度下,使用含不同浓度葡萄糖的生长培养液培养骨骼肌卫星细胞3h后,CCK-8测定显示,常氧低糖实验组的A值高于对照组(P<0.05),常氧高糖实验组和低氧低糖实验组的A值均显著高于对照组(P<0.01,图3);常氧高糖实验组的A值显著高于常氧低糖实验组(P<0.01),低氧高糖实验组的A值显著高于低氧低糖实验组(P<0.01,图4),表明相同氧气浓度下,高葡萄糖浓度较低葡萄糖浓度的培养液更能促进骨骼肌卫星细胞的增殖。可能的机制是,高葡萄糖浓度培养液中较多的葡萄糖分子与GLUT结合后进入骨骼肌卫星细胞膜内,从而引起合成增加。有研究发现,高浓度葡萄糖可以增加细胞内蛋白激酶B(Akt)的表达,以及丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)的磷酸化,同时,也会增加cyclin D1、cyclin E、CDK 2和CDK 4的水平,这些因子可以共同作用,促使骨骼肌卫星细胞从G1期转入S期,进一步合成DNA,进行细胞分裂和增殖[15]。因此可以推断,葡萄糖主要是通过PI3-K/Akt和 MAPKs作用于骨骼肌卫星细胞使其增殖的。适当提高培养液中的葡萄糖浓度将有利于细胞的增殖。但是,葡萄糖的浓度是否应该保持在既能够促进细胞增殖,又不至于过高而影响细胞正常代谢值,需要后续实验来检测骨骼肌卫星细胞对葡萄糖浓度的依赖性。
3.2 不同氧气浓度对骨骼肌卫星细胞增殖程度的影响
有研究表明,O2的相关信号通路对卫星细胞起着重要的作用,可能影响到细胞的增殖和细胞周期的运转调控,从而影响骨骼肌的生长[8]。
本实验参照先前的研究[23],选取的低氧环境为1%O2。本实验发现,低氧低糖实验组的A值显著高于常氧低糖实验组(P<0.01,图4),证明了在低氧条件下,骨骼肌卫星细胞的增殖程度会增加。而在最近的研究中在2%和20%的氧环境下,观察了 Myod、Myf5和CD34的表达,低氧环境下的表达均高于常氧环境下的表达,也应证了本实验的结果[32]。一方面,细胞在低氧环境下会抑制氧化磷酸化水平,ATP的生成主要依赖加快糖酵解速度来实现。细胞会上调与糖酵解有关酶和葡萄糖转运蛋白的表达来适应这种转变。主要是抑制细胞内脯氨酸残基的羟化酶作用,后者使脯氨酸残基羟化,产生低氧诱导因子(Hypoxia Inducible Factor,HIF),使细胞对低氧环境产生适应,降低细胞的氧消耗,且HIF可以调节葡萄糖的摄取,增加蛋白质的合成,促进细胞的增殖[27]。具体 HIF促进骨骼肌卫星细胞的增殖的调节途径需要后续研究来证明。另一方面,Notch信号传寻途径在对骨骼肌卫星细胞的增殖与分化起着重要的作用[14],同时,还受到环境氧分压(ambient oxygen tension)的调节[2,5]——主要体现在:低氧通过激活Notch信号传导途径,上调表达Pax7,同时下调miR-1和miR-206的表达,加快骨骼肌卫星细胞的自我更新速率。在此基础上可以认为,在骨骼肌损伤或者衰老之后,能够通过加强低氧暴露来促进骨骼肌的再生和修复。在Gustafsson等人的研究中发现,低氧会通过激活Notch或者Pax7信号通路来使成肌细胞维持在未分化状态[14]。虽然说抑制细胞分化未必一定促进细胞增殖,但是基于Pax7的表达上调和Myod以及肌细胞生成素的表达下调来看[18-19],低氧确实可以使骨骼肌卫星细胞在分化抑制状态下进一步增殖。由此得出,低氧环境可以调节骨骼肌卫星细胞静息与分化状态的平衡,促进细胞的不对称分裂。研究表明,葡萄糖浓度可能是一个调节细胞氧化还原的重要因素[28-29]。能够有效地通过磷酸戊糖途径 (pentose phosphate pathway,PPP)来调节细胞的生长[3],而 PPP在低氧环境下比常氧环境下更容易被激活[13]。也有可能低氧会使生肌调节因子MyoD和MRF上调,从而促进骨骼肌卫星细胞的增殖[8]。还有研究认为,G1/S期细胞通过磷酸化可以激活Akt信号,是各种不同类型的细胞在低氧条件下的适应和生存的机制之一[4],由此可以推测,该结论也同样适用于骨骼肌卫星细胞。衰老细胞的细胞周期常阻滞于 G1/S,尤其是 G1末期的限制性调控点“R”点[11,30],而降低氧浓度(1%)相对于常氧环境而言,可以通过升高细胞周期 G1/S转换调控因子——cyclin D1、cyclin E、cyclin A、CDK 2的水平来促进细胞增殖,同时降低细胞周期蛋白依赖性激酶抑制剂p27Kip1的水平[22]。这也能够解释在低氧和高糖的共同作用下,骨骼肌卫星细胞的增殖程度最为明显(表3)。
3.3 不同氧气浓度对骨骼肌卫星细胞释放LDH的影响
本实验在常氧和低氧环境中培养骨骼肌卫星细胞3h后,进行乳酸脱氢酶(LDH)细胞毒性检测实验[25]。
LDH是质膜完整性的常用标志物。试剂中的NAD+被 LDH 还原生成 NADH,NADH 和INT(2-p-iodophenyl-3-nitrophenyl tetrazolium chloride)被硫辛酰胺脱氢酶(diaphorase)催化反应生成 NAD+和强生色物甲臜(formazan),在490nm波长下产生吸收峰,从而可以通过比色来定量LDH的活性。A值与LDH活性成线性正相关。在低氧环境中培养3h后,LDH的测定结果显示,低氧低糖实验组的A值显著高于常氧低糖实验组(P<0.01),低氧高糖实验组的A值显著高于常氧高糖实验组(P<0.01),综合图4和图6的结果可以看出,可以认为,在相同葡萄糖浓度下,尽管低氧能够促进骨骼肌卫星细胞的增殖,但也会使骨骼肌卫星细胞的LDH释放量增加。有研究表明,低氧环境会导致细胞内ATP含量减少,当从低氧环境下转换到常氧环境之后,可以使降低的ATP水平恢复正常。然而,当细胞在低氧环境中暴露时间超过8h后,可能会导致ATP含量的不可逆减少,甚至引起细胞死亡[31]。LDH被释放的原因可能是在低氧环境的刺激下,细胞中的可用营养物质消耗加快,如葡萄糖等,细胞膜受到轻微刺激,但并未引起形态学上的细胞膜损伤时,可能导致LDH被释放到细胞膜外,当ATP被耗尽后,细胞膜的完整性被破坏[10,16],其中,细胞膜的损伤程度决定了 LDH 的释放量。在低氧条件下,由于糖酵解造成糖原减少,乳酸和无机磷在细胞内堆积。脂肪氧化不全使其中间代谢产物酮体增多,将引起细胞pH值下降。有研究表明,初始pH值为7.4的细胞在常氧环境(21%)和低氧环境(0.1%)分别培养1h后发现,pH值下降为7.08[21]。pH降低可引起磷脂酶活性增高,使溶酶体膜磷脂被分解,同时,内质网损伤以及蛋白质的合成障碍将进一步导致溶酶体膜损伤,细胞膜通透性增高,可能导致LDH的溢出释放到细胞质基质中。当细胞损伤严重时,甚至可能引起溶酶体肿胀、破裂,溶酶体酶释出,导致细胞内其他结构的损伤加重,细胞内含物释放至细胞外,将引起周围组织的炎症反应,甚至细胞坏死。由此看来,本实验将骨骼肌卫星细胞暴露在低氧中培养3h虽然引起了LDH的释放,但并未达到引起细胞膜损伤的刺激阈值,没有破坏骨骼肌卫星细胞膜的完整性。
4 结论
相同氧气浓度下,高葡萄糖浓度较低葡萄糖浓度的培养液更能促进骨骼肌卫星细胞的增殖。相同葡萄糖浓度下,低氧浓度可以促进骨骼肌卫星细胞的增殖。在两者共同干预骨骼肌卫星细胞生长时发现,高葡萄糖浓度、低氧浓度可促进骨骼肌卫星细胞的增殖,低氧浓度将引起骨骼肌卫星细胞的轻微损伤(或细胞膜通透性增加)。
限于本研究的条件所限,一些问题难以避免,在实验过程中也发现,需要进行更多的后续实验来进行完善和证明,包括:1)骨骼肌卫星细胞对葡萄糖浓度的依赖性是否存在线性关系,是否一味升高浓度均能促进其生长,抑或是存在一个较合适的促进增殖的浓度,并能够联系到在体情况下,例如糖尿病患者在发生骨骼肌损伤之后的修复过程的探讨及研究;2)葡萄糖引起骨骼肌卫星细胞增殖的信号转导途径只是通过一些研究的总结和分析之后进行了推导,未来研究需要进行进一步的确认;3)在氧气浓度降低到影响骨骼肌卫星细胞的正常生长之后,如何促进其恢复。
[1]吴嵽,陆耀飞.机械生长因子对骨骼肌卫星细胞激活的影响及与其增殖的量效关系[J].体育科学,2011,31(2):54-69.
[2]ACHARYYA S,SHARMA S M,CHENG A S,et al.TNF inhibits Notch-1in skeletal muscle cells by Ezh2and DNA methylation mediated repression:implications in duchenne muscular dystrophy[J].PLoS One,2010,5(8):e12479.
[3]ALMEIDA A,DELGADO-ESTEBAN M,BOLAÑOS J P,et al.Oxygen and glucose deprivation induces mitochondrial dysfunction and oxidative stress in neurones but not in astrocytes in primary culture[J].J Neurochemistry,2002,81(2):207-217.
[4]BEITNER-JOHNSON D,RUST R T,HSIEH T C,et al.Hypoxia activates Akt and induces phosphorylation of GSK-3in PC12cells[J].Cellular Signalling,2001,13(1):23-27.
[5]BRACK A S,CONBOY I M,CONBOY M J,et al.A temporal switch from notch to Wnt signaling in muscle stem cells is necessary for normal adult myogenesis[J].Cell Stem Cell,2008,2(1):50-59.
[6]CHAKRAVARTHY M V,DAVIS B S,BOOTH F W.IGF-I restores satellite cell proliferative potential in immobilized old skeletal muscle[J].J Appl Physi,2000,89(4):1365-1379.
[7]CHAKRAVARTHY M V,SPANGENBURG E E,BOOTH F W.Culture in low levels of oxygen enhances in vitro proliferation potential of satellite cells from old skeletal muscles[J].Cellular Molecular Life Sci CMLS,2001,58(8):1150-1158.
[8]CSETE M,WALIKONIS J,SLAWNY N,et al.Oxygen-mediated regulation of skeletal muscle satellite cell proliferation and adipogenesis in culture[J].J Cellular Physiol,2001,189(2):189-196.
[9]CSETE M.Oxygen in the cultivation of stem cells[J].Ann New York Academy Sci,2005,1049(1):1-8.
[10]DRENT M,COBBEN N A,HENDERSON R F,et al.Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation[J].Eur Respirat J,1996,9(8):1736-1742.
[11]DULIC V,DRULLINGER L F,LEES E,et al.Altered regulation of G1cyclins in senescent human diploid fibroblasts:accumulation of inactive cyclin E-Cdk2and cyclin D1-Cdk2complexes[J].Proceed National Academy Sci,1993,90(23):11034-11038.
[12]GAWLITTA D,LI W,OOMENS C W,et al.The relative contributions of compression and hypoxia to development of muscle tissue damage:an in vitro study[J].Ann Biomed Engineer,2007,35(2):273-284.
[13]GUPTE S A,OKADA T,MCMURTRY I F,et al.Role of pentose phosphate pathway-derived NADPH in hypoxic pulmonary vasoconstriction[J].Pulmonary Pharmacol Therapeutics,2006,19(4):303-309.
[14]GUSTAFSSON M V,ZHENG X,PEREIRA T,et al.Hypoxia requires notch signaling to maintain the undifferentiated cell state[J].Developmental Cell,2005,9(5):617-628.
[15]KIM Y H,HEO J S,HAN H J.High glucose increase cell cycle regulatory proteins level of mouse embryonic stem cells via PI3-K/Akt and MAPKs signal pathways[J].J Cellular Physiol,2006,209(1):94-102.
[16]LEIST M,SINGLE B,CASTOLDI A F,et al.Intracellular adenosine triphosphate(ATP)concentration:a switch in the decision between apoptosis and necrosis[J].J Exp Med,1997,185(8):1481-1486.
[17]LI T S,MARBÁN E.Physiological levels of reactive oxygen species are required to maintain genomic stability in stem cells[J].Stem Cells,2010,28(7):1178-1185.
[18]LIU W,WEN Y,BI P,et al.Hypoxia promotes satellite cell self-renewal and enhances the efficiency of myoblast transplantation[J].Development,2012,139(16):2857-2865.
[19]MAJMUNDAR A J,SKULI N,MESQUITA R C,et al.O2Regulates Skeletal Muscle Progenitor Differentiation through Phosphatidylinositol 3-Kinase/AKT Signaling[J].Molecular Cellular Biology,2012,32(1):36-49.
[20]STANLEY NAHMAN JR N,LEONHART K L,COSIO F G,et al.Effects of high glucose on cellular proliferation and fibronectin production by cultured human mesangial cells[J].Kidney Int,1992,41(2):396-402.
[21]PARKS S K,MAZURE N M,COUNILLON L,et al.Hypoxia promotes tumor cell survival in acidic conditions by preserving ATP levels[J].J Cellular Physiol,2013,228(9):1854-1862.
[22]POLYAK K,LEE M H,ERDJUMENT-BROMAGE H,et al.Cloning of p27Kip1,a cyclin-dependent kinase inhibitor and a potential mediator of extracellular antimitogenic signals[J].Cell,1994,78:59-66.
[23]RHOADS R P,JOHNSON R M,RATHBONE C R,et al.Satellite cell-mediated angiogenesis in vitro coincides with a functional hypoxia-inducible factor pathway[J].Am J Physiology-Cell Physiol,2009,296(6):C1321-C1328.
[24]RICHARDSON R S,NOYSZEWSKI E A,LEIGH J S,et al.Lactate efflux from exercising human skeletal muscle:role of intracellular[J].J Appl Physiol,1998,85(2):627-634.
[25]ROTH W,FONTANA A,TREPEL M,et al.Immunochemotherapy of malignant glioma:synergistic activity of CD95ligand and chemotherapeutics[J].Cancer Immunol,Immunotherapy,1997,44(1):55-63.
[26]SEALE P,RUDNICKI M A.A new look at the origin,function,and“stem-cell”status of muscle satellite cells[J].Developmental Biol,2000,218(2):115-124.
[27]SEMENZA G L.HIF-1:mediator of physiological and pathophysiological responses to hypoxia[J].J Appl Physiol,2000,88(4):1474-1480.
[28]SEO S Y,KIM E Y,KIM H,et al.Attenuation of neuronal death by NMDA and oxygen-glucose deprivation in cortical neurons maintained in high glucose[J].Ann New York Academy Sci,1999,893(1):396-399.
[29]SEO S Y,KIM E Y,KIM H,et al.Neuroprotective effect of high glucose against NMDA,free radical,and oxygen-glucose deprivation through enhanced mitochondrial potentials[J].J Neurosci,1999,19(20):8849-8855.
[30]SMITH J R,PEREIRA-SMITH O M.Replicative senescence:implications for in vivo aging and tumor suppression[J].Sci,1996,273(5271):63-67.
[31]STEINBACH J P,WOLBURG H,KLUMPP A,et al.Hypoxiainduced cell death in human malignant glioma cells:energy deprivation promotes decoupling of mitochondrial cytochrome c release from caspase processing and necrotic cell death[J].Cell Death Differentiat,2003,10(7):823-832.
[32]URBANI L,PICCOLI M,FRANZIN C,et al.Hypoxia increases mouse satellite cell clone proliferation maintaining both in vitro and in vivo heterogeneity and myogenic potential[J].PloS one,2012,7(11):e49860.
[33]VANDER HEIDEN M G,PLAS D R,RATHMELL J C,et al.Growth factors can influence cell growth and survival through effects on glucose metabolism[J].Molecular Cellular Biol,2001,21(17):5899-5912.

