有氧运动和白藜芦醇对肥胖大鼠主动脉内皮细胞内分泌功能的影响
曹 姣,宋德军,肖国强
大量研究表明,高脂饮食可引起机体脂代谢紊乱,脂质异常堆积,肥胖产生[1,3,5]。高游离脂肪酸(FFA)可引起机体氧化应激,而血高FFA和氧化应激是血管内皮功能异常的重要诱因,并且长期高脂饮食可抑制血管内皮细胞一氧化氮合酶的表达,NO生成减少,造成血管内皮细胞功能异常,引起血管内皮系统功能紊乱[14]。由此可见,高脂饮食对于血管内皮功能的危害相当严重,寻求有效的改善方法是当今研究的重中之重。
以往实验表明,有氧运动能改善机体脂代谢紊乱、氧化应激[2,8]及血管内皮功能[7],然而对高脂饮食引起的主动脉的内皮功能紊乱及相关机制的研究未见报道。白藜芦醇(Res)作为最近几年医学领域的新生药物备受瞩目,其是否能对高脂饮食大鼠主动脉内皮功能起作用尚不清楚。并且将运动和Res联合干预高脂饮食大鼠是否存在叠加效应?尚未被研究。因此,本研究选取有氧运动和Res干预方式,探讨其对高脂饮食所致的脂代谢紊乱、主动脉内皮细胞内分泌功能异常的影响及相关机制,旨在为高脂饮食所致心血管相关疾病的防治提供新的思路。
1 材料与方法
1.1 实验动物
2月龄SPF级雄性SD大鼠均选自广州中医药大学动物实验中心,体重180±20g。大鼠适应性喂养2周后进行随机分组,适应性喂养期间所有大鼠喂以普通饲料,实验期间动物房进行自然光照,房间温度保持25℃左右,湿度为50%。实验期间大鼠自由饮食饮水,正常饮食对照组进行固体普通饲料喂养,高脂饮食模型组进行固体高脂饲料喂养。
高脂饲料具体成分为:5%蔗糖,18% 猪油,15%蛋黄粉,0.5%胆酸钠,1%胆固醇,60.5%基础饲料。其按能量比例计算:其中脂肪提供的能量占58.3%、5%蔗糖、蛋白质占21%、碳水化合物占20.5%。
1.2 实验分组和肥胖模型构建
所有大鼠适应性喂养2周后,随机分为正常饮食对照组(NC组,7只)和高脂组(H组,33只)。高脂组大鼠进行为期16周的高脂饮食喂养构建肥胖大鼠模型,之后随机分成安静组(HF组,8只),有氧运动组(HE组,8只),白藜芦醇干预组(HR组,8只),有氧运动联合白藜芦醇干预组(RE组,9只)。
1.3 运动方案
运动干预组大鼠进行跑台运动训练,首先适应性运动1周,前3天跑台速度为5m/min,之后每天增加5m/min,最后保持在15m/min,每次运动30min。之后参考Bed-ford的经典跑台运动方案[12]。采用中等强度跑台训练,速度15m/min,相当于50%˙VO2max负荷强度。每天9:30开始运动训练,每次运动1h,5天/周,共计6周。
1.4 白藜芦醇灌胃方案
大鼠称重后按照40mg/kg的剂量称量Res,按照每只大鼠1ml的溶液量将Res溶于双蒸水中,形成混合溶液后进行灌胃[18],每周7天,共计6周。
1.5 取材与保存
大鼠处理前禁食12h,经10%水合氯醛(0.35~0.40 ml/kg)腹腔注射麻醉后剪开腹腔进行腹主动脉取血,置于抗凝管中静置10min左右,于高速离心机内,4℃、3 500 rpm离心15min,制备血清,按组标记放于-80℃冰箱中保存待测。之后,打开胸腔取主动脉,一份置于10%甲醛溶液中进行固定,另一份以锡纸标记包好放于液氮中速冻后转入-80℃冰箱中冷存待测。
1.6 测试指标及检测方法
血清甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)和血清游离脂肪酸(FFA)购自南京建成生物工程研究所。采用比色法测试;主动脉eNOS、ET-1检测采用免疫组织化学法测试,试剂盒购自博士德生物工程有限公司。测试步骤参照相关文献[9]。主动脉 NOS(T-NOS,cNOS和iNOS)采用比色法,NO采用硝酸还原酶法,主动脉SOD采用黄嘌呤氧化酶法测定,MDA采用硫代巴比妥酸法测定。
1.7 统计学处理
应用CK40-F2000型显微镜观察主动脉切片,每张切片随机选取5个视野,400倍光镜下观察记录5组大鼠主动脉血管eNOS和ET阳性细胞染色情况,使用Image-Pro-Plus图像处理软件进行图像采集与分析,分析结果以染色平均光密度值表示。
所得数据应用SPSS 16.0和Excel 2003统计软件进行处理,采用双因素方差分析和配对样本t检验进行统计学分析,结果以“平均数±标准差”(±S)来表示,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 各组大鼠体重变化
如图1所示,各组大鼠体重随时间的延长逐渐增加,但各组大鼠体重增长速度和增加幅度存在差异性。由图可知,16周高脂饮食后结果显示(0周),与NC组比较,其余各组体重均显著性升高(P<0.05)。在实验干预期间,各周高脂安静组体重较其余各干预组对应周大鼠体重均显著性升高(P<0.05),而RE组较 HR组、HE组有进一步降低的趋势。
2.2 各组大鼠血清脂代谢指标变化
如表1所示,与 NC组比较,HF组 TG、TC、LDL-c和FFA均非常显著升高(P<0.01),HDL-c显著降低(P<0.05)。与 HF组比较,HE组、HR 组、RE组大鼠 的 TG、TC、LDL-c和FFA显著性降低(P<0.05或P<0.01),HDL-c显著性升高(P<0.05)。
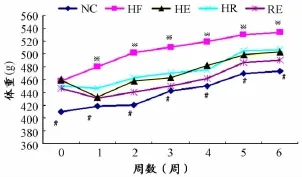
图1 本研究各组大鼠体重变化曲线图Figure 1. Changes of Weight between Each Group
表1 本研究各组大鼠血清脂代谢各指标变化一览表Table 1 Changes of Serum Lipid Metabolism between Each Group (±S)

表1 本研究各组大鼠血清脂代谢各指标变化一览表Table 1 Changes of Serum Lipid Metabolism between Each Group (±S)
注:与NC组比较,#P<0.05,##P<0.01;与HF组比较,*P<0.05,**P<0.01。
组别 TG(mmol/l) TC(mmol/l) HDL-c(mmol/l) LDL-c(mmol/l) FFA(μmol/l)NC 0.45±0.13 1.36±0.33 0.41±0.10 0.26±0.06 313.09±23.09 HF 1.55±0.21## 5.09±0.24## 0.32±0.07# 1.88±0.13## 627.19±97.89##HE 0.80±0.39#* 4.06±0.18#* 0.38±0.08#* 0.38±0.08#* 558.22±68.12##**HR 0.92±0.55#** 4.32±0.46# 0.39±0.09#* 0.39±0.22* 578.01±73.23##*RE 0.77±0.61** 4.00±0.33** 0.40±0.09#* 0.32±0.31** 402.37±56.89##**
2.3 各组大鼠主动脉内皮细胞内分泌功能的变化
2.3.1 各组大鼠主动脉ET-1表达的变化
如图2(箭头所指为阳性细胞表达)和表2所示,NC组ET-1表达最弱,阳性细胞少且染色浅,HF组ET-1表达量最多,染色深。与HF组相比,HE和HR组ET-1表达量均有所下降,仍有深棕色颗粒物质表达,其中HE组呈非常显著性差异(P<0.01),HR组呈显著性差异(P<0.05),联合干预呈现叠加效应(RE组)。
2.3.2 各组大鼠主动脉NO含量的变化
如表3所示,与NC组相比较,HF组大鼠主动脉NO含量非常显著降低(P<0.01)。HE组、HR组和RE组大鼠主动脉NO含量较HF组均非常显著升高(P<0.01),RE组较HF组呈显著性升高(P<0.05)。

图2 本研究各组大鼠主动脉ET-1表达的变化组织切片图Figure 2. Changes of ET-1in Aorta between Each Group
表2 本研究各组大鼠主动脉ET-1阳性表达的变化一览表Table 2 Changes of ET-1in Aorta between Each Group (±S)

表2 本研究各组大鼠主动脉ET-1阳性表达的变化一览表Table 2 Changes of ET-1in Aorta between Each Group (±S)
注:与NC组比较,#P<0.05,##P<0.01;与 HF组比较,*P<0.05,**P<0.01。
NC HF HE HR RE ET(Mean Density) 0.25±0.03 0.39±0.04## 0.31±0.02#** 0.33±0.05##* 0.28±0.12#**指标
表3 各组大鼠主动脉NO含量的变化一览表Table 3 Changes of NO Content in Aorta between Each Group (μmol/gprot,±S)

表3 各组大鼠主动脉NO含量的变化一览表Table 3 Changes of NO Content in Aorta between Each Group (μmol/gprot,±S)
注:与NC组比较,#P<0.05,##P<0.01;与 HF组比较,*P<0.05,**P<0.01。
指标NC HF HE HR RE NO 202.34±11.46 150.21±7.72## 176.61±9.07##** 170.18±8.10##** 183.43±7.02##*
2.3.3 各组大鼠主动脉NOS活性的变化
如表4所示,与NC组比较,HF组大鼠主动脉T-NOS和cNOS活性显著降低(P<0.01),iNOS活性显著升高(P<0.01)。与HF组比较,HE组、HR组和RE组大鼠主动脉T-NOS和cNOS活性均非常显著升高(P<0.01),iNOS活性非常显著降低(P<0.01),其中,RE组 T-NOS和cNOS活性值均为最高,iNOS活性最低,呈现叠加效应。
表4 本研究各组大鼠主动脉T-NOS及cNOS、iNOS活性变化一览表Table 4 Changes of T-NOS,cNOS and iNOS Activity in Aorta between Each Group (U/mgprot.,±S)

表4 本研究各组大鼠主动脉T-NOS及cNOS、iNOS活性变化一览表Table 4 Changes of T-NOS,cNOS and iNOS Activity in Aorta between Each Group (U/mgprot.,±S)
注:与NC组比较,#P<0.05,##P<0.01;与 HF组比较,*P<0.05,**P<0.01。
NC HF HE HR RE T-NOS 6.04±0.32 3.09±0.31## 4.79±0.25##** 4.19±0.31##** 5.17±0.19##**cNOS 4.75±0.22 0.22±0.18## 2.76±0.25##** 2.02±0.28##** 3.34±0.04##**iNOS 1.29±0.14 2.85±0.27## 2.03±0.17##** 2.18±0.23##** 1.83±0.16##*
2.3.4 各组大鼠主动脉eNOS活性的变化
如图3(箭头所指为阳性细胞表达)和表4所示,NC组eNOS表达量最多,染色较深,HF组阳性细胞表达最少。与HF组相比,HE组和HR组eNOS表达量均显著升高(P<0.05或P<0.01)。RE组eNOS表达量明显增多,阳性细胞表达排列整齐,出现叠加效应。
2.4 各组大鼠主动脉氧自由基代谢的变化
如表6所示,与NC组比较,HF组SOD活性呈非常显著性降低(P<0.01),MDA含量非常显著性升高(P<0.01)。与HF组比较,HE组、HR组和RE组大鼠主动脉SOD活性显著升高(P<0.05或P<0.01),MDA含量呈非常显著降低(P<0.01)。
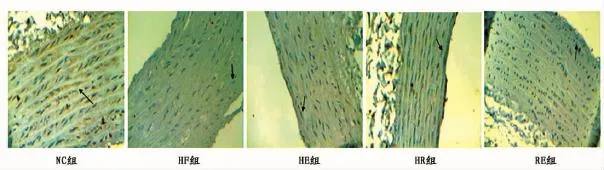
图3 本研究各组大鼠主动脉eNOS活性的变化组织切片图Figure 3. Changes of eNOS Activity in Aorta between Each Group
表5 本研究各组大鼠eNOS的阳性表达变化一览表Table 5 Changes of eNOS Positive Expression in Aorta between Each Group (±S)

表5 本研究各组大鼠eNOS的阳性表达变化一览表Table 5 Changes of eNOS Positive Expression in Aorta between Each Group (±S)
NC HF HE HR RE eNOS(mean Density) 0.52±0.13 0.35±0.08## 0.43±0.02#** 0.41±0.07##* 0.46±0.12#**
表6 本研究各组大鼠主动脉SOD活性、MDA含量的变化一览表Table 6 Changes of SOD Activity and MDA Content in Aorta between Each Group (±S)

表6 本研究各组大鼠主动脉SOD活性、MDA含量的变化一览表Table 6 Changes of SOD Activity and MDA Content in Aorta between Each Group (±S)
注:与NC组比较,#P<0.05,##P<0.01;与 HF组比较,*P<0.05,**P<0.01。
NCHFHEHRRE SOD(U/mg.prot) 147.94±6.25 107.13±6.45## 130.57±5.62##** 127.02±6.86##** 138.51±5.08#*MDA(nmol/mg.prot) 3.08±0.46 8.08±0.42## 5.15±0.45##** 5.79±0.26##** 4.04±0.37#**
3 讨论
3.1 有氧运动和Res对肥胖大鼠体重、血脂的影响
运动健身防病的作用越来越引起人们的重视,常被作为辅助性疗法用于各种疾病的预防与治疗中[11]。Res具有抗氧化[13]、抗炎、降低血脂[23]等效应。本研究通过16周的高脂饮食成功构建营养型肥胖大鼠模型,表现为体重增加、血脂异常、氧化应激增加等特征。本实验结果显示,经过6周的干预后,联合干预组(RE组)大鼠血清TG、TC、LDL-c和FFA均明显低于 HE组和 HR组,HDL-c高于HE组、HR组,表明联合干预改善肥胖大鼠脂代谢紊乱优于单独干预,其原因可能为有氧运动和Res联合干预存在量的积累,较单一干预更好的动员脂肪代谢供能,促进脂类物质的分解代谢,并且FFA作为运动时肌肉的能源物质也可促进脂类物质的分解[17]。
3.2 有氧运动和Res对肥胖大鼠主动脉内皮细胞内分泌功能的影响
NO是内皮细胞产生的最为重要的血管内皮舒张因子,ET-1是由血管内皮细胞以自分泌或旁分泌方式释放的作用最强的缩血管物质,通过与特异性受体结合,在局部以多种途径发挥强烈收缩血管作用及刺激血管平滑肌细胞肥大、增殖的作用,NO/ET-1比例失衡可导致血管内皮细胞损伤,这种结构性改变也是心血管疾病,如动脉粥样硬化的先行预兆。一氧化氮合酶(NOS)是NO生成的关键限速因子,根据其亚型的不同可分为:神经型一氧化氮合酶(nNOS,主要表达于神经元和骨骼肌)和内皮型一氧化氮合酶(eNOS,主要表达于内皮细胞)合称为结构型一氧化氮合酶(cNOS),诱导型一氧化氮合酶iNOS主要由巨噬细胞和巨噬细胞/单核细胞谱系的细胞表达[27]。
高脂饮食与体力活动减少是近几年最为常见的不良生活方式[4],长期高脂饮食可引起机体肥胖、脂代谢紊乱,Nepal等[24]、Lammert等[10]研究发现,血脂异常可导致血管内皮损伤,包括高胆固醇血症、脂蛋白-α的异常增高等,降低内皮细胞产生的NO含量,导致内皮功能受损。本实验结果显示,与NC组大鼠相比,HF组大鼠主动脉ET-1表达显著增加而NO、eNOS表达降低,同时iNOS表达增加,提示长期高脂饮食喂养导致大鼠血管内皮功能紊乱。适度运动可降低大鼠主动脉损伤所引起的ET-1含量升高[21]。 另 有 研 究 指 出[6,25],有 氧 运 动 可 通 过 降 低 LDL 含量,即通过改善脂代谢,降低脂质氧化产物的生成来减少ET-1生成,从而阻止其对血管内皮细胞的损伤。本实验结果显示,有氧运动组大鼠iNOS表达、ET-1表达明显较HF组降低(P<0.01),即6周有氧运动能显著降低长期高脂饮食所致肥胖大鼠主动脉ET-1和iNOS的表达,提高eNOS的活性表达,增加NO含量,表明有氧运动能有效改善高脂饮食所致的肥胖大鼠主动脉内皮细胞内分泌功能紊乱。其原因可能与有氧运动能较好的影响心脏血流动力学、提高抗氧化能力、预防缺血性损伤有关,最终改善心血管系统功能[19]。
Res作为葡萄中含量较高的多酚类化合物发挥重要的心血管保护作用,美国已将其作为膳食添加剂用于心血管疾病的预防治疗。Li等[20]通过Res干预脐静脉内皮细胞实验发现,Res可以通过明显激活K+-Ca2+通道,增加NOS活性,促进NO生成释放。朱立贤等人[9]对高脂血症大鼠施以4周Res灌胃干预,结果发现,Res可明显降低血清iNOS活性及由iNOS催化生成的NO量,提高eNOS活性,调节NO水平。本实验结果显示,Res干预组大鼠主动脉eNOS表达和T-NOS较HF组明显升高,NO产生量增加,ET-1和iNOS表达量下降。由此表明,Res能改善长期高脂饮食所致肥胖大鼠的主动脉内皮功能异常。其原因可能为Res通过清除脂质过氧化产物以减少LDL-c的氧化,减弱NO抑制作用,从而使NO含量升高,抑制脂质过氧化,减弱内皮细胞的氧化损伤[23]。
目前针对主动脉内皮功能的研究多集中在离体细胞研究、血液指标测定等,本实验选取主动脉各指标判定有氧运动和Res单独及两者联合干预对肥胖大鼠主动脉内皮功能的改善作用,更加客观直接的体现对于主动脉内皮细胞内分泌功能的改善效果。本实验结果显示,有氧运动和Res单独干预均可明显改善高脂饮食所致的肥胖大鼠主动脉内皮功能,eNOS活性增强,NO产生量增加,iNOS和ET-1表达量显著下降,并且联合干预优于单独干预,呈现叠加效应,其原因可能为多途径参与eNOS活性提高,NO的含量增加及其生物活性提高,减少内皮毒性物质的生成而发挥作用[16]。
3.3 有氧运动和Res对肥胖大鼠主动脉氧自由基代谢的影响
在既往的研究中,参与内皮细胞内分泌功能进展的因素包括血流动力学失调、纤溶能力的受损、生长因子过度产生、粘附因子和炎症基因表达增加,细胞层的渗透增加以及ROS的产生增加中的一种或多种因素[16,22]。然而肥胖大鼠的主动脉中内皮细胞内皮功能紊乱是否与氧化应激加强同时存在尚不清楚。
MDA是判定脂质过氧化水平和氧化损伤程度的重要指标,SOD是机体消除自由基的最为重要的抗氧化酶,两者共同用于衡量机体的氧化应激水平。本实验结果显示,肥胖模型组大鼠主动脉SOD活性降低,MDA含量明显升高,表明高脂饮食大鼠主动脉脂质过氧化产物生成增加,体内自由基含量升高,氧化-抗氧化系统代谢失衡,出现氧化应激,这与国外研究结果相一致[17],参与了内皮功能紊乱发生。
有氧运动可提高大鼠血液抗氧化能力,降低脂质过氧化,减少自由基对机体的损害[8]。本实验结果显示,与HF组比较,HE组大鼠主动脉SOD活性非常显著升高(P<0.01),MDA含量显著降低(P<0.01),表明有氧运动可显著提高高脂饮食大鼠主动脉的抗氧化酶活性,使机体抗氧化能力保持在较高水平,增强脂质过氧化产物的代谢能力,进一步提高自由基代谢清除能力,改善主动脉氧化应激,减弱氧化损伤,提高主动脉NO的生物利用率,保护内皮功能。
Res能提高骨骼肌、心肌、肝脏等各组织的抗氧化酶活性,降低脂质过氧化水平,清除过量自由基,延缓机体氧化应激[18],但Res对于高脂饮食所致大鼠主动脉氧化应激影响如何尚不清楚。本实验结果显示,Res干预后大鼠主动脉SOD活性明显升高,MDA含量降低,提示Res可增强主动脉抗氧化能力,减少氧化代谢产物生成,对受自由基攻击的细胞起保护作用。可能与Res能提高SIRT1的含量和活性[15],提高机体的抗氧化能力有关,最终降低主动脉ET-1含量,提高NO含量。
由此可见,有氧运动和Res单独干预均能提高肥胖大鼠主动脉SOD活性,降低MDA含量,而联合干预优于单独干预,提示两者联合干预对于提高高脂饮食所致肥胖大鼠主动脉抗氧化酶活性,增强自由基清除能力具有叠加效应,最终增加主动脉中的NO含量,提高NO的生物利用率,降低ET-1的含量,保护主动脉内皮细胞内分泌功能。
4 结论
有氧运动和Res能较好的改善肥胖大鼠脂代谢异常,改善高脂饮食所致的主动脉氧化应激引起的内皮细胞内分泌功能紊乱,并且联合干预优于单一干预,具有叠加效应。
[1]李庆雯,黄力平,王慧,等.有氧运动对高脂饲料喂养大鼠血脂及骨骼肌PPARα、ABCA1及Apo AI mRNA表达的影响[J].中国运动医学杂志,2009,28(2):174.
[2]刘洪珍.有氧运动锻炼对人体自由基代谢及其相关酶系的影响[J].中国运动医学杂志,2001,20(4):425-427.
[3]孙婧瑜,漆正堂,丁树哲.FAT/CD36、AMPK 和PGC-1α在运动干预高脂饮食性肥胖中的作用机制[J].中国运动医学杂志,2013,32(2):174-177.
[4]童俊露,王佑民.生活方式对高脂肥胖大鼠 APPL1和GLUT4的影响[J].安徽医科大学学报,2012,47(12):1393-1396.
[5]王先西,赵秀华,王峰,等.高脂饮食引起大鼠动脉血管内皮细胞衰老[J].国际病理科学与临床杂志,2010,30(2):118-122.
[6]吴翊馨,张海平,李秋萍.有氧运动对高胆固醇血症小鼠血浆内皮素及血脂的影响[J].沈阳体育学院学报,2006,25(4):50-51.
[7]张靓,黄叔怀.不同运动负荷对大鼠cNOS和iNOS活性的影响及其机理探讨[J].中国运动医学杂志,2002,21(1):23-26.
[8]张晓华,李世昌.有氧耐力训练对大鼠血液脂质过氧化和抗氧化能力的影响[J].宜宾科技,2009,(2):26-30.
[9]朱立贤,金征宇.白藜芦醇对高脂血症大鼠血脂和一氧化氮及其合酶的影响[J].安徽农业科学,2005,33(2):278-279.
[10]AKEXABDER LAMMERT,TILL HASENBERG,INGA IMHOF,et al.High prevalence of retinal endothelial dysfunction in obesity WHO class III[J].Microvascular Res,2012,84:362-366.
[11]BE LEVIN,AA DUNN-MEYNEL.Differential effects of exercise on body weight gain and adiposity in obesity-prone and re-sistant rats[J].Int J Obesity,2006(30):722-727.
[12]BEDFORD T G,TIPTON C M,WILSON N C,et al.Maximum oxygen consumption of rats and its changes with vanous experimental procedures[J].Appl Physiol,1979,47(6):1278-1283.
[13]BHATT S R,LOKHANDWALA M F,BANDAY A A.Resveratrol prevents endothelial nitric oxide synthase uncoupling and attenuates development of hypertension in spontaneously hypertensive rats[J].Eur J Pharmacol,2011,667(1-3):258-264.
[14]CHARLOTTE A PRATT.Lipoprotein lipase and triglyceride in skeletal and cardiac muscles of rats fed lard or glucose[J].Nutr Res,1989,9(1):47-55.
[15]COSTA CDOS S,ROHDEN F,HAMMES TO,et al.Resveratrol upregulated SIRT1,FOXO1,and adiponectin and downregulated PPARγ1-3mRNA Expression in human visceral adipocytecytes[J].Obes Surg,2011,21(3):356-361.
[16]CRISTINA M SENA,ANA M PEREIRA,RAQUEL SEICA.Endothelial dysfunction-A major mediator of diabetic vascular disease[J].Biochimicaet Biophysica Acta,2013,18(32):2216-1131.
[17]DOBRIAN A D,DAVIES M J,SCHRIVER S D,et al.Oxidative stress in a rat model of obesity-induced hypertension[J].Hypertension,2001,37:554-560.
[18]GOMEZ-ZORITA S,FEMANDEZ-QULNTELA A,MACAMLLA MT,et al.Resveralrol attenuates steatosisin obese Zucker rats by decreasing fatty acid availability and reducing oxidative stress[J].Bri J Nutr,2011,107(2):202-210.
[19]JULIANE C CAMPOS,KATIA M S GOMES,JULIO C B.Ferreira impact of exercise training on redox signaling in cardiovascular diseases[J].Food Chemical Toxicol,2013,62:107-119.
[20]LI HF,CHEN SA,WU SN.Evidence for the stimulatory effect of resveratrol on Ca2+-cativated K+current in vascular endothelial cells[J].Cardiovascular Res,2000,45:1035-1045.
[21]LISA A LESNIEWSKI,MELANIE L ZIGLER,JESSICA R DURRANT,et al.Aging compounds western diet-associated large artery endothelial dysfunction in mice:Prevention by voluntary aerobic exercise[J].Exp Gerontol,2013,48:1218-1225.
[22]M H LAUGHLIN,S C NEWCOMER,S B BENDER.Importance of hemodynamic forces as signals for exercise-induced changes in endothelial cell phenotype[J].J Appl Physiol,2008,104:588-600.
[23]RICERA L,MORON R,ZARZUELO A,et al.Long-term resveratrol administration reduces metabolic disturbances and lowers blood pressure in obese Zucker rats[J].Biochem Pharmacol,2009,77(6):1053-1063.
[24]SAROI NEPAL,SALMA MALIK,ASHOK KUMAR SHARMA,et al.Abresham ameliorates dyslipidemia,hepatic steatosis and hypertension in high-fat diet fed rats by repressing oxidative stress,TNF-a and normalizing NO production[J].Experimental Toxicol,Pathol,2012,64:705-712.
[25]SHAODONG C,HAIDONG Z,MANTING L,et al.Research of influence and mechanism of combining exercise with diet control on a model of lipid metabolism rat induced by high fat diet[J].Lipids Health Dis,2013,12:21.
[26]WALLERRATH T,LI H,GODTEL-AMBRUST U,et al.A blend of poly-phenolic compounds explains the stimulatory effect of red wine on human endothelial NO synthase[J].Nitric Oxide,2005,12:97-104.
[27]WENDY K ALDERTON,CHRIS E COOPER,RICHARD G.KNOWLES.Nitric oxide synthases:structure,function and inhibition[J].Biochem J,2001,357:93-615.

